肝移植術后早期發生胰島素抵抗的危險因素
孫聚珊,王智鵬,曹助,張龍華,白磊,李濤,趙晉明,何翼彪
(新疆醫科大學第一附屬醫院 消化血管外科中心/肝臟·腹腔鏡外科,新疆 烏魯木齊 830054)
自1963 年Starzl教授首次實施了全世界首例原位肝移植手術(liver transplantation,LT)以來,LT逐漸成為治療各種終末期肝病唯一有效的方法[1],目前手術成功率已高達90%,術后1年生存率也達到了90%,術后5年生存率也接近70%[2]。隨著受體存活時間的逐漸延長,LT術后的一些并發癥開始困擾著廣大的臨床醫師,如移植物失去功能、血管并發癥、膽道并發癥、代謝并發癥。而代謝并發癥中包括了糖尿病、肥胖、高脂血癥、骨質疏松等[3],其中LT術后糖代謝紊亂發生率較高,大約30%~50%的受體無需胰島素處理短期內恢復正常。部分受體術后1個月內需使用胰島素控制血糖,后期血糖可自主恢復正常,此類受體稱為一過性高血糖(transient-high glucose,T-HG);部分轉化為不可逆的術后新發糖尿病(new-onset diabetse mellitus,NODM)[4]。無論是T-HG還是NODM都是術后發生胰島素抵抗(insulin resistent,IR)的結果,LT術后IR增加了心血管疾病、感染和移植物失功的風險,甚至增加了受者的病死率。目前關于NODM危險因素的研究報道較多,但關于術后IR的研究較少,本研究的主要目的是分析IR的危險因素,為術后糖代謝紊亂的診治提供新的思路。
1 資料和方法
1.1 肝移植受體資料及納入與排除標準
本研究為單中心回顧性病例分析,選取2016年1 月至2021 年6 月于新疆醫科大學第一附屬醫院行LT的受體。納入標準:(1)首次行LT的受體;(2)受體年齡≥18歲;(3)隨訪時間>1個月;(4)術后有規律穩定的免疫抑制劑治療方案。排除標準:(1)術后24 h內死亡;(2)術前患有糖尿病;(3)在其他移植中心移植后于我科隨訪的受體;(4)自體LT;(5)多臟器聯合移植。共有46例納入本研究。所有的LT手術由相同外科團隊實施,手術方式為背駝式LT或原位LT,膽道重建采取端端吻合的方式。本研究收集的數據包括受體術前一般資料、術后1 個月內的檢驗結果,出院后隨訪內容為血糖、血藥濃度、炎癥指標。本研究符合赫爾辛基宣言的倫理準則,在涉及人類參與者的研究中執行的所有程序都符合倫理制度審查委員會的倫理標準(K202106-01)。
1.2 IR的診斷標準
T-HG定義為術后1個月內血糖高于正常值,后期無需胰島素及降糖藥物控制,血糖可自主恢復正常。臨床上常用的是2003年ADA和WHO的診斷標準:出現糖尿病癥狀,且隨機血糖(random plasma glucose,RPG)≥11.1 mmol/L或快速血糖(fasting plasma glucose,FPG)≥7.0 mmol/L;或口服糖耐量實驗(oral glucose tolerance test,OGTT)檢測2 h血糖值≥11.1 mmol/L,以上數值需兩次檢測予以證實,NODM診斷方可成立。按照血糖濃度分為正常對照組和IR組(T-HG組、NODM組)。
1.3 免疫抑制藥物方案
所有受體在LT術后常規免疫抑制治療采用鈣調磷酸酶抑制劑(TAC)+驍悉(MMF)+激素三聯用藥,術后48 h內開始服用TAC 0.15 mg·kg-1·d-1,MMF 1 500 mg/d,bid;術中開放門靜脈前靜脈推注甲強龍500 mg,術后第2至7天分別為240、200、160、120、80、40 mg,然后改為口服強的松,起始劑量20 mg/d,每10日遞減5 mg,直至停藥;術后早期抗感染采用頭孢類抗生素;術后早期3~5 d常規預防性使用抗真菌及抗病毒藥物預防感染;口服拉米夫定/恩替卡韋預防乙型肝炎復發。
1.4 統計學分析
2 結果
2.1 正常對照組與IR組受體基線資料
46 例受體中,共有31 例(67.39%)術后發生了IR,其中17例受體發展為不可逆的NODM(36.96%),公民逝世后器官捐獻(DCD 移植)的受體26 例(56.52%),單因素分析中有5個變量與IR顯著相關,分別為受體的年齡(P=0.008)、熱缺血時間(warm ischemia time,WIT)(P=0.004)、ALT(P=0.034)、術前FBG(P=0.045)、BMI(P=0.008)、術前IL-6(P=0.008)。其余變量在兩組間無明顯統計學差異。見表1。
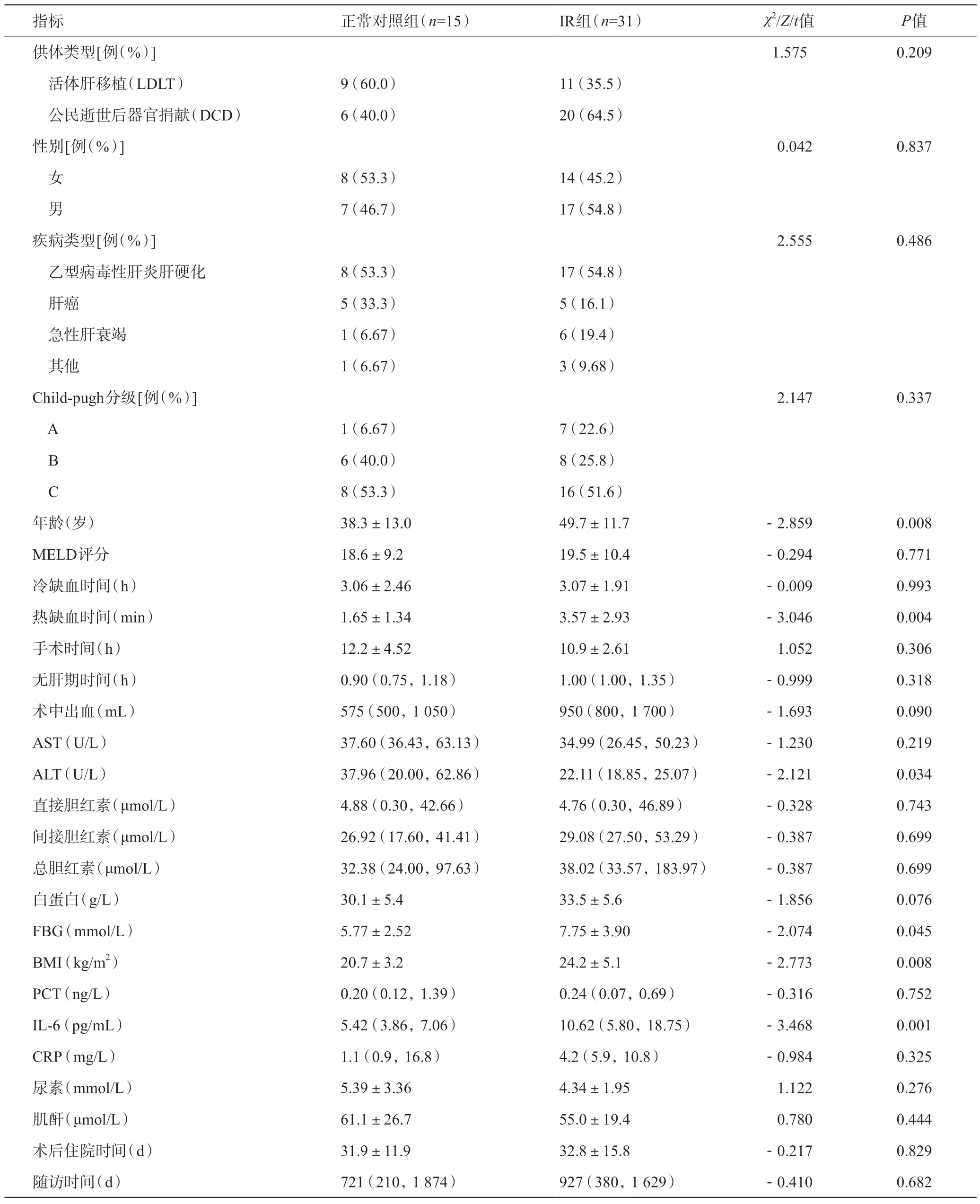
表1 正常對照組和IR組受體術前基線資料
2.2 T-HG組與NODM組受體基線資料
對T-HG組和NODM組受者基線特征進行了比較,發現乙型病毒性肝炎肝硬化、高齡、BMI較高的受體及接受DCD供肝的受體術后發生NODM的風險更高(P<0.05);NODM組隨訪時間高于T-HG組(P<0.05),其余變量在兩組間無明顯統計學差異。見表2。
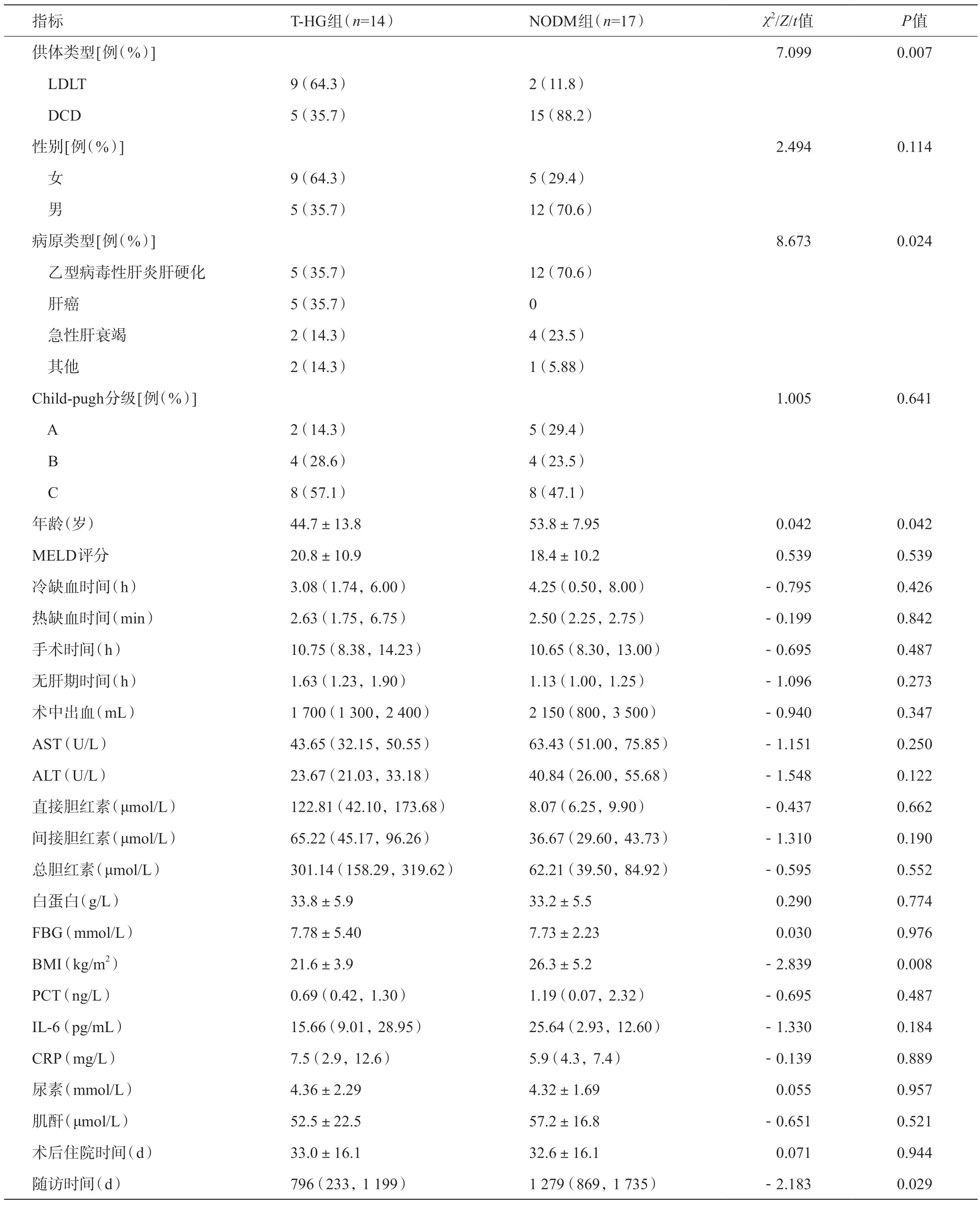
表2 T-HG組和NODM組受體術前基線資料
2.3 IR相關多因素Logistic回歸
將表1 中單因素分析中有意義的指標納入多因素Logistic回歸分析中,表3顯示WIT每增加1 min,發生IR的風險是原來的3.175 倍(OR3.175;95%CI0.641~1.670,P=0.025)。Logit(P)=-14.095+0.0735×年齡+1.155×WIT+0.271×FBG+0.267×BMI+0.069×IL-6,并繪制ROC曲線(AUC=0.771,95%CI0.667~0.875),同時構建校準曲線,證明模型擬合效果好,誤差小(見圖1)。
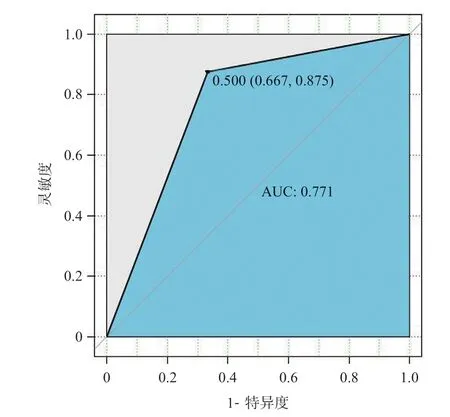
圖1 多因素Logistic回歸分析AUC曲線
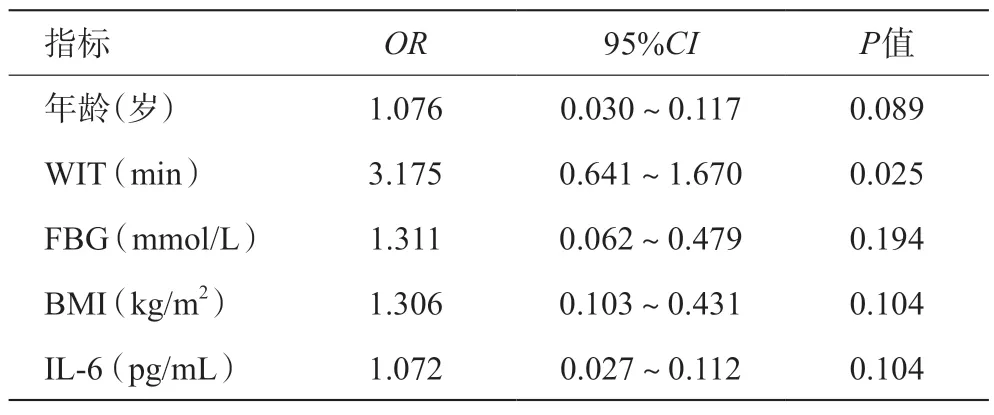
表3 LT術后IR的多因素Logistic回歸分析
2.4 正常對照組與IR組術后CRP、IL-6、PCT水平
與正常對照組比較,IR組CRP水平在術后第4、7、14、21、28天明顯升高,而IL-6水平在術后第7、14、21、28天明顯升高,差異有統計學意義(P<0.05),見圖2~3,術后30 d內兩組PCT水平無統計學差異(P>0.05),見圖4。
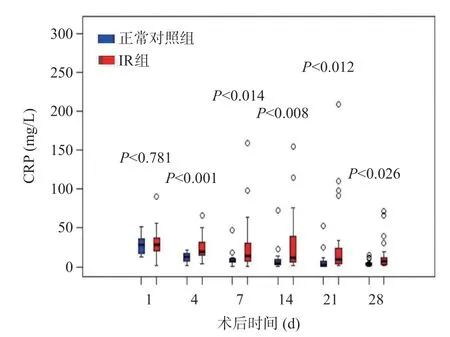
圖2 LT術后正常對照組和IR組的CRP水平變化
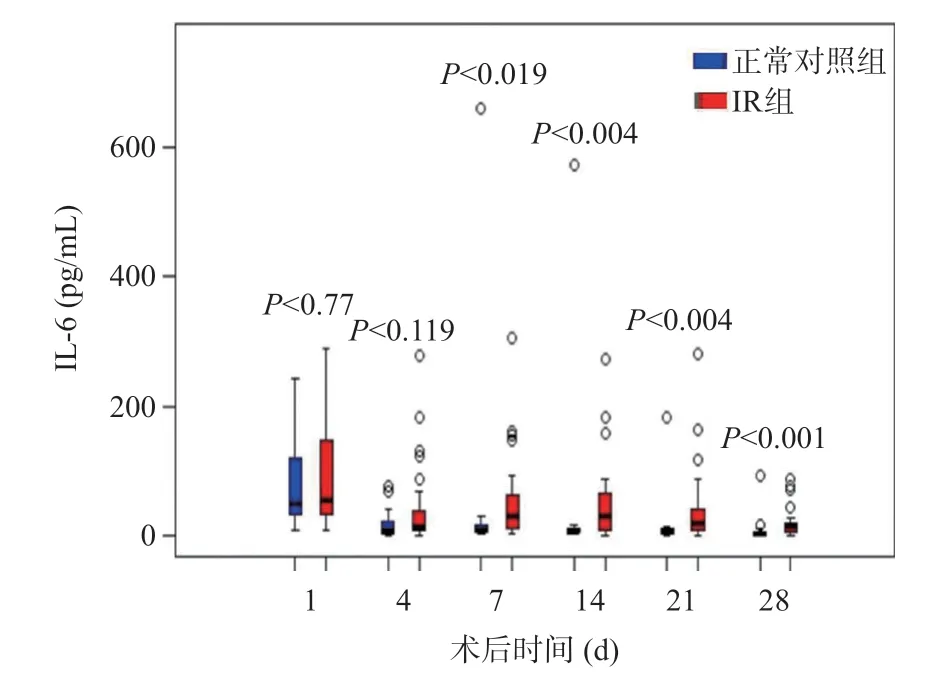
圖3 LT術后正常對照組和IR組的IL-6水平變化
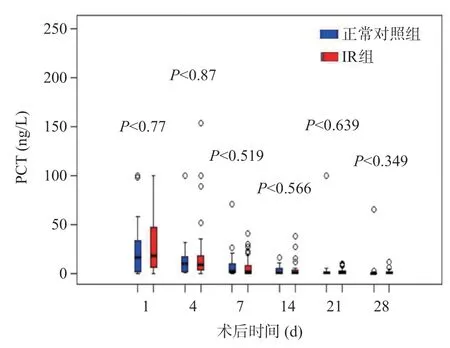
圖4 LT術后正常對照組和IR組的PCT水平變化
2.5 正常對照組與IR組術后TAC血藥濃度
TAC是公認的器官移植術后新發糖尿病的危險因素,通過對TAC濃度比較發現IR組術后第12、21天TAC濃度明顯高于正常對照組,兩組間差異有統計學意義(P<0.05),見圖5。
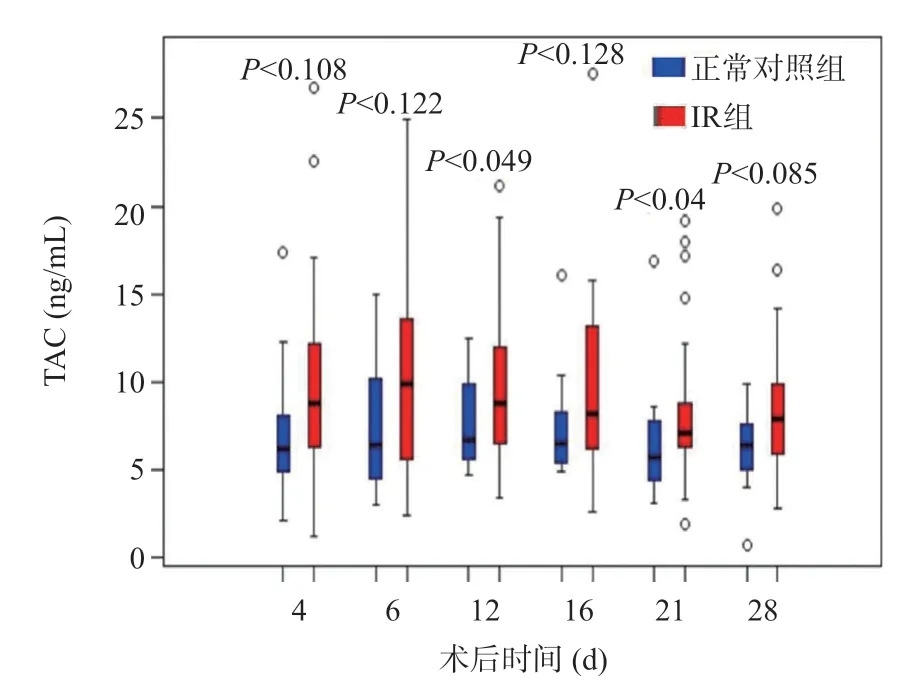
圖5 LT術后正常對照組和IR組TAC濃度變化
2.6 正常對照組與IR組術后FBG水平
IR組術后第4、7、14、21、28天FBG明顯高于正常對照組,差異有統計學意義(P<0.05),見圖6。
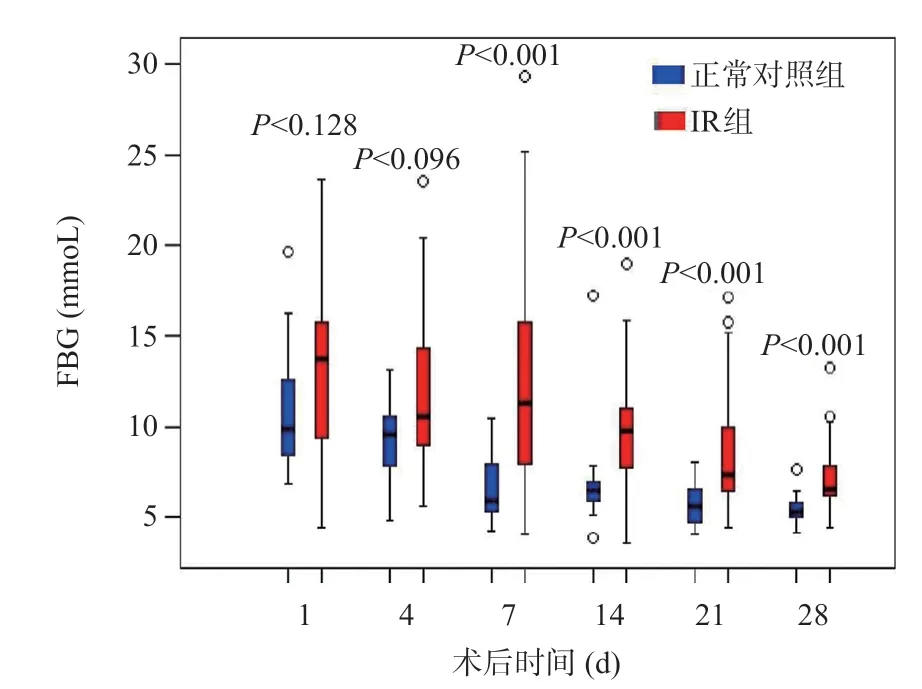
圖6 LT術后正常對照組和IR組FBG濃度變化
2.7 IR與預后的關系
正常對照組死亡7例,隨訪時間(969±807)d,IR組死亡9 例,隨訪時間(1 035±632)d。構建Kaplan-Meier生存曲線,并進行Log-rank檢驗P=0.1817,兩組受體存活率無統計學差異(P>0.05),見圖7。
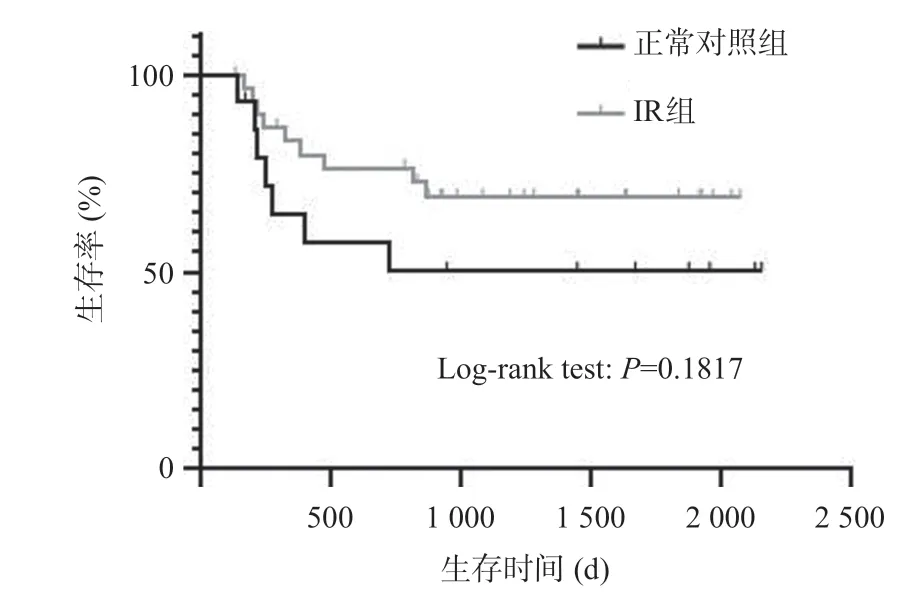
圖7 兩組Kaplan-Meier生存曲線對比
3 討論
本研究發現:(1)高齡、BMI高、WIT時間長,術前FBG及IL-6較高LT術后發生IR的危險因素,其中WIT是獨立危險因素;(2)年輕、BMI較低或接受LDLT供肝的受體,發展成為NODM的風險較低;(3)術后1個月內CRP、IL-6、FBG、TAC血藥濃度高的受體發生IR的風險較高。
Hartog等[5]的研究證實肝臟WIRI影響IRS-1、IRS-2 和PI3K來誘導IR,且與移植物失功相關,是術后早期發生NODM的危險因素,熱缺血可能會耗盡肝糖原儲備并通過影響移植物的代謝儲備而危及早期LT功能[6]。我們的研究結果也證實了這一發現,在LT的過程中包括了熱缺血、冷缺血及缺血再灌注損傷,在我們的研究中WIT是受體術后發生IR的獨立危險因素(OR3.175,95%CI0.641~1.670,P=0.025),有研究表明DCD肝移植術后早期的IR可能與熱缺血損傷有關,長時間冷保存所造成的冷缺血是LDLT肝移植術后NODM的獨立危險因素[7]。同時,在進行T-HG組與NODM組相比時,發現接受LDLT供肝的受體IR更容易逆轉(P<0.05),原因可能是LDLT供受體一般情況和各項指標都好于DCD,包括年輕、較低的BMI,換而言之當肝臟代謝中的胰島素信號通路激活時,這類受體可以提供更適宜的碳水化合物代謝環境[8]。表1中發現ALT(P=0.034),考慮與受體原發疾病有關。目前尚無文獻報道ALT與術后IR有關,且其余肝功能指標組間比較無明顯差異,故未納入分析。
Toshiki等[9]的研究結果表明,在病理狀態下,肝細胞中產生的大量炎性細胞因子如IL-1β和IL-6通過蛋白磷酸化的信號通路影響胰島素的糖調節,在細胞因子和胰島素的不同信號通路之間互相作用,互相影響,導致糖原沉積,也初次證明了是細胞因子,而不是糖調節激素,優先控制肝臟糖代謝,從而導致血糖異常。我們的研究發現術前IL-6較高的受體術后IR的發生率較高(P<0.05),同時我們的研究發現即使存在抗生素的使用、受體的個體差異等混雜因素,術后第7、14、21、28天IR組的IL-6水平均高于正常對照組,且差異有統計學意義(P<0.05)。術后IL-6水平升高的部分原因在于肝臟缺血再灌注損傷,有研究表明LT后釋放的細胞因子對于血糖代謝的影響的潛在作用會在早期階段變得明顯,并隨著多種因素的影響而使細胞因子的作用隨著時間流逝而減弱[9],這也是我們的研究重點放在LT術后的早期階段的原因所在。IL-6 在胰島素信號傳導通路的上游通過抑制胰島素受體、IRS-1和PI3K激酶,進而影響胰島素信號通路,導致IR[7]。通過我們的研究結果與既往文獻佐證可以明確,IR與炎癥反應相互影響、相互加重,通過炎癥因子相關通路的研究可能為預防和治療IR的提供新的思路和策略。
年齡是公認的NODM危險因素,Kuo等[10]報告的一項樣本量為20 172 大型回顧性研究結果表明,年齡≥50歲是NODM的獨立危險因素。我們的研究發現年齡每增加1歲發生IR的風險是原來的1.076倍(OR1.076,95%CI0.03016~0.11688,P=0.089)。年齡大于45~50歲的受者術后更容易發展為NODM,但只有受者年齡才是NODM發生逆轉的獨立因素,即受者年齡越小,其發生逆轉可能性越大[11-12],在我們的研究中也證實了這一觀點,T-HG組的平均年齡小于NODM組(P<0.05)。同時我們也發現BMI較高的受體術后發生IR的風險較高(P<0.05),BMI正常或較低的受體術后不容易發展為NODM。研究表明,當BMI≥25 kg/m2時NODM的發病率較BMI<25 kg/m2高1.25倍[13]。Anastácio等[14]的一項關于LT術后Meta的研究中指出脂聯素水平較低是LT術后受體發生IR的危險因素,肥胖受體脂聯素水平較低,TNF-α、IL-6、CRP、HOMA-IR較高。因此,肥胖受體在術前通過合理飲食和鍛煉,來達到降低體重及腹圍的目的,對于降低IR的發病率是有必要的。
有文獻表明,術前FBG較高是術后NODM較強的預測因子[15],在我們的研究中通過單因素分析證實發現術前FBG較高的受體術后發生IR的風險更大(P<0.05),可能與肝功能不全和β細胞功能異常有關。Ling等[13]通過對中國肝移植數據庫的10 204例受體數據進行分析發現術后30 d內持續血糖較高是NODM的獨立危險因素,通過對本中心受體術后1個月內的血糖進行分析,發現IR組的術后5 次血糖結果中有4次血糖水平高于正常對照組(P<0.05),說明LT術后高血糖原因不能完全用手術創傷后的應激反應來解釋,可能與LT特有的缺血再灌注損傷有關。
TAC是公認的導致LT術后IR的危險因素,在我們的研究中,納入的受者術后標準免疫抑制劑方案均為TAC,無法評估TAC對于術后IR的發病率是否有預測意義,但是在術后1 個月的TAC血藥濃度隨訪中我們發現第12、21天IR組高于正常對照組,且差異有統計學意義(P<0.05)。TAC作為鈣調磷酸酶抑制劑,已經被證實可以引起IR,并進一步導致受體發生NODM[16]。Yagi等[17]研究證實LDLT術后3個月TAC血藥濃度≥8 ng/mL是NODM的獨立危險因素。Rodriguez-Rodriguez等[18]的研究證實TAC的毒性依賴于已經存在的β細胞功能障礙所導致的IR,轉錄因子在胰島素產生和增殖中有重要的作用,如果不存在IR,TAC將不存在這些毒性作用。Lione等[19]的一項關于腎移植術后TAC臨床試驗證實緩釋劑與普通劑型效果相當,因此,在免疫抑制不同劑型效果相同的情況下,選擇對人體葡萄糖代謝影響最小的免疫抑制治療方案,可能降低IR的發病率。
本研究樣本量較小,存在選擇偏倚和信息偏倚,但我們將數據盡可能詳盡分享,希望能夠充實LT數據庫并在未來預防LT術后IR的研究中提供新思路,通過對LT術后IR的機制和危險因素進行研究對降低IR的發生率,提高受體遠期生存率及生活質量具有重大的臨床意義。