miR-500在腎細胞癌中的表達及其生物學功能
楊匆匆,姚鵬,任文明,韓杰,徐玉節,程立
(皖南醫學院弋磯山醫院泌尿外科,安徽 蕪湖 241001)
腎細胞癌(renal cell carcinoma,RCC)是最常見的腎癌之一,約占成人惡性腫瘤的3%[1],發病率和死亡率呈逐年上升趨勢[2-4]。由于RCC早期臨床特征不明顯,約有25%~30%的患者在明確診斷時已出現轉移,而轉移性RCC是一種難以治療的惡性腫瘤[5],5年生存率低于10%[6-7]。隨著分子生物學技術的發展,微小RNA(miRNAs)的發現為癌癥的研究開辟了新的窗口。miRNAs是高度保守的大約18~24個核苷酸的非編碼RNA[8],結合到mRNA的3'UTR以調節基因表達[9-10]。它們已被證實參與多種生物過程,并在腫瘤發生和發展的調節中起關鍵作用[11-13],被認為是腫瘤治療的潛在靶點。大量研究證明微小RNA-500(miR-500)的異常表達與肝細胞癌[14]、胃癌[15]、結直腸癌[16]、乳 腺 癌[17]、非 小 細 胞 肺 癌[18]、前 列 腺癌[19]等惡性腫瘤的進展相關。但鮮見miR-500與RCC相關的報道,本研究旨在探討miR-500在RCC發生、發展中的作用,為RCC的發生發展機制提供理論參考。
1 材料與方法
1.1 臨床樣本收集2020年1月至2021年2月在我院泌尿外科行手術治療且經病理組織學確診的36例RCC患者的腎癌組織和癌旁正常組織(可見RCC病灶外2.0 cm)。年齡30~86歲;男28例,女8例;T1期27例,T2期2例,T3+T4期7例。患者術前均未行放化療,且所有患者均簽署知情同意書。所有新鮮組織在切除后立即在液氮中快速冷凍保存。本研究經醫院倫理委員會批準。
1.2 細胞培養選取miR-500表達水平較低的RCC細胞株ACHN和KETR3,均購自上海中科院細胞庫。這2種細胞株保存在含有10%胎牛血清(FBS,美國Corning公司)的DMEM培養基(美國Gibco公司)中,并在37℃、5%CO2增濕培養箱中培養。
1.3 細胞轉染miR-500過表達引物(miR-500 mimics)及陰性對照引物(negative control,NC)購自中國上海生工公司。腎癌細胞株ACHN和KETR3接 種 于6孔 板 中 并 培 養24 h后,用Lipofectamine 3000(美國Thermo公司)進行細胞轉染。24 h后更換為新鮮培養液,轉染48 h后收集細胞,提取RNA,然后使用qRT-PCR驗證轉染后2種細胞株miR-500的表達,U6作為內參照。miR-500上游引物:5'-ATCCTTGCTACCTGGGTGAGA-3',下游引物:5'-GCTCTCGCTCTCAGAATCCTT-3';U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。引物大小為80 bp。程序95℃10 min、95℃15 s、60℃60 s、60℃20 s,40循環。
1.4 癌組織及癌旁正常組織中miR-500表達水平采用熒光定量聚合酶鏈反應(qRT-PCR)技術檢測,按照試劑盒說明書。
1.5 細胞增殖實驗采用MTS法檢測細胞增殖情況。在37℃、5%CO2環境中,將RCC細胞株ACHN和KETR3以1×104/孔 的 密 度 接 種 到96孔 板 中,DMEM培養基最終體積為100 μl,6個重復孔。過夜附著后,將每個孔的細胞用5 pmol/L miR-500 mimics或NC進行轉染。孵育0、24、48、72 h后,用MTS法分析確定細胞活力。將MTS標記試劑(美國Promega公司)與新鮮DMEM培養基混合,并按照產品說明書孵育細胞2 h,使用VARIOSCAN FLASH(美國Thermo Fisher公司)在490 nm和690 nm波長下測量光密度,以此反映細胞增殖活性,并繪制細胞增殖折線圖。
1.6 細胞遷移實驗采用劃痕實驗檢測細胞遷移能力。將RCC細胞株ACHN和KETR3均勻接種在6孔板中,并使用Lipofectamine 3000將miR-500 mimics和NC轉染6 h。當細胞密度達到90%時,200 μl無菌移液管尖端劃出清晰的劃痕。然后將細胞用磷酸鹽緩沖液(PBS)沖洗,并在無血清DMEM培養基中培養。在劃痕形成0和24 h后用數碼相機系統(日本奧林巴斯光學公司)獲取圖像。實驗重復3次。
1.7 細胞凋亡實驗運用流式細胞儀評價細胞凋亡程度。將細胞株ACHN和KETR3均勻接種到6孔板中。轉染48 h后,根據說明書,收集每個孔的細胞,包括漂浮細胞,并用5 μl碘化丙啶(PI)和5 μl膜聯蛋白V-熒光素異硫氰酸酯(KeyGEN)染色。在30 min內,使用流式細胞儀(美國Beckman公司)對每個樣品進行測量和分析。
1.8 統計學方法采用SPSS 19.0軟件進行統計學分析。正態分布的計量資料采用配對樣本t檢驗和獨立樣本t檢驗進行比較,P<0.05為差異有統計學意義。
2 結果
2.1miR-500在腎癌組織中低表達36例RCC患者中29例癌組織中miR-500表達下調(圖1A);RCC癌組織中miR-500的平均表達水平顯著低于癌旁正常組織(P<0.01)(圖1B)。
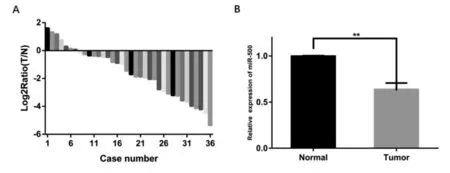
圖1 RCC癌組織和癌旁正常組織中miR-500的表達
2.2 轉染結果qRT-PCR結果顯示轉染ACHN和KETR3細胞后,miR-500 mimics組miR-500的表達分別是NC組的(97.79±22.06)倍和(73.71±15.16)倍,差異有統計學意義(P<0.01),見圖2。

圖2 ACHN、KETR3細胞轉染結果
2.3miR-500抑制RCC細胞的增殖MTS法結果顯示,miR-500 mimics組ACHN和KETR3細胞在24、48、72 h時,miR-500 mimics組細胞增殖速率較NC組明顯降低(P<0.05)。見圖3。
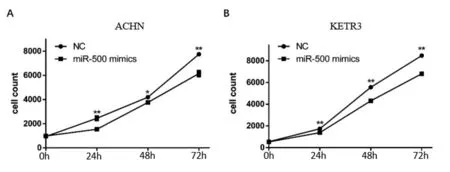
圖3 miR-500抑制ACHN(A)和KETR3(B)細胞的增殖
2.4miR-500抑制RCC細胞的遷移劃痕實驗結果顯示,在轉染后24 h,與NC組比較,miR-500 minics組ACHN細胞和KETR3細胞的遷移距離分別減少了(32.06±16.92)%和(63.16±35.88)%(P<0.05)。見圖4。
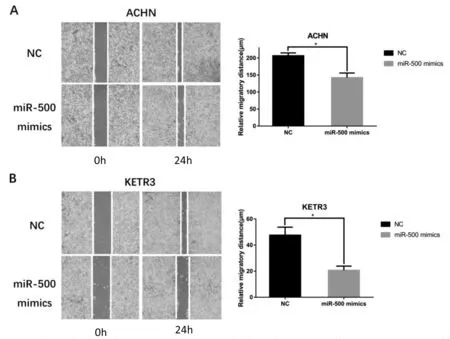
圖4 miR-500抑制ACHN和KETR3細胞的遷移
2.5miR-500誘導RCC細胞凋亡流式細胞術檢測結果顯示,轉染miR-500 48 h后,miR-500 minics組的ACHN細胞凋亡率較NC組細胞凋亡率顯著升高,分別為(19.10±1.89)%和(9.76±1.95)%(P<0.01);KETR3細胞的相應凋亡率分別為(9.85±0.28)%和(6.32±0.70)%(P<0.01)。見圖5。
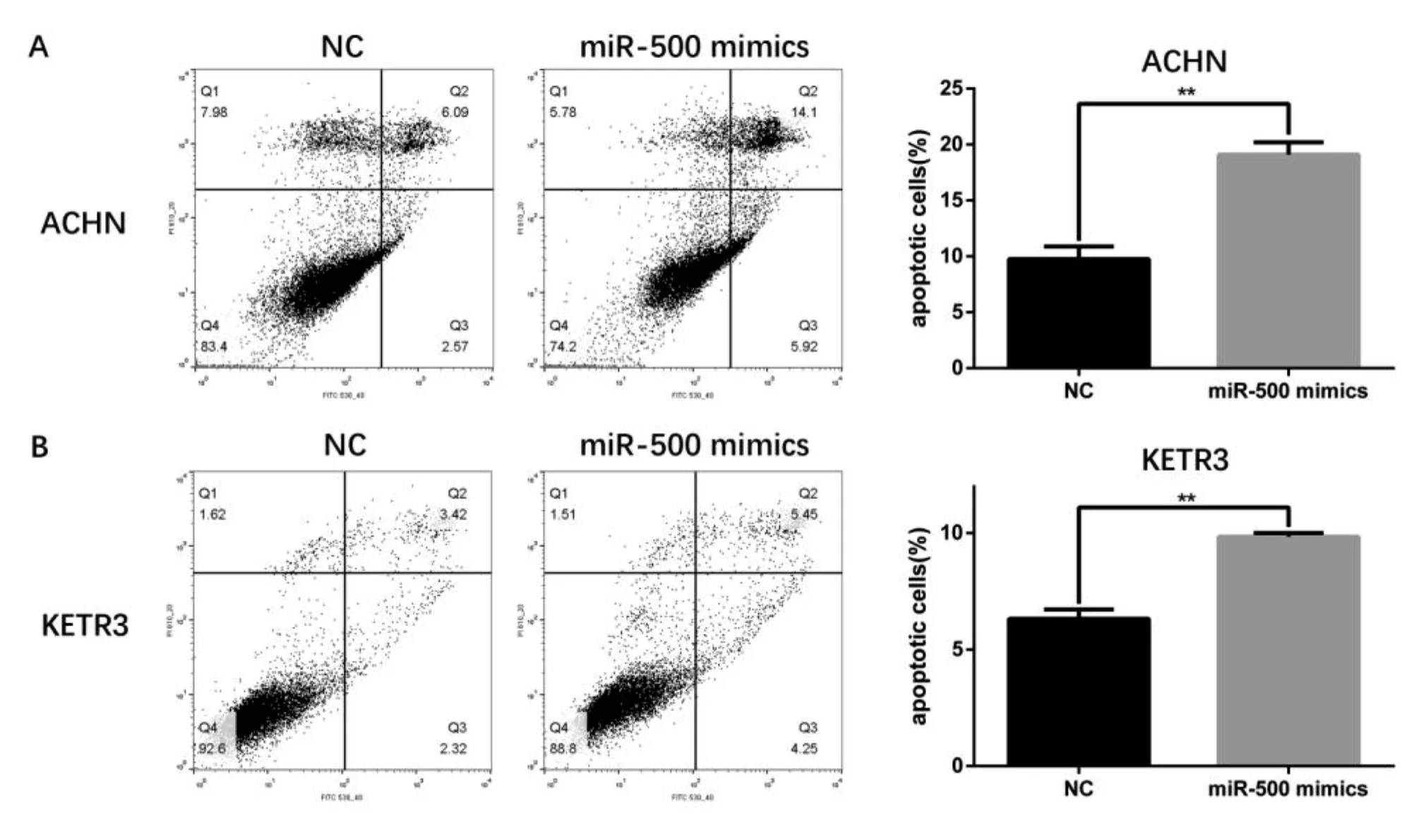
圖5 miR-500誘導ACHN和KETR3細胞凋亡
3 討論
腫瘤發生與多種基因的序列性改變有關,包括癌基因的激活和抗癌基因的功能障礙。大約50%以上的miRNAs基因位于與多種腫瘤相關基因區域或脆弱基因位點,這表明了miRNAs在諸多腫瘤的發生發展、遷移、增殖、凋亡等方面均有著重要生物學功能。一些miRNAs在RCC中表達明顯上調,如miR-210、miR-155和miR-21;另一些miRNAs,如miR-708和miR-145則表達降低[20],這表示miRNAs不僅具有腫瘤促進作用,亦可能具有腫瘤抑制作用。
人類已發現miR-500在許多惡性腫瘤組織中的異常表達,并在癌癥發展中起著關鍵作用。如有研究發現miR-500表達在胃癌組織中明顯上調,但在正常胃組織中相對較低。結果表明miR-500通過激活核因子NF-κB信號傳導通路誘導胃癌細胞增殖和抗凋亡[15]。也有研究發現抑制miR-500,可以顯著抑制非小細胞肺癌細胞的增殖、遷移、侵襲和黏附,并誘導非小細胞肺癌細胞凋亡[18]。有報道miR-500在肝細胞癌患者的血清和腫瘤組織中大量表達,但在腫瘤切除后可恢復至基線水平[14]。也有實驗證實miR-500的靶向敲低顯著提高了前列腺癌細胞中低密度脂蛋白受體相關蛋白1B(LRP1B)的水平,使前列腺癌細胞周期停滯在G1期,進而抑制細胞增殖[19]。此外,長鏈非編碼RNA LINC00641靶向調控miR-500的表達抑制結腸癌細胞增殖、遷移及侵襲[16]。然而,關于miR-500在RCC中的表達特征或功能機制知之甚少。
本研究首先采用qRT-PCR技術檢測36例RCC癌組織和癌旁正常組織中miR-500的表達水平,結果顯示RCC癌組織中miR-500表達水平顯著低于癌旁正常組織,這說明miR-500有可能是一種調控RCC發展的抑癌基因。為了進一步探討miR-500水平對RCC發展的影響,本研究通過將2種RCC細胞系ACHN和KETR3進行miR-500過表達后,分析了miR-500上調對RCC細胞增殖、遷移和凋亡的作用。結果表明,miR-500上調顯著抑制了2種RCC細胞的增殖與遷移能力,并誘導了細胞凋亡增加。研究結果對miR-500在RCC發生發展、遷移、增殖、凋亡等方面中的作用及可能機制提供了全新思路。
綜上所述,在RCC細胞系ACHN和KETR3細胞中,miR-500能抑制其增殖和遷移,誘導凋亡增加,在RCC中發揮著重要生物學作用。miR-500可能是未來RCC生物治療的新靶點,應進一步研究探索miR-500的生理作用及靶基因。

