血流感染肺炎克雷伯菌臨床特征、毒力基因及分子流行病學研究
杭修兵 肖曉 儲雯雯 葉乃芳 劉周
(安徽醫科大學第二附屬醫院檢驗科,合肥 230601)
血流感染是指由細菌、真菌等病原體入侵血流所致的全身性感染,屬于臨床重癥感染性疾病[1]。肺炎克雷伯菌(Klebsiella pneumoniae,KPN)屬于腸桿菌目克雷伯菌屬,是導致醫院和社區感染的主要病原菌之一[2-3]。隨著廣譜抗菌藥物的濫用,碳青霉烯耐藥KPN(carbapenem-resistance KPN,CRKP)檢出率呈逐年上升趨勢,使得血流感染治療難度增加[4]。近年來CRKP不僅表現為多重耐藥,而且通過獲得毒力質粒進化為高毒力、高耐藥性菌株,使得臨床感染蔓延趨勢更為嚴重[5-6]。研究表明,社區與院內血流感染KPN在臨床特征、毒力因子以及分子生物學特征上存在一定差異,對其進行相關監測具有重要臨床意義[7]。本研究回顧性分析安徽地區某省級綜合性三級甲等醫院2019年1月至2020年12月住院患者送檢血液標本中KPN的臨床特征和耐藥情況,并對其毒力基因和相關分子生物學特征進行研究分析,以期為血流感染KPN的臨床診治和耐藥防控提供相關依據。
1 資料與方法
1.1 病例資料
收集2019年1月至2020年12月安徽地區某省級綜合性三級甲等醫院的臨床血流感染患者血培養分離的91株KPN(剔除重復菌株)。本研究納入標準為住院血流感染患者中至少一次血培養分離出KPN,并達到血流感染的診斷標準[8];同時排除標準為:① 病史資料不全,② 患者年齡<14歲,③ 兩種及以上細菌混合感染。最終共計72株KPN納入本研究,同時收集對應住院患者主要臨床資料,包括年齡、性別、入住ICU天數、基礎疾病、接受侵襲性診療操作與發生KPN血流感染前使用碳青霉烯類藥物情況、患者臨床轉歸。根據臨床感染類型分組,其中感染發生入院48 h后為醫院血流感染(hospital-acquired bloodstream infection,HABSI)組,感染發生于入院4 8 h以內為社區血流感染(community-onset bloodstream infection,COBSI)組[9]。研究通過本院倫理委員會審查同意(批準號:PJ-YX2018-001)。
1.2 菌株鑒定及藥敏試驗
常規傳統方法培養純化細菌,應用德國Bruker-Microflex LT型質譜儀進行菌種鑒定,應用法國BioMérieux Vitek-2型全自動分析儀進行藥敏試驗,結果判定參照CLSI 2019版標準[10]。采用微量肉湯稀釋法測定多黏菌素B的(minimum inhibitory concentration,MIC)MIC值,結果按EUCAST標準判定(http://www.eucast.org)。CRKP的判定標準為對亞胺培南、美羅培南及厄他培南3者任意一種耐藥的KPN。應用改良碳青霉烯滅活試驗(mCIM)及EDTA改良滅活試驗(eCIM)檢測CRKP菌株的碳青霉烯酶表型[10]。
1.3 多位序列分型、莢膜血清型及毒力基因檢測
應用多位點序列分型(multilocus sequence typing,MLST)進行KPN的序列分型檢測,擴增包括gapA、infB、mdh、pgi、phoE、rpoB和tonB在內的7個標準的管家基因,擴增條件及方法參見文獻[11],擴增產物測序后確定等位基因,應用MLST網站進行序列類型(sequence type,ST)鑒定。將等位基因gapA-infBmdh-pgi-phoE-rpoB-tonB按順序整理,并根據其差異將ST型分為單個位點變異型(single-locus variants,SLVs)、雙位點變異型(double-locus variants,DLVs)及三位點變異型(triple-locus variants,TLVs)。應用goeBurst軟件建立最小生成樹,確定ST型中的克隆群主型(group founder,GF)及亞克隆群主型(sub-group founder,sub-GF)[12]。
應用PCR方法檢測了10種毒力相關基因,包括iucA、allS、iroB、kfu、mrkD、rmpA、rmpA2、ureA、wabG和ybtS,PCR引物及擴增條件參見文獻[13]。應用PCR聯合測序技術檢測KPN菌株莢膜wzi分型,PCR引物及擴增條件參見文獻[14]。
1.4 全基因組測序及生物信息學分析
應用Illumina NovaSeq測序儀對CRKP菌株進行全基因組測序,測序結果應用在線數據庫(http://www.mgc.ac.cn/cgi-bin/VFs/v5/main.cgi)分析毒力基因;應用Resfinder和PlasmidFinder分析耐藥基因及質粒特征。應用在線服務器(https://cge.cbs.dtu.dk/services/CSIPhylogeny/)分析單核苷酸多態性(single nucleotide polymorphism,SNP),然后將結果導入軟件FigTree 1.4.3,生成最大似然樹。
1.5 統計學分析
應用WHONET5.6軟件對藥敏結果進行分析,其他統計分析應用SPSS 21.0軟件。應用χ2檢驗進行兩組間率的比較,以P<0.05為有統計學差異。
2 結果
2.1 臨床感染特征分析
72例KPN血流感染患者中,54.2%為HABSI組(39例),45.8%為COBSI組(33例)。兩組患者在年齡、性別及基礎疾病方面均無顯著差異(P>0.05)。HABSI組患者入住ICU天數>10d比例高于COBSI組(P<0.05)。在發生血流感染前,HABSI組患者接受侵入性操作及使用碳青霉烯類藥物的比例也顯著高于COBSI組(P<0.05)。比較臨床預后可見,HABSI組患者治愈或好轉的比例顯著低于COBSI組(P<0.05)。具體臨床特性見表1。
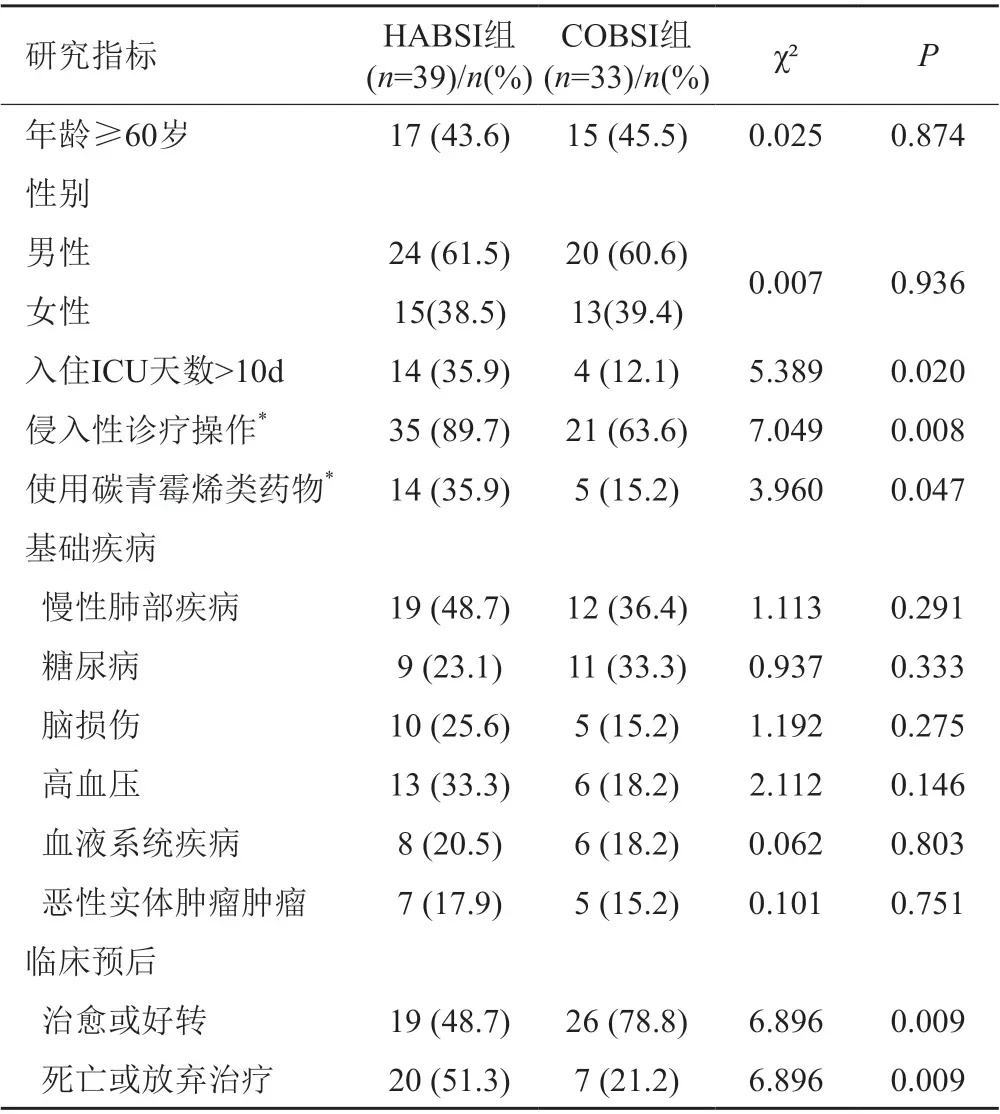
表1 HABSI組和COBSI組患者的臨床特征比較Tab.1 Comparison of clinical characteristics between HABSI group and COBSI group
2.2 抗菌藥物敏感性實驗
藥敏試驗結果顯示,72株KPN對頭孢曲松、頭孢他啶、頭孢吡肟、氨曲南、哌拉西林/他唑巴坦、環丙沙星和左氧氟沙星的耐藥率均在34.7%~48.6%,亞胺培南、美羅培南和厄他培南的耐藥率均為26.4%,替加環素耐藥率為1.4%,未檢出多黏菌素B的耐藥株。HABSI組KPN對亞胺培南、美羅培南和厄他培南的耐藥率均為48.7%,而COBSI組未檢出碳青霉烯耐藥菌株。除多黏菌素B和替加環素外,HABSI組KPN對抗菌藥物耐藥率均顯著高于COBSI組(P<0.05)。結果見表2。
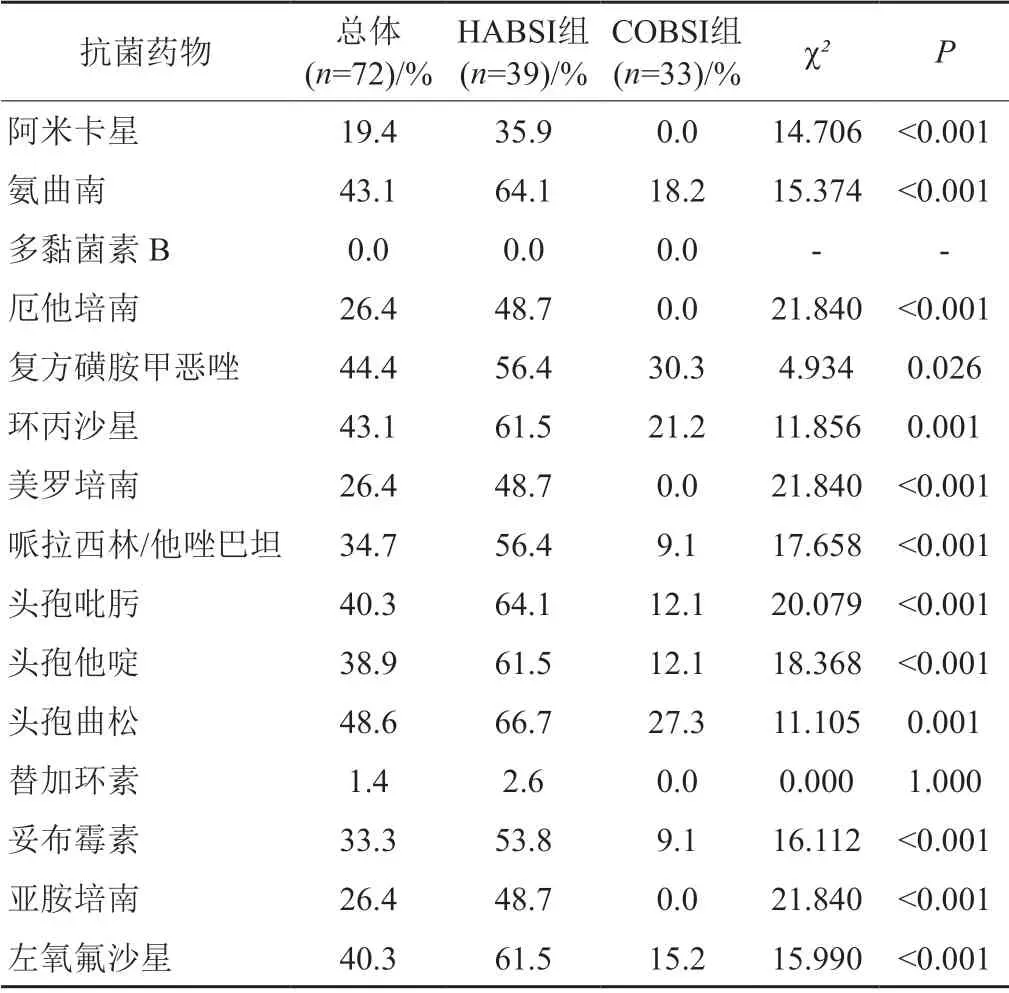
表2 HABSI和COBSI組的KPN對抗菌藥物耐藥率Tab.2 The resistance rates of KPN with HABSI group and COBSI group
2.3 分子分型及毒力基因檢測
MLST結果顯示,HABSI組包含23種ST型,其中ST11型16株(41.0%)、ST15型2株(5.1%),其余ST1、ST14、ST17、ST39、ST65、ST101、ST107、ST218、ST220、ST234、ST307、ST334、ST592、ST906、ST1386、ST1496、ST1630、ST1699、ST1803、ST1899及ST2494各1株(各占2.56%)。COBSI組中包含24種ST型,其中ST23型4株(12.1%),ST86型3株(9.1%),ST25、ST65、ST231及ST412各2株(6.1%),ST14、ST17、ST20、ST37、ST163、ST200、ST276、ST307、ST380、ST511、ST586、ST595、ST611、ST661、ST685、ST1627、ST1786及ST1798各1株(各占3.03%)。
GoeBURST分析顯示,HABSI組中ST220為GF,ST11、ST65和ST39等為sub-GF,ST15和ST1630為ST11的TLVs;COBSI組中ST23為GF,ST511、ST65和ST412為sub-GF,ST163為ST23的SLV,ST17、ST25和ST276均為ST23的DLVs,見圖1。
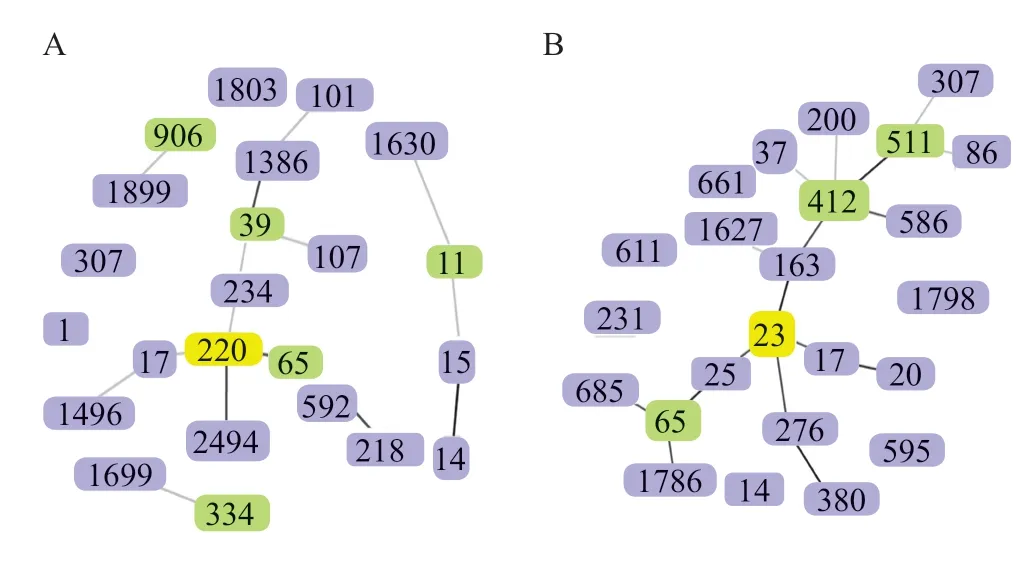
圖1 HABSI組菌株(A)與COBSI組菌株(B)ST型的goeBURST分析圖Fig.1 GoeBURST analysis of HABSI group and COBSI group isolates’ sequence type
莢膜分型顯示,HABSI組菌株中38.5%為K64型,K125、K19和K57型分別占10.3%、5.1%和5.1%,COBSI組菌株莢膜型中K2、K1和K57分別占21.2%、12.1%和6.1%,見表3。
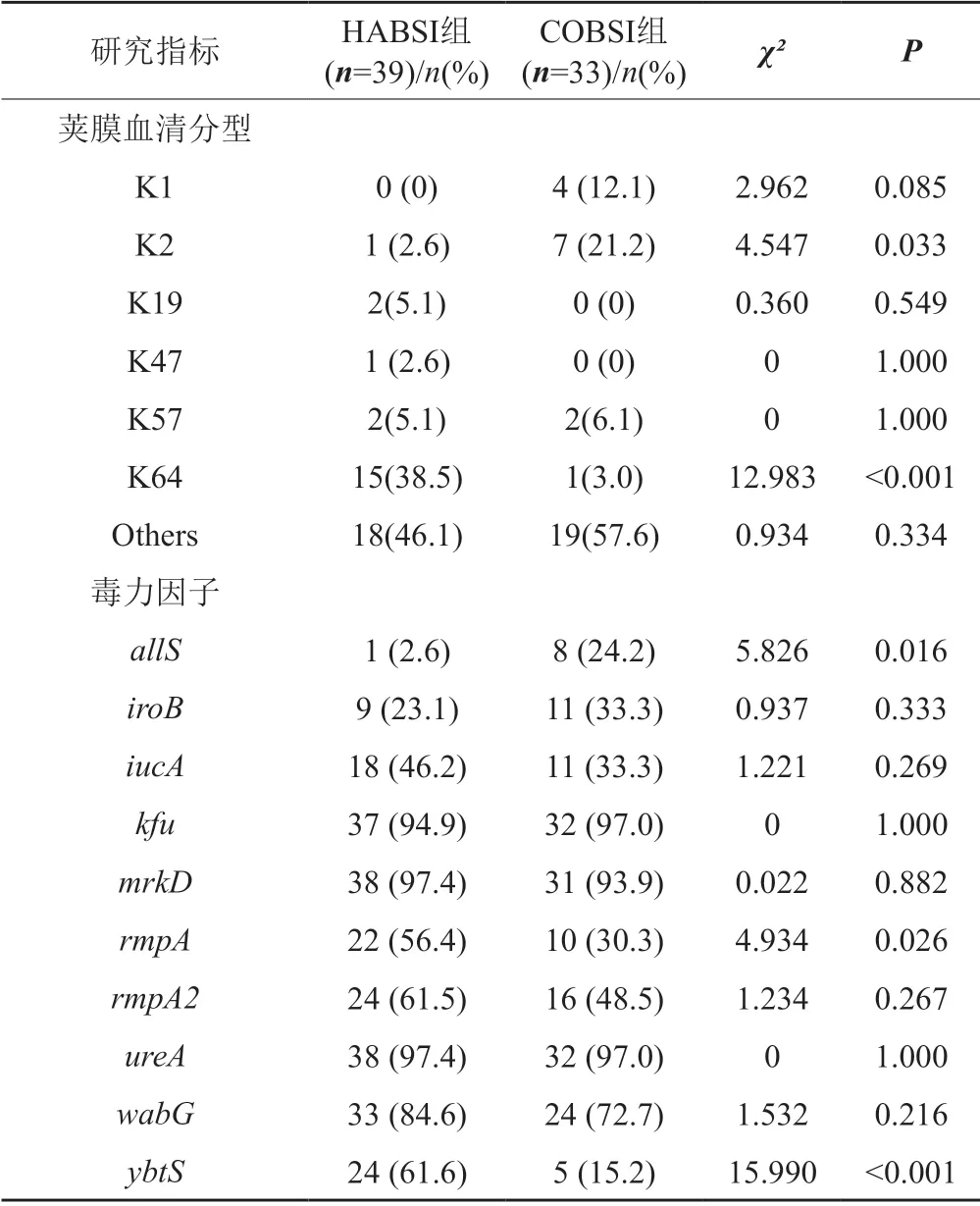
表3 HABSI組和COBSI組莢膜分型及毒力因子分析Tab.3 Capsular serotype and virulence factor analysis of HABSI group and COBSI group
毒力基因分析顯示,pLVPK-like毒力質粒相關的毒力因子rmpA、rmpA2以及iucA在HABSI組和COBSI組攜帶率分別為56.4%、61.6%、46.2%與30.3%、48.5%和33.3%。
2.4 CRKP全基因組測序分析
共檢出19株CRKP,根據其分離的先后順序,將19株CRKP依次命名為CRKP 01~19。mCIM及eCIM試驗顯示,所有CRKP菌株mCIM試驗均為陽性,5.3%(1/19)菌株eCIM試驗陽性。Resfinder分析顯示,上述eCIM試驗陽性菌株(1株,5.3%)攜帶blaNDM-1,其余mCIM陽性CRKP(18株,94.7%)攜帶blaKPC-2。所有CRKP均攜帶超廣譜β-內酰胺酶(extended spectrum β-lactamase,ESBL)基因,包括blaCTX-M-65(73.7%)、blaSHV-12(84.2%)和blaTEM-1(78.9%)等。耐藥基因tet(A)和fosA攜帶率為84.2%和68.4%。
分子分型結果顯示,84.2%(16/19)的CRKP屬于ST11型,且K64為ST11-CRKP主要莢膜型(15株,93.8%),SNP分析顯示所有ST11-CRKP具有高度親緣關系。PlasmidFinder分析顯示,CRKP攜帶IncF11、IncR及IncHI1B型質粒的比例分別為94.7%(18/19)、78.9%(15/19)及63.2%(12/19)。其中攜帶IncHI1B型質粒的CRKP均屬于K64-ST11型,其rmpA、iucA和rmpA2基因攜帶率分別為100%(12/12)、91.7%(11/12)和91.7%(11/12)。見圖2。
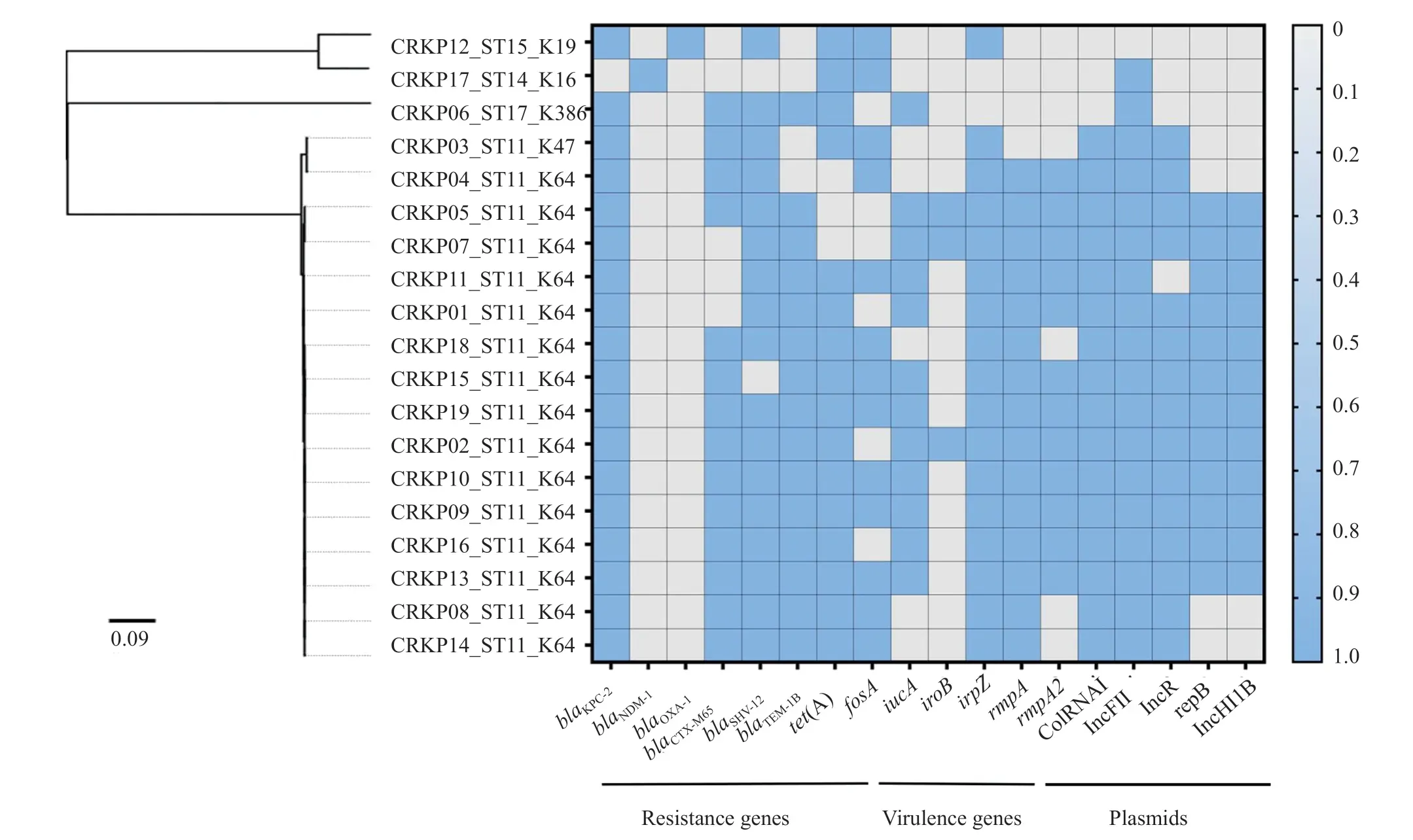
圖2 CRKP相關耐藥基因、毒力基因及質粒分布情況Fig.2 Distribution of resistance genes,virulence genes and plasmids in 19 CRKP isolates
3 討論
KPN是臨床血流感染的常見病原體,隨著碳青霉烯類抗生素在臨床廣泛使用,KPN的耐藥趨勢不斷上升。研究表明,醫院感染與社區感染KPN對抗菌藥物的耐藥性有一定的差異,醫院獲得性血流感染KPN菌株常常攜帶多種耐藥基因,呈現多重耐藥表型,導致患者住院時間增加、病死率升高,給臨床抗感染治療帶來極大挑戰[15-16]。本研究72例患者中醫院獲得性占54.2%(39例),且臨床預后醫院組比社區組患者差,與上述報道基本一致。
ICU是易發生血流感染的主要科室之一,這與ICU患者住院周期長、病情危重以及長時間或大劑量使用抗生素等特點有關[17]。本研究數據顯示,HABSI組患者入住ICU天數>10d比例高于COBSI組,入住ICU天數的延長可能會增加HABSI的感染風險。在侵入性治療方面,發生KPN血流感染前進行侵襲性診療操作患者的比例HABSI組顯著高于COBSI組。研究表明,對于侵襲性診療操作,如置管、穿刺、氣管插管等有創操作更容易引起HABSI[18]。因此,在進行院感防控時,應重點關注ICU病區,增強醫務人員的無菌操作觀念,以防多重耐藥菌通過手部污染物體表面。同時臨床和院感部門應盡量加強侵入性操作的評估,掌握合理的拔管指征。
藥敏試驗結果顯示,除多黏菌素B和替加環素外,HABSI組KPN對抗菌藥物耐藥率均顯著高于COBSI組,其中HABSI組菌株對碳青霉烯類抗生素的耐藥率高達48.7%,值得臨床高度關注。進一步對HABSI組的CRKP菌株進行耐藥基因分析可見,所有CRKP均攜帶包括碳青霉烯耐藥基因在內的多個耐藥基因。質粒分析提示CRKP都攜帶了一個或多個質粒復制子,其中以IncFII和IncR為主。研究表明,IncFII和IncR質粒通常攜帶不同的耐藥基因,并且可以在醫院環境中傳播,從而造成多重耐藥菌株的播散[19]。HABSI組在發生KPN血流感染前使用過碳青霉烯類藥物的比例明顯高于COBSI組,提示碳青霉烯類藥物的過度使用可能會增加CRKP菌株產生的風險。因此,臨床科室、藥學部門及醫院感染管理部門應高度重視,規范使用抗菌藥物,采取嚴格的消毒隔離措施,避免KPN多重耐藥菌株的產生與傳播。
本研究中84.2%的CRKP為ST11型,該類型是中國地區CRKP的主要流行克隆群[16]。通過莢膜分型,ST11型可分為K47-ST11及K64-ST11兩個亞克隆型,而近年來K64-ST11型CRKP逐漸取代了K47-ST11型,成為臨床主要流行的亞克隆[20]。本文中,K64-ST11亞克隆型檢出比例高達93.8%,同時SNP分析顯示其具有高度的親緣關系,提示該亞克隆型可能存在醫院內感染播散;且HABSI組菌株多種質粒介導的毒力因子(如rmpA、rmpA2和iucA等)陽性率較高,同時HABSI組中CRKP菌株攜帶IncHI1B型質粒的比例高達63.2%。IncHI1B型質粒是KPN菌株中pLVPK-like毒力質粒的主要分子型別,該型質粒中常攜帶了包括rmpA、rmpA2、iucA及ybtS等在內的多種毒力質粒。毒力質粒pLVPK-like被認為是高毒力KPN(hypervirulent KPN,hvKP)的關鍵分子標志,一般情況下由K1-ST23型及K2-ST86型hvKP天然攜帶[21],這也提示本地區已經存在攜帶IncHI1B型pLVPK-like毒力質粒CRKP菌的醫院感染流行趨勢,應加強防控。
由于納入研究的菌株及病例數量較少,使得本研究存在一定的局限性,需進一步對KPN進行廣度和深度及多部門的協作研究,后續將繼續收集臨床分離菌株,密切監控血流感染中K64-ST11型CRKP菌株的流行趨勢,為制定相應的感染控制措施,防控多重耐藥菌的院內傳播流行提供參考數據。

