對甲酚降解菌對自閉癥小鼠行為及微生物群落-腸道-腦軸影響
張文茂 陳卓 穆紅香 彭贊平
自閉癥為神經系統發育障礙,對患兒的社交功能造成較大不良影響,且本病在我國的發病率呈現升高的趨勢,是臨床控制需求極高的一類疾病。而對自閉癥進行機制研究,有助于治療靶點篩選,因此是臨床研究的重點[1-2]。微生物群落-腸道-腦軸作為近年來在自閉癥研究中的一個重要方面,較多研究認為腸道菌群可通過影響腦腸軸來影響中樞神經系統。有研究顯示,患兒糞便中的對甲酚含量較高,且其含量與自閉癥癥狀密切相關,而對甲酚降解菌可降解對甲酚,可通過腦腸軸進行調控,從而對自閉癥實現治療的作用[3-5]。故本研究探究對甲酚降解菌誘導自閉癥小鼠行為變化及對微生物群落-腸道-腦軸的影響,現報道如下。
1 材料與方法
1.1 一般材料
將2022 年1—2 月的20 只孤獨癥譜系障礙模型(Black and Tan Bachyuric-T+tf/J,BTBR-T+tf/J)近交系小鼠隨機分為研究組(對甲酚降解菌干預組)10 只和對照組(空白質粒大腸桿菌組)10 只,其均于小鼠出生3 周斷奶后進行研究,其中研究組的體質量18~22 g,平均(20.12±0.98)g;對照組的體質量18~22 g,平均(20.06±1.01)g。另選取10 只3 周昆明(Kunming,KM)小鼠為空白組,18~22 g,平均(20.16±0.96)g。三組小鼠均雌雄各半,且三組的體質量比較,差異無統計學意義(P>0.05),具有可比性。
1.2 方法
研究符合動物倫理學要求。動物飼養和操作條件依據《湖南省實驗動物管理辦法》和《實驗動物質量管理辦法》[6]要求嚴格執行。動物房室內溫度控制18~26℃,相對濕度40%~60%。獨立通氣籠具飼養,按12 h 光照12 h 黑暗交替光源。墊料經高溫滅菌消毒處理,飲用水為煮沸冷涼自來水,常規飼料熱量為3.51 kCal/g,研究組的小鼠每2 天1 次,連續服用1 個月:1×1010cfu 新鮮培養的對甲酚降解菌;對照組每2 天1 次,連續服用1 個月:1×1010cfu 新鮮培養的空白質粒大腸桿菌。實驗期間每日更換墊料(代謝籠除外),飲水喂食按實驗要求。均飼養8 周。
1.3 觀察指標
比較三組的行為學實驗(曠場試驗、理毛實驗、大理石包埋實驗及三箱實驗)結果及微生物群落-腸道-腦軸指標[糞便活菌數、腸道組織過氧化氫酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)及總抗氧化能力(total antioxidant capacity,TAC)、海馬組織核因子相關因子-2(NF-E2-related factor,2Nfr-2)及超氧化物歧化酶(superoxide dismutase,SOD)]。
(1)曠場試驗:采用邊長為45 cm 的正方形敞箱進行實驗,分成16 個小正方形,中間4 個小正方形為中央區域,將實驗小鼠置入中央區域,采用追蹤系統軟件(格羅貝爾生物科技有限公司,型號:ANYmaze)對小鼠在敞箱內的移動距離、中央區域停留時間及移動速度進行統計,統計時間為5 min[7]。(2)理毛實驗:將實驗小鼠置入干凈整潔的籠子內,統計其20 min內的理毛次數[8]。(3)大理石包埋實驗:將實驗小鼠置入鼠籠,鼠籠中鋪設新鮮的墊料,放入直徑1.5 cm 大理石彈珠,將實驗小鼠放入30 min,計算被埋藏的大理石彈珠[9]。(4)三箱實驗:將實驗小組置于三個箱體中,三個箱體之間有活動門,實驗前將小鼠放入中間箱體自由活動10 min,然后進行實驗,將小鼠放入左右兩個箱體,實驗小鼠置入中間箱體,記錄10 min,統計小鼠在每個箱體的停留及嗅探時間,進行箱體偏好系數[(小鼠箱體時間-物體箱體時間)/(小鼠箱體時間+物體箱體時間)]及嗅探時間偏好系數[(小鼠嗅探時間-物體嗅探時間)/(小鼠嗅探時間+物體嗅探時間)]的計算[10]。(5)糞便活菌數:分別在第 3、4、5、6、7 周采集小鼠糞便,采用平板活菌計數法進行糞便活菌數的檢測及統計,統計項目為雙歧桿菌、乳桿菌及厭氧菌總數。(6)飼養8 周后采集腸道組織及大腦組織,進行腸道組織CAT、MDA 及TAC,海馬組織Nfr-2 及SOD 的檢測,采用電動勻漿儀(浙江泰林生物技術股份有限公司,型號:HTY-761)制備勻漿,采用每項指標對應的試劑盒進行檢測。
1.4 統計學方法
2 結果
2.1 三組的曠場實驗結果比較
空白組的曠場試驗顯著優于研究組及對照組,研究組則顯著優于對照組(P<0.05),見表1。
表1 三組的曠場實驗結果比較()
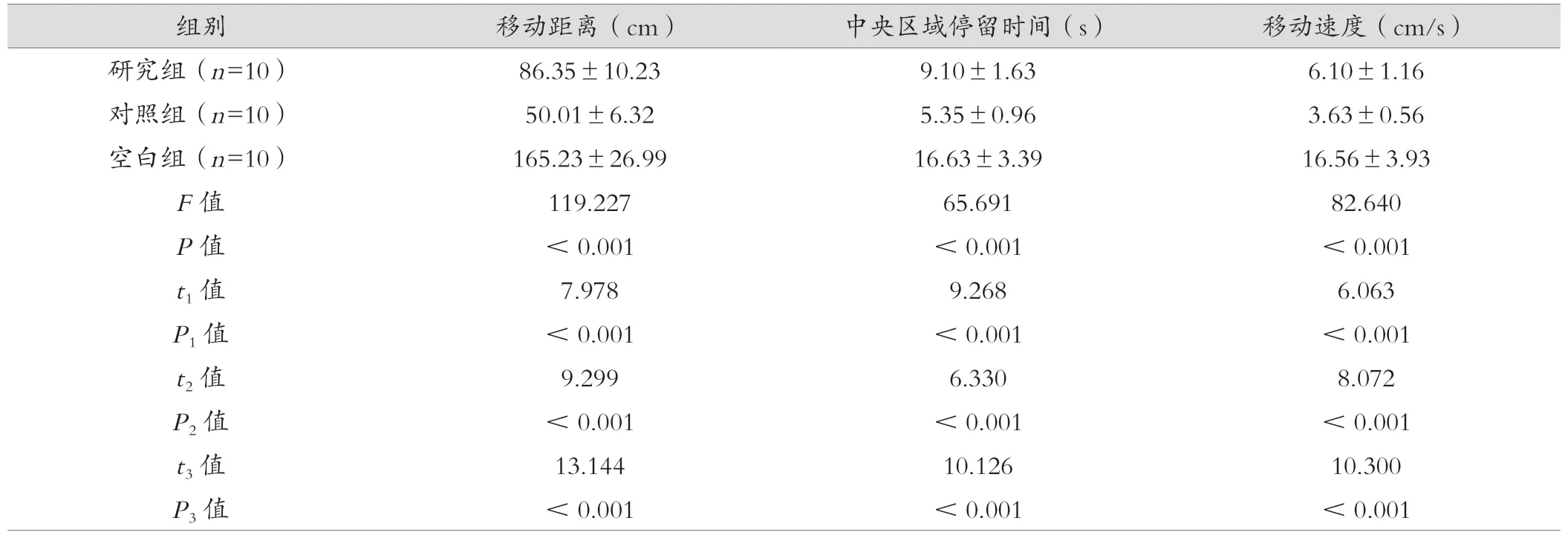
表1 三組的曠場實驗結果比較()
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
2.2 三組的理毛實驗及大理石包埋實驗比較
空白組的理毛實驗及大理石包埋實驗顯著優于研究組及對照組,研究組則顯著優于對照組(P<0.05),見表2。
表2 三組的理毛實驗及大理石包埋實驗比較()

表2 三組的理毛實驗及大理石包埋實驗比較()
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
2.3 三組的三箱實驗比較
空白組的三箱實驗顯著優于研究組及對照組,研究組則顯著優于對照組(P<0.05),見表3。
表3 三組的三箱實驗比較(%,)

表3 三組的三箱實驗比較(%,)
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
2.4 三組的糞便活菌數比較
空白組的糞便活菌數顯著高于研究組及對照組,研究組則顯著高于對照組(P<0.05),見表4。
表4 三組的糞便活菌數比較(cfu/g,)
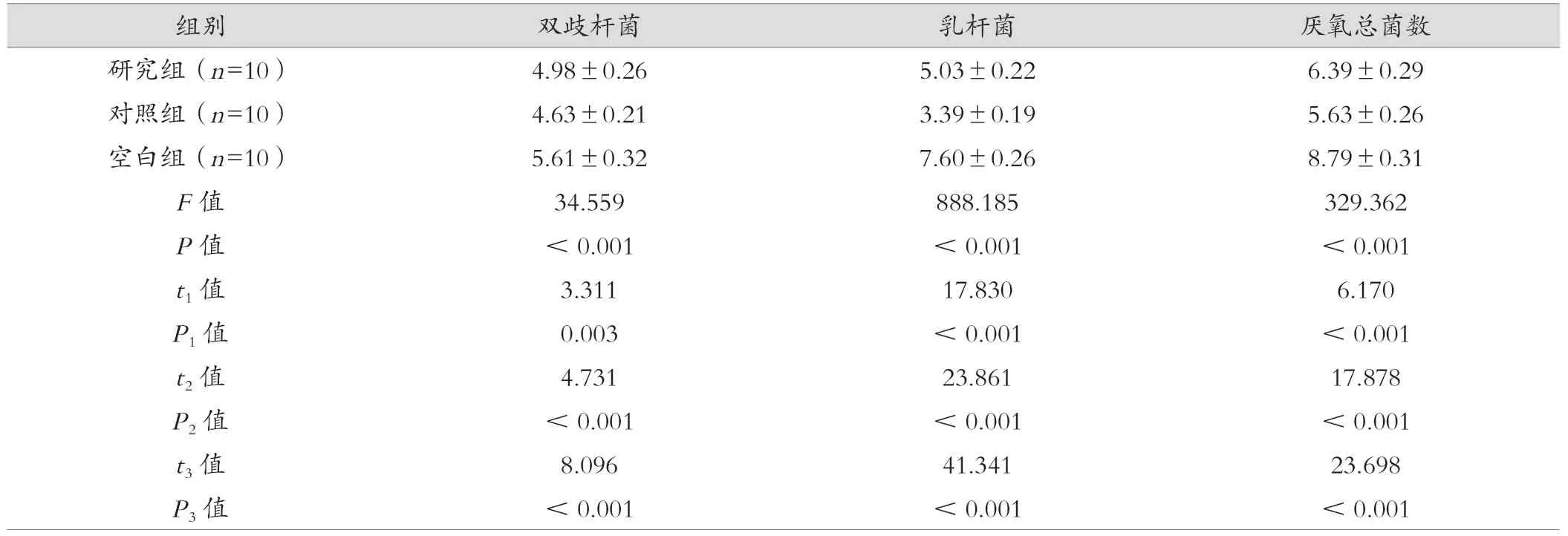
表4 三組的糞便活菌數比較(cfu/g,)
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
2.5 三組的腸道組織CAT、MDA 及TAC 比較
空白組的腸道組織CAT 及TAC 顯著高于研究組及對照組,研究組則顯著高于對照組,腸道組織MDA 顯著低于研究組及對照組,研究組顯著低于對照組(P<0.05),見表5。
表5 三組的腸道組織CAT、MDA 及TAC 比較()

表5 三組的腸道組織CAT、MDA 及TAC 比較()
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
2.6 三組的海馬組織Nfr-2 及SOD 比較
空白組的海馬組織SOD 顯著高于研究組及對照組,研究組則顯著高于對照組,Nfr-2 顯著低于研究組及對照組,研究組顯著低于對照組(P<0.05),見表6。
表6 三組的海馬組織Nfr-2 及SOD 比較()
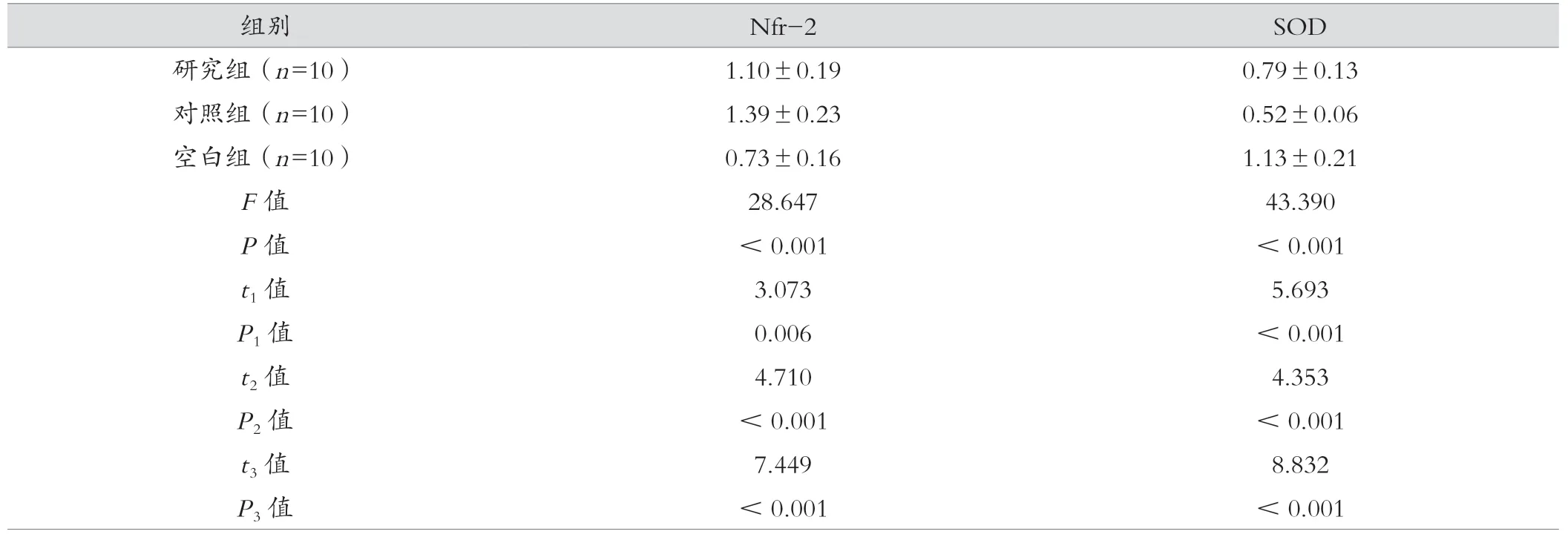
表6 三組的海馬組織Nfr-2 及SOD 比較()
注:t1、P1 為研究組與對照組比較;t2、P2 為研究組與空白組比較;t3、P3 為對照組與空白組比較。
3 討論
臨床中與自閉癥相關的研究中,微生物群落-腸道-腦軸方面的研究日益增多,較多研究認為,腸道微生態的失衡可能是導致自閉癥發生發展的重要原因之一,對腸道微生態失調的干預與調控可能是治療本病的有效方式之一[12]。腦腸軸作為腦、腸之間的雙相生理通信網絡,腸道菌群可通過影響腦腸軸來達到影響中樞神經系統的作用,因此認為微生物介導可能會對自閉癥起到一定的治療干預作用。有研究顯示[13],自閉癥患兒的腸道對甲酚含量顯著升高,且其含量與自閉癥癥狀呈正相關,因此對自閉癥患兒進行治療的過程中,通過降解對甲酚來達到調控腦腸軸的方式,對疾病進行控制與改善的研究意義較高。而對甲酚降解菌可對對甲酚起到降解的作用[14],因此認為,對甲酚降解菌可能與自閉癥起到一定的影響作用,但是相關方面的研究相對不足。
本研究結果顯示,空白組小鼠的上述行為學實驗結果及微生物群落-腸道-腦軸指標指標顯著優于對甲酚降解菌干預及空白質粒大腸桿菌干預的小鼠,而對甲酚降解菌干預的小鼠,上述方面的檢測與評估結果均顯著優于空白質粒大腸桿菌干預的小鼠(P<0.05),因此認為對甲酚降解菌誘導自閉癥小鼠行為變化的優勢較為突出,且可對微生物群落-腸道-腦軸相關方面的檢測指標具有較好的改善作用,因此對于自閉癥的治療與改善效果較好。分析原因,對甲酚降解菌通過降解對甲酚來達到影響腸道狀態的作用,進而影響到腸道菌群失衡的情況[15],而這一與改善腸道組織CAT、MDA 及TAC 具有積極的作用,有助于調控其抗氧化失衡的情況,進而影響到腦部,表現為海馬組織Nfr-2 及SOD 表達的改善,而這是其神經保護作用中的一個重要環節,而上述幾個方面均有助于改善自閉癥的狀態[16],因此小鼠的相關行為變化更為突出。
綜上所述,研究認為對甲酚降解菌可改善自閉癥小鼠的相關行為,可能為通過影響微生物群落-腸道-腦軸來達到影響疾病的目的。此文的研究結果為自閉癥后期標準制定提供了借鑒內容。

