基于術前NLR、LMR、CEA和CA19-9對結腸癌根治術后預后列線圖預測模型的構建及評價
蔣永杰,寇邦國,杜文龍,邊攀,李兵太,尹蘭寧,2*
1蘭州大學第二醫院普通外科,甘肅 蘭州 730030;2蘭州大學第二醫院西固醫院,甘肅 蘭州 730060
結腸癌是消化道最常見的惡性腫瘤之一,主要特點為發病率高、預后差,近年來其發病率和病死率在國人癌癥中均居第4位,在消化道惡性腫瘤中均居第1位,且呈逐年上升趨勢[1-4]。目前絕大多數患者就診時已處于中晚期,且行結腸癌根治術治療的患者預后差異較大。因此,制定綜合性、個體化的治療方案,以改善預后,以及尋找有效的影響結腸癌根治術預后的臨床病理因素特別是簡單、實用、經濟的預后影響因素尤為重要。有研究發現,癌癥相關炎癥反應促進了惡性腫瘤的發生發展,并與患者的生存有關[5]。臨床上反映全身炎癥反應的常規指標是白細胞(如中性粒細胞、淋巴細胞和單核細胞等)及急性期蛋白。研究發現,中性粒細胞可通過分泌細胞因子和趨化因子促進腫瘤微環境的形成,從而促進腫瘤細胞的增殖和轉移[6]。淋巴細胞在癌癥免疫監測中起著至關重要的作用,可通過介導細胞毒性和細胞死亡來抑制腫瘤細胞的增殖和生長[7]。因此,中性粒細胞/淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)可反映腫瘤炎癥狀態與抗腫瘤免疫狀態之間的平衡,二者比例失衡可能與腫瘤的發生和發展有關,較高的NLR提示機體可能處于炎癥反應激活和抗腫瘤免疫抑制狀態[8]。來自外周單核細胞的腫瘤相關巨噬細胞可抑制獲得性免疫反應并促進腫瘤細胞的生長和腫瘤滋養層血管生成,進而引起腫瘤侵襲和轉移[9]。此外,研究發現,單核細胞還可通過調節中性粒細胞和腫瘤相關巨噬細胞分泌相關細胞因子來影響腫瘤干細胞的活性,從而降低腫瘤對化療的敏感性[10]。研究發現,NLR和淋巴細胞/單核細胞比值(lymphocyte to monocyte ratio,LMR)作為評價全身免疫炎癥相關的重要指標,在結直腸癌的診斷和預后預測中具有一定的臨床應用價值[11-13]。此外,循環血癌胚抗原(carcinoembryonic antigen,CEA)和糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)是臨床常用的消化道惡性腫瘤輔助診斷指標,尤其在結腸癌的輔助診斷中具有較高的特異性,在臨床上應用廣泛[14-15]。有研究發現,血清CEA、CA19-9水平不僅與結腸癌的發病有關,且與患者預后相關[16-17]。本研究旨在分析術前NLR、LMR、CEA和CA19-9對結腸癌根治術(R0)患者預后的影響,并構建結腸癌根治術后1、2、3年生存率的列線圖預測模型,以期為臨床提供一種更為便捷的預后預測方式。
1 資料與方法
1.1 研究對象 回顧性分析2014年4月-2018年12月在蘭州大學第二醫院普通外科行結腸癌根治術的185例結腸癌患者的臨床病理資料。納入標準:(1)經病理檢查確診為結腸癌;(2)臨床化驗檢查及病理資料完整;(3)術前未接受過新輔助放化療;(4)腫瘤行根治性R0切除;(5)術后行奧沙利鉑聯合化療。排除標準:(1)術后發生嚴重并發癥致生存時間<30 d;(2)重復癌或并發直腸癌;(3)既往存在其他惡性腫瘤病史;(4)存在炎癥性疾病的感染證據或病史,影響血常規結果;(5)存在精神性疾病或其他嚴重內科疾病。本研究經蘭州大學第二醫院醫學倫理委員會審批(2022A-039),所有患者均已簽署知情同意書。
1.2 方法 按照結腸癌術后標準方案對所有患者進行隨訪。術后2年內每3個月隨訪1次,第2~5年每半年隨訪1次,5年后每年隨訪1次。隨訪內容包括血常規,腫瘤標志物(CEA、CA19-9),胸部、腹部和盆腔增強CT,以及腸鏡等。結局指標為總生存期(overall survival,OS)和無病生存期(disease-free survival,DFS)。OS定義為手術日期至患者死亡的時間,DFS定義為手術日期至患者因結腸癌發生復發、轉移或死亡的時間。末次隨訪截止時間為2020年7月。
1.3 NLR、LMR、CEA和CA19-9的最佳截斷值 采用受試者工作特征(receiver operator characteristic,ROC)曲線分析NLR、LMR、CEA和CA19-9預測結腸癌根治術后患者總生存狀態(生存/死亡)的最佳截斷值[由約登指數(Youden index)確定,約登指數=靈敏度+特異度-1,在約登指數最大處取最佳截斷值],根據NLR、LMR的最佳截斷值將患者分為高NLR組與低NLR組、高LMR組與低LMR組。
1.4 列線圖預測模型的構建及評價 使用R4.1.1軟件分析結腸癌根治術后患者DFS的影響因素,將Cox風險比例回歸模型中的獨立危險因素引入rms包,繪制列線圖。
1.4.1 區分度評價 采用一致性指數(C指數)評價列線圖預測模型的區分度,C指數在0.50~0.70為準確度較低,0.71~0.90為準確度中等,高于0.90則為準確度高。
1.4.2 一致性分析 采用校準曲線分析列線圖預測模型的一致性,預測模型對應曲線與校準圖中45°對角線貼合度越高表明模型預測結果與實際情況一致性越好。
1.4.3 列線圖預測模型風險分層 使用X-tile軟件根據Cox風險得分對列線圖預測模型進行風險分層,以低、中、高風險三個水平分別對應患者預后良好、中等、差三個分組。
1.5 統計學處理 采用SPSS 26.0軟件進行統計分析。計量資料以±s表示,兩組間比較采用t檢驗;計數資料以例(%)表示,兩組間比較采用χ2檢驗或Fisher's精確檢驗。使用Kaplan-Meier法和log-rank檢驗分析兩組生存的差異,使用Cox比例風險回歸模型分析影響結腸癌根治術后患者預后的因素。使用GraphPad Prism 7.00軟件繪制生存曲線。檢驗水準為α=0.05。
2 結 果
2.1 一般資料 入選符合納入排除標準的結腸癌患者2 2 9 例,失訪4 4 例,最終納入1 8 5例。其中男111例(60.0%),女74例(40.0%);年齡23~79(55.0±11.7)歲;臨床分期Ⅰ-Ⅱ期98例(53.0%),Ⅲ-Ⅳ期87例(47.0%);NLR為2.98(1.1~48.6),LMR為3.75(0.4~11.4)。185例患者術后1、2、3、5年累計總生存率分別為88.7%、83.8%、82.7%、81.1%,累積無復發生存率分別為83.8%、76.2%、71.9%、66.7%。
2.2 NLR、LMR、CEA和CA19-9預測結腸癌根治術后患者總生存狀態的ROC曲線分析 NLR、LMR、CEA和CA19-9預測結腸癌根治術后患者總生存狀態的ROC曲線如圖1所示,其AUC分別為0.784、0.672、0.727和0.656,最佳截斷值分別為3.40、3.25、4.30 ng/ml和21.82 U/ml。
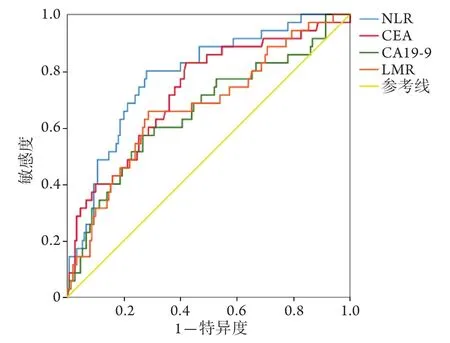
圖1 NLR、LMR、CEA和CA19-9預測結腸癌根治術后患者總生存狀態的ROC曲線Fig.1 ROC curves of NLR, LMR, CEA and CA19-9 predicting overall survival situation of patients with colon cancer after radical resection
2.3 術前NLR、LMR與結腸癌臨床病理特征的關系 根據NLR、LMR的最佳截斷值將患者分為低NLR組(≤3.40,n=115)與高NLR組(>3.40,n=70)、低LMR組(≤3.25,n=74)與高LMR組(>3.25,n=111)。高NLR組與低NLR組患者腫瘤浸潤深度、腫瘤最大徑和術前CEA水平比較,差異有統計學意義(P<0.05);高LMR組與低LMR組患者腫瘤浸潤深度、腫瘤部位和腫瘤最大徑比較,差異有統計學意義(P<0.05,表1)。
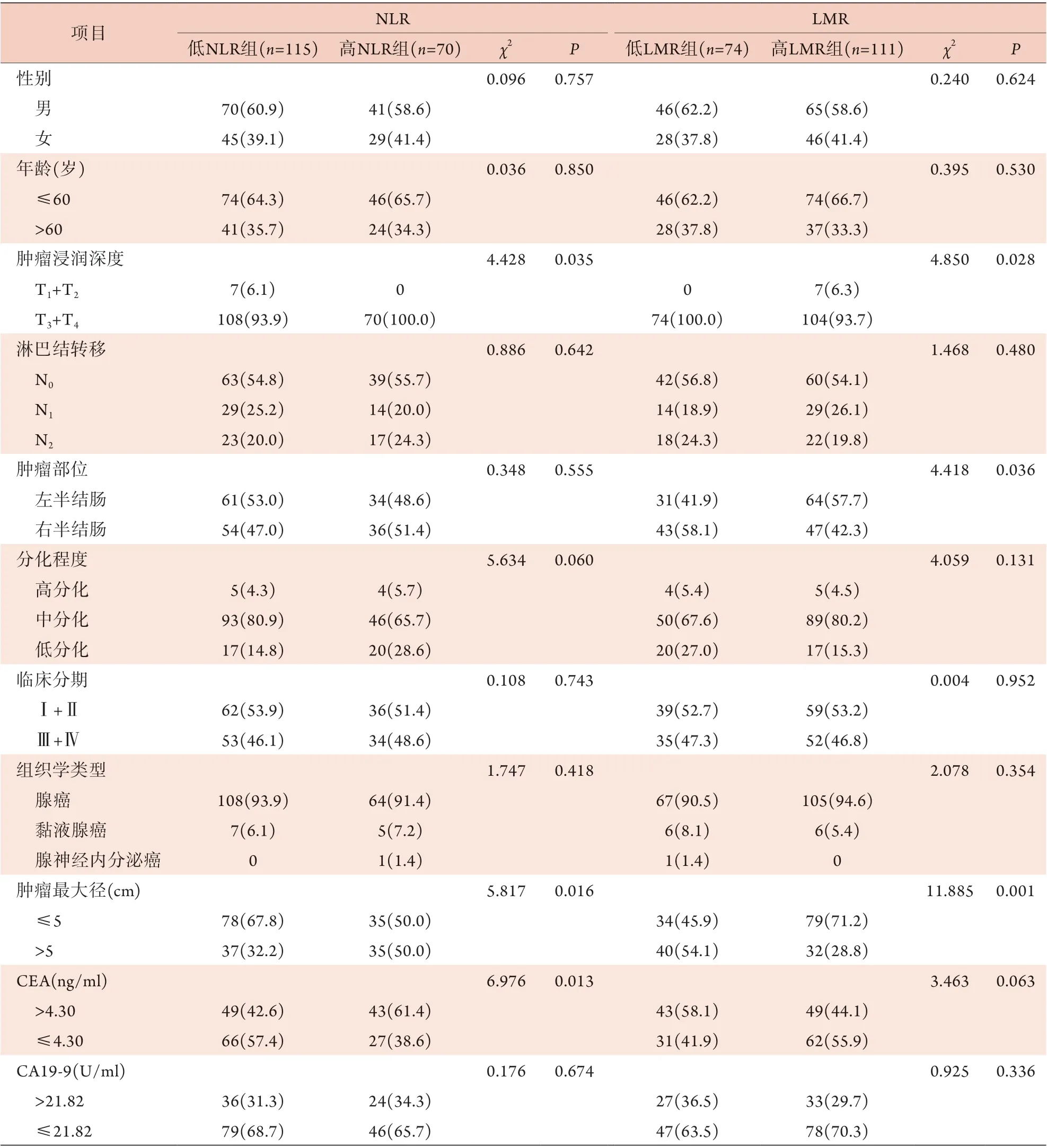
表1 術前NLR、LMR與結腸癌臨床病理特征的關系[例(%)]Tab.1 Relationship between preoperative NLR, LMR and clinicopathological features of colon cancer [n(%)]
2.4 結腸癌根治術后患者生存分析 隨訪截至2020年7月,共隨訪3~68個月,中位隨訪時間為32個月,其中52例(28.1%)出現腫瘤復發,死亡35例(18.9%),累積無病生存率為71.89%,累積總生存率為81.08%。Kaplan-Meier法和log-rank檢驗結果顯示,高NLR組患者的OS和DFS明顯短于低NLR組,低LMR組患者的OS和DFS明顯短于高LMR組(P<0.001)(圖2)。
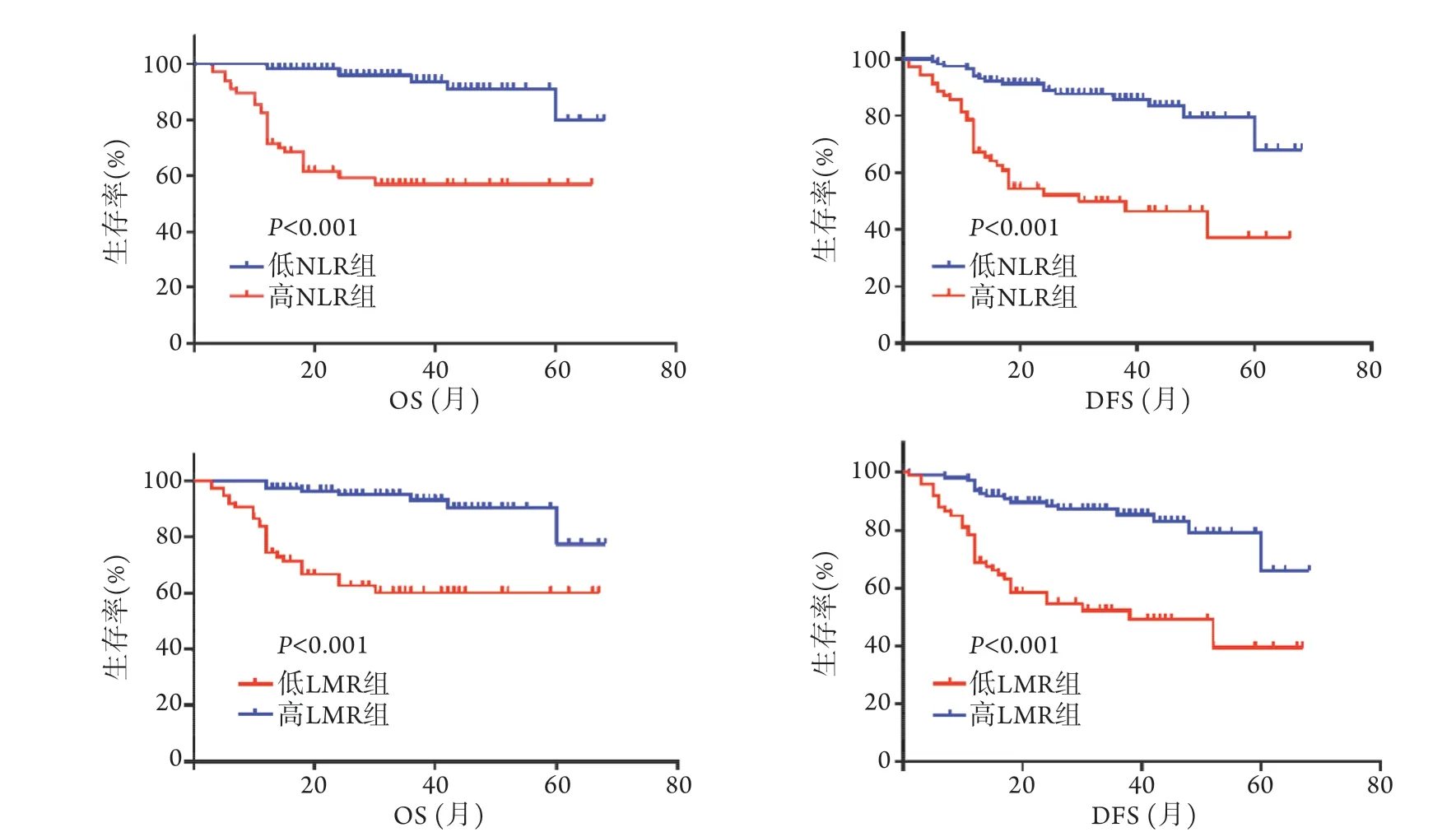
圖2 不同NLR、LMR結腸癌患者的總生存期(OS)和無病生存期(DFS)曲線Fig.2 Survival curves of overall survival (OS) and disease-free survival (DFS) of patients with different NLR and LMR
2.5 影響結腸癌根治術后患者生存的單因素和多因素Cox回歸分析 單因素分析結果顯示,性別、年齡、腫瘤浸潤深度、腫瘤分化程度、腫瘤部位和腫瘤最大徑與結腸癌根治術后患者的OS和DFS無關(P>0.05),而淋巴結轉移、組織學類型、臨床分期、NLR、LMR、CEA及CA19-9與結腸癌根治術后患者的OS和DFS有關(P<0.05)(表2)。
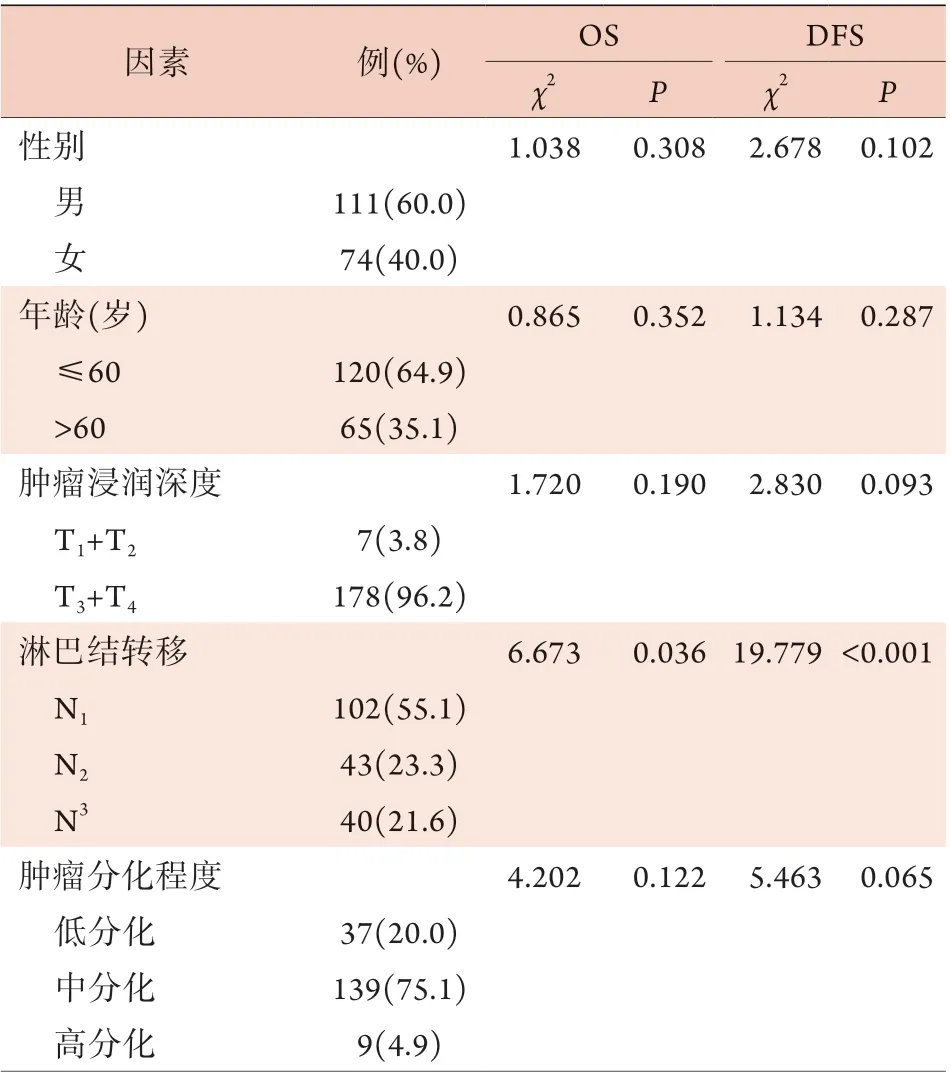
表2 影響結腸癌根治術后患者生存的單因素分析Tab.2 Univariate analysis of survival of colon cancer patients after radical resection
(續 表)
將單因素分析中P<0.05的因素納入多因素Cox回歸分析,結果顯示,NLR、CEA及組織學類型為結腸癌根治術后患者OS的獨立影響因素(P<0.05),而NLR、LMR、CEA、CA19-9及臨床分期為結腸癌根治術后患者DFS的獨立影響因素(P<0.05),其中LMR為保護性因素(表3)。
表3 影響結腸癌根治術后患者生存的多因素Cox回歸分析Tab.3 Cox regression analysis of survival of colon cancer patients after radical resection
2.6 預測結腸癌根治術后患者1、2、3年DFS的列線圖 使用R4.1.1軟件,納入多因素Cox回歸分析中影響DFS的因素(NLR、LMR、CEA、CA19-9及臨床分期)建立函數模型并繪制列線圖,這些因素的每一個數字或類別在分數量表上的分數相加,對應在總分標上,向下畫直線,與1、2、3年無病生存率坐標軸的交點表示生存概率(圖3)。

圖3 預測結腸癌根治術后患者1、2、3年DFS的列線圖Fig.3 Nomogram for predicting DFS at 1, 2, and 3 years in colon cancer patients after radical resection
2.7 列線圖預測模型的效能評價
2.7.1 區分度評價和一致性分析 列線圖預測模型C指數為0.851(95%CI 0.804~0.899),表明該模型具有較好的區分度;一致性分析結果顯示,列線圖預測模型所得無病生存率曲線與校準圖中45°對角線貼合度較高,提示該預測模型有較好的一致性(圖4)。
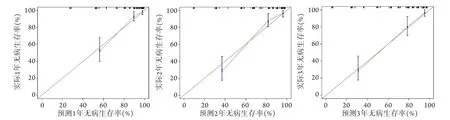
圖4 預測結腸癌根治術后患者1、2、3年無病生存率的列線圖預測模型校準圖Fig.4 Calibration chart of the nomogram prediction model for predicting the 1, 2, and 3 years disease-free survival rate of patients with colon cancer after radical resection
2.7.2 列線圖預測模型風險分層 使用R4.1.1軟件計算列線圖預測模型風險得分,然后使用X-tile軟件將該模型根據Cox風險得分分為低(<3.9分)、中(3.9~14.6分)、高(>14.6分)風險三個水平(圖5),分別對應患者預后良好、中等、差三個分組,Kaplan-Meier生存曲線分析顯示,低風險組的DFS明顯優于中、高風險組(P<0.001)。
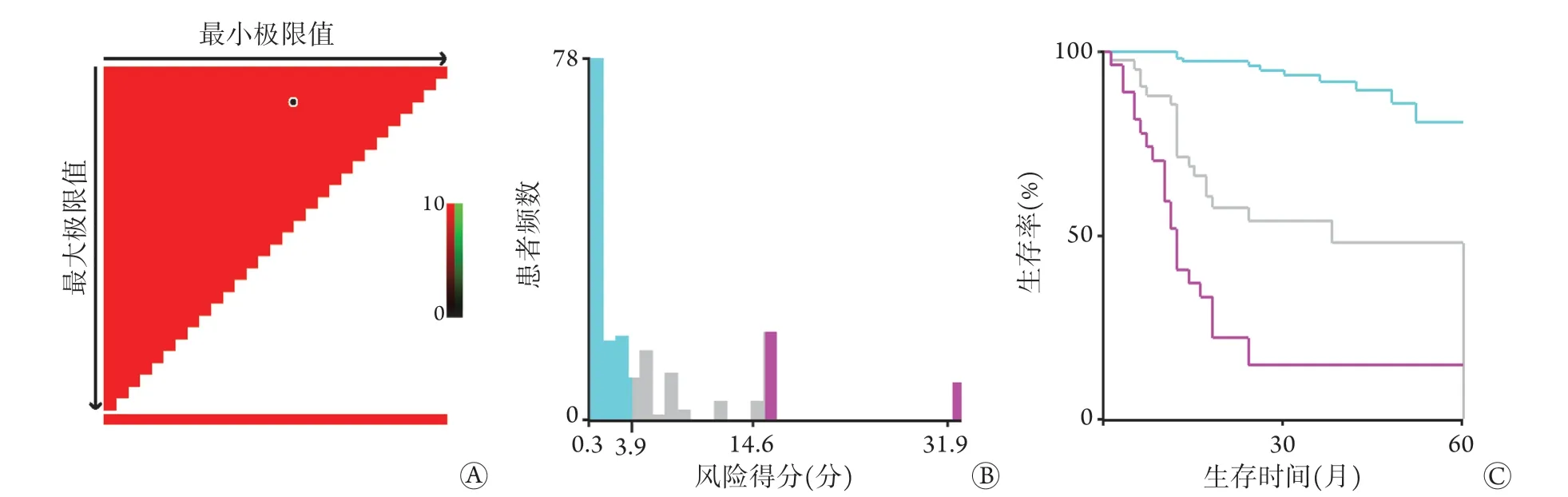
圖5 X-tile軟件風險分層列線圖預測模型Fig.5 X-tile software risk stratification nomogram prediction model
3 討 論
大量研究發現,炎癥與腫瘤的發生發展關系密切[18],腫瘤相關炎癥可誘導腫瘤本身或周圍細胞表達各種分子如腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、IL-17等,從而形成可能促進腫瘤進展的微環境[19-21]。Ostan等[22]發現,炎癥反應觸發了基因突變或表觀遺傳機制的改變,從而促進了癌癥的轉移和進展,而干預炎癥反應能夠降低癌癥發生、進展的風險。目前有研究報道,多種炎癥相關標志物與結直腸癌患者的預后相關,多種炎性因子聯合應用可進一步提高對結直腸癌患者預后的預測效能,其中NLR、LMR是機體炎癥反應的標志物,可作為評估結直腸癌患者預后的指標[23-25]。然而由于研究設計和樣本量的差異,LMR與結直腸癌患者預后的關系尚存在爭議[26]。NLR被證實與肺癌、胃癌、卵巢癌等多種惡性腫瘤的預后明顯相關,可作為這些腫瘤的預后指標[27-29],而LMR可作為食管癌、胃癌、乳腺癌等惡性腫瘤的預后評估指標[30-32]。此外,有研究發現,術前血小板/淋巴細胞比值(platelet to lymphocyte ratio,PLR)、預后營養指數(prognostic nutritional index,PNI)和系統免疫炎癥指數(systemic immune-inflammation index,SII)可作為結腸癌根治術后患者預后的預測指標,但相關研究結果不一致[33-35]。CEA是一種提取自結腸癌和胚胎組織中的多糖蛋白復合物,其中90%由結直腸癌產生,常與細胞黏附相關,術前CEA水平升高常被認為是預后不良的信號,與結腸癌根治術后總生存率降低存在相關性[36];CA19-9是一種黏蛋白型的糖類蛋白抗原,可介導腫瘤細胞與血管內皮細胞黏附而促使腫瘤發生遠處轉移,故其可能對轉移性結腸癌有一定預測價值[37-38]。
本研究基于術前免疫炎癥指標NLR、LMR與腫瘤標志物CEA、CA19-9,聯合臨床病理特征分析影響結腸癌根治術后患者生存的危險因素,結果顯示,高NLR、CEA、CA19-9及低LMR的患者預后較差,與既往研究結果一致[23-24]。分析原因為,高NLR、低LMR提示淋巴細胞減少,中性粒細胞或單核細胞增多。淋巴細胞減少可能導致機體免疫系統對腫瘤的免疫反應降低[7];中性粒細胞可通過分泌細胞因子和趨化因子促進腫瘤微環境的形成,從而促進腫瘤細胞的增殖和轉移[6],而來自外周單核細胞的腫瘤相關巨噬細胞可抑制獲得性免疫反應并促進腫瘤細胞生長和腫瘤滋養層血管生成,進而引起腫瘤的侵襲和轉移[9]。本研究分析NLR、LMR與結腸癌臨床病理特征的關系發現,高NLR組與低NLR組患者在腫瘤浸潤深度、腫瘤最大徑和術前CEA水平等方面差異明顯(P<0.05),而高LMR組與低LMR組患者在腫瘤浸潤深度、腫瘤部位和腫瘤最大徑等方面差異明顯(P<0.05),提示高NLR和低LMR患者的腫瘤更具侵襲性,但導致該結果的具體機制目前尚不清楚。單因素分析發現,淋巴結轉移、組織學類型、臨床分期、NLR、LMR、CEA及CA19-9等與結腸癌根治術后患者的OS和DFS有關(P<0.05);進一步行多因素Cox回歸分析發現,NLR、CEA及組織學類型為結腸癌根治術后患者OS的獨立影響因素,而NLR、LMR、CEA、CA19-9及臨床分期是結腸癌根治術后患者DFS的獨立影響因素(P<0.05),其中LMR為保護性因素。
列線圖可量化及預測某一臨床事件發生的概率,從而指導臨床決策和風險分層[39-40]。本研究納入了Cox回歸分析中影響結腸癌根治術后患者DFS的獨立影響因素(NLR、LMR、CEA、CA19-9和臨床分期),構建了基于這些因素的列線圖預測模型(基于OS影響因素的列線圖預測模型效能較低,且預測價值不高,結果未呈現),并進行了一致性分析和區分度評價,結果表明,該列線圖模型具有良好的預測效能。通過X-tile軟件根據Cox風險得分將該模型進行風險分層,以低(<3.9分)、中(3.9~14.6分)、高(>14.6分)風險三個水平分別對應患者預后良好、中等、差三個分組,顯示出了良好的臨床應用價值。
綜上所述,本研究結果表明,NLR、LMR、CEA、CA19-9和臨床分期可作為結腸癌根治術后患者預后的預測指標,包含這些指標的列線圖預測模型可更好地預測預后,將該預測模型根據Cox風險得分進行風險分層后更方便臨床應用,有助于推動個體化診療。但本研究為單中心回顧性研究,樣本量較少,且存在選擇偏倚,獲得的NLR及LMR的截斷值可能與其他同類研究有所不同,且隨訪達5年的患者較少,代表性差,因此構建的列線圖模型未對5年無病生存率進行預測,后續須進行多中心、大樣本、前瞻性的臨床試驗對該結果加以驗證。

