自噬在脂多糖誘導(dǎo)的A549細(xì)胞炎癥反應(yīng)中的作用及機(jī)制研究
時(shí)佳 陶慧嫻 郭艷 鄒蕓蘇 王木子 盧志濤 丁溢芳 許衛(wèi)東 周曉光
(1.南京醫(yī)科大學(xué)附屬兒童醫(yī)院新生兒醫(yī)療中心,江蘇南京 210008;2.張家港市第一人民醫(yī)院新生兒科,江蘇張家港 215600)
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是機(jī)體在遭受各種病理刺激(如缺氧、感染、休克等)后發(fā)生的一種急性肺損傷(acute lung injury,ALI),是新生兒臨床常見的危重癥。其特征是肺泡-毛細(xì)血管膜屏障遭到破壞,從而增強(qiáng)炎癥細(xì)胞的遷移能力和促炎細(xì)胞因子的產(chǎn)生,使炎癥反應(yīng)失控[1]。迄今為止,ARDS的發(fā)病率和病死率一直居高不下。因此,迫切需要闡明新生兒ARDS的發(fā)病機(jī)制以制訂相應(yīng)的防治措施。
自噬是一種古老的、進(jìn)化保守的細(xì)胞內(nèi)消化和再循環(huán)途徑,主要包括巨自噬、微自噬和分子伴侶介導(dǎo)的自噬3種類型,對(duì)于維持細(xì)胞的正常功能及細(xì)胞穩(wěn)態(tài)具有重要作用。巨自噬以其處理大型細(xì)胞內(nèi)結(jié)構(gòu)的能力著稱,雙膜囊泡結(jié)構(gòu)的自噬體也成為其區(qū)別于另外兩種自噬形式的特征。自噬參與人類多種疾病的發(fā)生、發(fā)展過程,本研究主要對(duì)巨自噬(以下簡稱“自噬”)進(jìn)行研究。自噬被認(rèn)為是應(yīng)對(duì)炎癥的一種基本細(xì)胞反應(yīng),其相關(guān)途徑(如微管相關(guān)蛋白輕鏈3相關(guān)吞噬作用和非常規(guī)分泌等)是免疫和炎癥的核心穩(wěn)態(tài)機(jī)制[2]。一般來說,自噬有助于宿主激活免疫以控制感染,同時(shí)限制有害的、不受控制的炎癥反應(yīng)。在先天免疫系統(tǒng)中,Toll 樣受體4(Toll-like receptor 4,TLR4) 是一種重要的模式識(shí)別受體(pattern recognition receptor,PRR),PRR 通過識(shí)別病原體相關(guān)分子模式或危險(xiǎn)相關(guān)分子模式,調(diào)節(jié)先天免疫或炎癥過程[3]。TLR4 也是第1 個(gè)被證明參與自噬 過 程 的 受 體[4]。 TLR4 經(jīng) 脂 多 糖(lipopolysaccharide,LPS)激活后產(chǎn)生的細(xì)胞因子參與病原體的清除,對(duì)機(jī)體有益;但當(dāng)該過程失調(diào)時(shí),可能會(huì)導(dǎo)致危及生命的病理生理改變,如新生兒ARDS[5]。因此,TLR4 被認(rèn)為是一個(gè)重要的藥理學(xué)靶點(diǎn)。目前有關(guān)自噬與新生兒ARDS發(fā)病關(guān)系的研究報(bào)道極少,自噬在新生兒ARDS炎癥反應(yīng)所致肺損傷中的作用與機(jī)制尚不明了。本實(shí)驗(yàn)利用LPS 誘導(dǎo)人肺泡上皮A549 細(xì)胞(簡稱“A549細(xì)胞”)炎癥反應(yīng)來模擬新生兒ARDS發(fā)病過程中失控的炎癥反應(yīng)與肺損傷變化,旨在探討自噬在炎癥反應(yīng)導(dǎo)致肺損傷過程中的作用及其機(jī)制,為新生兒ARDS的防治提供新的途徑和實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 細(xì)胞和主要試劑
人肺泡上皮細(xì)胞株A549(上海中喬新舟生物科技有限公司);DMEM 高糖培養(yǎng)基(Gibco,美國);磷酸緩沖鹽溶液、內(nèi)參β-actin(武漢賽維爾生物科技有限公司);胎牛血清(PAN,德國);LPS、兔抗LC3B、P62 抗體(Sigma,美國);兔抗Beclin-1 抗體(Abcam,英 國);兔抗NLRP3、TLR4抗體(北京博奧森生物技術(shù)有限公司);兔抗Caspase-1、ASC 抗體、內(nèi)參GAPDH(武漢三鷹生物技術(shù)有限公司);辣根過氧化物酶標(biāo)記山羊抗兔IgG抗體(南京巴傲得生物科技有限公司);3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素(rapamycin,RAPA)(MCE,美國);CCK-8 試劑盒 (Dojindo, 日 本); LipofectamineTM2000(Invitrogen Life Technologies,美國);人源TLR4 過表達(dá)載體質(zhì)粒、TLR4 siRNA(均由南京銳博生物科技有限公司設(shè)計(jì));RIPA裂解液(上海碧云天生物技術(shù)有限公司)。
1.2 A549細(xì)胞培養(yǎng)及實(shí)驗(yàn)分組
向人肺泡上皮細(xì)胞株A549 細(xì)胞中施加含10%胎牛血清的DMEM 高糖培養(yǎng)基,置于37℃、5%CO2的培養(yǎng)箱中培養(yǎng)。當(dāng)細(xì)胞密度長至90%后棄培養(yǎng)液,磷酸緩沖鹽溶液清洗2 次,以0.25%EDTA 胰酶消化細(xì)胞,調(diào)整細(xì)胞密度接種于細(xì)胞培養(yǎng)板中,培養(yǎng)至細(xì)胞穩(wěn)定貼壁。
(1)濃度梯度分組:加入不同濃度(0、1、5、10 μg/mL)的LPS 工作液,刺激12 h;時(shí)間梯度分組:加入濃度為1 μg/mL 的LPS 工作液,刺激不同的時(shí)間(0、4、8、12、24 h)。收樣前0.5 h加入三磷酸腺苷(adenosine triphosphate,ATP)(濃度為5 mmol/L)。收集各組細(xì)胞沉淀,用于后續(xù)蛋白檢測(cè)。
(2)細(xì)胞自噬抑制實(shí)驗(yàn)分為:對(duì)照組、LPS組、3-MA組、3-MA+LPS組。3-MA組和3-MA+LPS組加入濃度為5 mmol/L 的自噬抑制劑3-MA 與細(xì)胞共培養(yǎng)12 h。細(xì)胞自噬激動(dòng)實(shí)驗(yàn)分為:對(duì)照組、LPS 組、RAPA 組、RAPA+LPS 組。RAPA 組 和RAPA+LPS 組加入濃度為100 nmol/L 的自噬激動(dòng)劑RAPA 與細(xì)胞共培養(yǎng)12 h。LPS 的處理濃度為1 μg/mL,處理時(shí)間為12 h。收樣前0.5 h加入ATP。收集各組細(xì)胞沉淀,用于后續(xù)蛋白檢測(cè)。
(3)細(xì)胞轉(zhuǎn)染實(shí)驗(yàn)分兩部分,每部分各分4組:TLR4 過表達(dá)對(duì)照組、TLR4 過表達(dá)組、TLR4過表達(dá)對(duì)照+LPS 組、TLR4 過表達(dá)+LPS 組;TLR4沉默對(duì)照組、TLR4 沉默組、TLR4 沉默對(duì)照+LPS組、TLR4沉默+LPS組。
1.3 細(xì)胞轉(zhuǎn)染
將細(xì)胞接種至6 孔板中,待細(xì)胞密度長至40%~60%時(shí)進(jìn)行轉(zhuǎn)染。轉(zhuǎn)染前2 h 對(duì)細(xì)胞進(jìn)行換液。通過構(gòu)建質(zhì)粒載體過表達(dá)TLR4,使用siRNA沉默TLR4,針對(duì)質(zhì)粒和siRNA 進(jìn)行轉(zhuǎn)染工作液的配制:將4 μg 的TLR4 過表達(dá)/空載質(zhì)粒DNA 和10 μL 濃 度 為20 μmol/L 的TLR4 siRNA 及 其 對(duì) 照siRNA 加至250 μL 的無血清培養(yǎng)基中,混勻,再將5~10 μL 的LipofectamineTM2000 加至另外250 μL的無血清培養(yǎng)基中,混勻,室溫靜置5 min,再將兩者混合,室溫靜置20 min。從每孔中吸出500 μL培養(yǎng)基棄去,再按每孔500 μL 將上述配制的混合液加入,混勻,4~6 h 后換液,轉(zhuǎn)染48 h。收樣前0.5 h 加入ATP(濃度為5 mmol/L)。收集各組細(xì)胞沉淀,用于后續(xù)蛋白檢測(cè)。
1.4 CCK-8法檢測(cè)細(xì)胞存活率
將細(xì)胞接種于96孔板中培養(yǎng)12~24 h。以濃度為0、1、5、10 μg/mL 的LPS 刺激12 h;以濃度為1 μg/mL的LPS分別刺激0、4、8、12、24 h,收樣前0.5 h 加入ATP,后每孔加入10 μL 的CCK-8 溶液,1~4 h 后應(yīng)用酶標(biāo)儀檢測(cè)450 nm 處各孔吸光度。實(shí)驗(yàn)獨(dú)立重復(fù)3次。
1.5 Western blot法檢測(cè)蛋白表達(dá)
采用RIPA 裂解液提取細(xì)胞總蛋白,并經(jīng)二喹啉甲酸法測(cè)定蛋白質(zhì)濃度。通過SDS-PAGE電泳分離蛋白后轉(zhuǎn)移到PVDF 膜上,5%脫脂牛奶室溫封閉2 h,分別孵育相應(yīng)抗體:微管相關(guān)蛋白1 輕鏈3B (microtubule associated protein 1 light chain 3 beta, MAP1LC3B, LC3B) 、 Beclin-1、 P62、NLRP3、Caspase-1、ASC、TLR4(均為1∶1 000配制),4℃過夜。TBST 洗膜(10 min×3 次),室溫 孵 育 二 抗 (1∶5 000) 1 h, TBST 洗 膜(10 min×3 次),用ECL 發(fā)光劑熒光顯色,在化學(xué)發(fā)光凝膠成像系統(tǒng)曝光觀察蛋白條帶。以GAPDH(1∶5 000)或β-actin(1∶1 000)作為內(nèi)參,分析各條帶灰度值。實(shí)驗(yàn)獨(dú)立重復(fù)3次。
1.6 統(tǒng)計(jì)學(xué)分析
采用GraphPad Prism 8.0 進(jìn)行分析和統(tǒng)計(jì)。正態(tài)分布的計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(±s)表示,兩組間比較采用兩樣本t檢驗(yàn),多組間比較采用方差分析,組間兩兩比較采用LSD-t法。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 LPS刺激對(duì)A549細(xì)胞存活率的影響
在培養(yǎng)的A549 細(xì)胞中以不同濃度(0、1、5、10 μg/mL) 的LPS 刺 激12 h, 與0 μg/mL 組(100.0%±0.0%) 相 比, 1 μg/mL 組(86.0%±1.2%),5 μg/mL組(72.8%±1.9%)和10 μg/mL組(63.6%±1.0%)的細(xì)胞存活率隨LPS 濃度的增加逐漸降低;以1 μg/mL的LPS在A549細(xì)胞中刺激不同 的 時(shí) 間(0、4、8、12、24 h),與0 h 組(100.0%±0.0%) 相比,細(xì)胞存活率在4 h 組(97.67%±0.23%)、8 h 組(94.21%±0.65%) 及12 h 組(95.15%±0.59%)僅有輕微降低,24 h 組(72.33%±1.59%)則明顯降低,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖1。
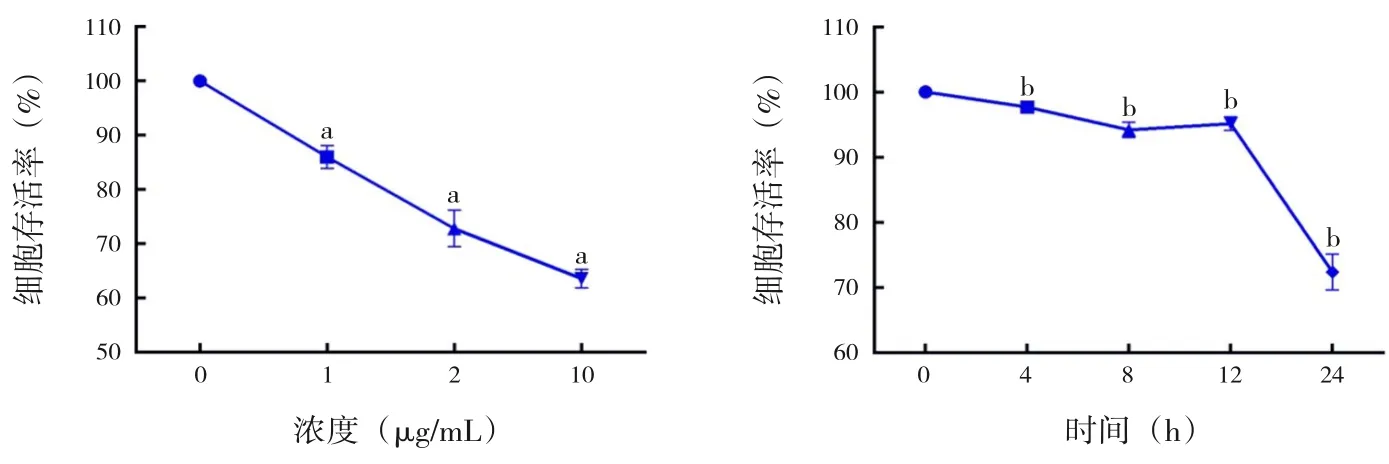
圖1 不同LPS 的刺激濃度和時(shí)間對(duì)A549 細(xì)胞存活率的影響
2.2 LPS對(duì)A549細(xì)胞炎癥水平的影響
在培養(yǎng)的A549 細(xì)胞中以不同濃度(0、1、5、10 μg/mL) 的LPS 刺 激12 h,炎 癥 指 標(biāo)NLRP3、Caspase-1和ASC蛋白表達(dá)水平在1 μg/mL組升高并達(dá)到高峰,與0 μg/mL組比較,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);以1 μg/mL 的LPS 在A549 細(xì)胞中刺激不同的時(shí)間(0、4、8、12、24 h),炎癥指標(biāo)NLRP3、Caspase-1 和ASC 蛋白表達(dá)水平均在12 h組升高并達(dá)到高峰,與0 h組比較,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖2及表1~2。
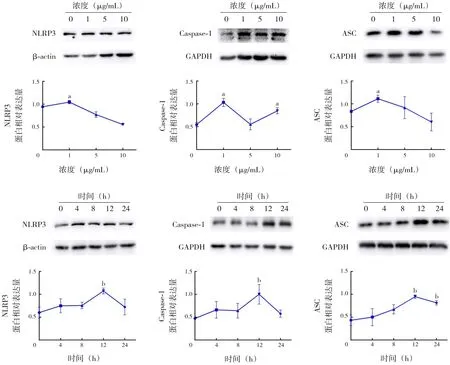
圖2 LPS對(duì)A549細(xì)胞炎癥蛋白表達(dá)的影響
2.3 LPS對(duì)A549細(xì)胞自噬水平的影響
在培養(yǎng)的A549 細(xì)胞中以不同濃度(0、1、5、10 μg/mL)的LPS 刺激12 h,自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ、Beclin-1 和P62 的表達(dá)水平均在1 μg/mL 組升高并達(dá)到高峰,與0 μg/mL組比較,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);以1 μg/mL 的LPS 在A549 細(xì)胞中刺激不同的時(shí)間(0、4、8、12、24 h),自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ、Beclin-1 和P62 的表達(dá)水平均在12 h組升高并達(dá)到高峰,與0 h組比較,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖3及表1~2。
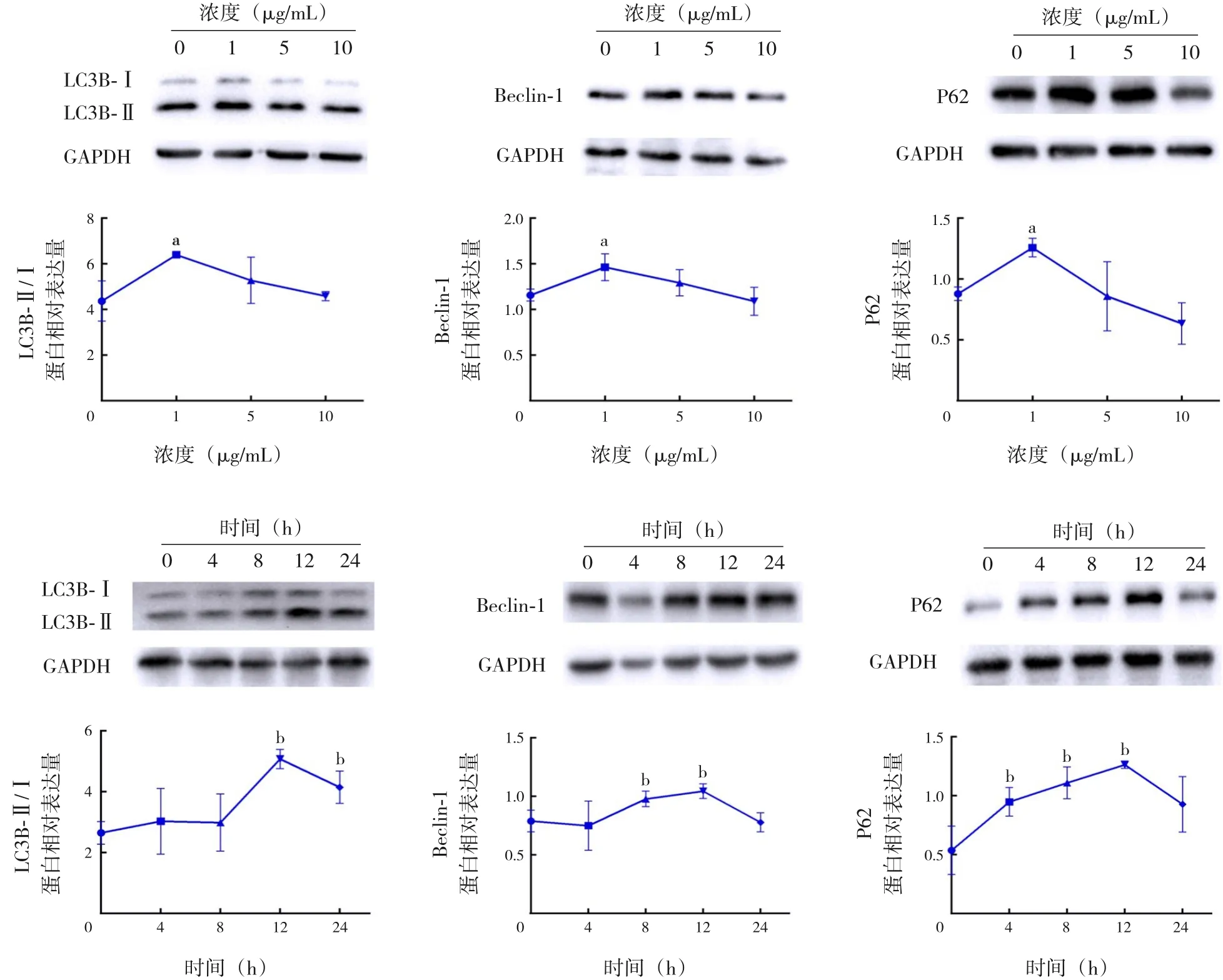
圖3 LPS對(duì)A549細(xì)胞自噬相關(guān)蛋白表達(dá)的影響
表1 不同濃度LPS刺激各組炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
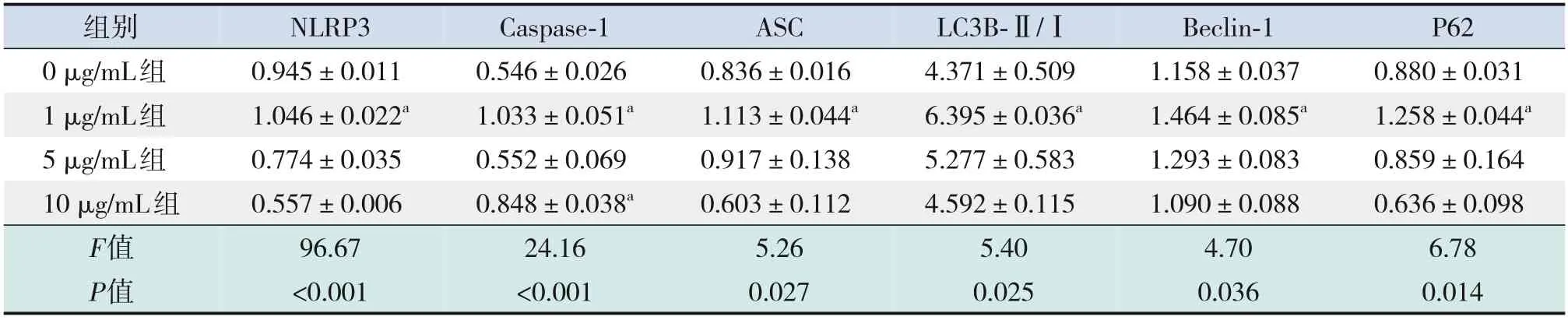
表1 不同濃度LPS刺激各組炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
注:a示與0 μg/mL組比較,P<0.05。
組別NLRP3 Caspase-1 ASC LC3B-Ⅱ/ⅠBeclin-1 P62 0 μg/mL組1 μg/mL組5 μg/mL組10 μg/mL組F值P值0.557±0.006 96.67<0.001 0.848±0.038a 24.16<0.001 0.603±0.112 5.26 0.027 4.592±0.115 5.40 0.025 1.090±0.088 4.70 0.036 0.636±0.098 6.78 0.014 0.945±0.011 1.046±0.022a 0.774±0.035 0.546±0.026 1.033±0.051a 0.552±0.069 0.836±0.016 1.113±0.044a 0.917±0.138 4.371±0.509 6.395±0.036a 5.277±0.583 1.158±0.037 1.464±0.085a 1.293±0.083 0.880±0.031 1.258±0.044a 0.859±0.164
表2 LPS刺激不同時(shí)間各組炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)

表2 LPS刺激不同時(shí)間各組炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
注:a示與0 h組比較,P<0.05。
組別NLRP3 Caspase-1 ASC LC3B-Ⅱ/ⅠBeclin-1 P62 0 h組4 h組8 h組12 h組24 h組F值P值6.07 0.010 5.37 0.014 10.92 0.001 5.95 0.010 3.97 0.035 8.41 0.003 0.60±0.07 0.75±0.09 0.76±0.04 1.07±0.04a 0.72±0.10 0.475±0.005 0.661±0.105 0.643±0.092 1.002±0.123a 0.577±0.046 0.435±0.066 0.502±0.109 0.672±0.058 0.949±0.022a 0.815±0.028a 2.653±0.213 3.033±0.624 2.986±0.543 5.079±0.182a 4.146±0.306a 0.789±0.053 0.750±0.121 0.978±0.038a 1.045±0.036a 0.779±0.047??0.537±0.119 0.949±0.070a 1.110±0.077a 1.263±0.018a 0.928±0.136
2.4 LPS對(duì)A549細(xì)胞TLR4蛋白表達(dá)水平的影響
在培養(yǎng)的細(xì)胞中以不同濃度(0、1、5、10 μg/mL)的LPS 刺激12 h,TLR4 蛋白表達(dá)水平在1 μg/mL 組(0.585±0.054)升高并達(dá)到高峰,與0 μg/mL 組比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);以1 μg/mL 的LPS 在A549 細(xì)胞中刺激不同的時(shí)間(0、4、8、12、24 h),TLR4 蛋白表達(dá)水平在12 h組(1.090±0.031)升高并達(dá)到高峰,與0 h 組比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖4。

圖4 LPS對(duì)A549細(xì)胞TLR4蛋白表達(dá)的影響
2.5 自噬對(duì)炎癥的影響
2.5.1 自噬抑制劑3-MA對(duì)炎癥及自噬相關(guān)蛋白表達(dá)水平的影響 在自噬抑制劑3-MA 的處理下,自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ蛋白表達(dá)水平明顯降低,P62 蛋白表達(dá)水平明顯升高;而炎癥指標(biāo)NLRP3、Caspase-1、ASC蛋白表達(dá)水平明顯升高,與對(duì)照組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05)。經(jīng)LPS(1 μg/mL,12 h)刺激后,3-MA+LPS 組自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)仍呈降低趨勢(shì),P62蛋白表達(dá)進(jìn)一步升高;炎癥指標(biāo)NLRP3、Caspase-1、ASC蛋白表達(dá)水平則進(jìn)一步升高,與LPS組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖5和表3。
表3 自噬抑制劑3-MA干預(yù)后炎癥及自噬蛋白表達(dá)的比較 (±s,n=3)
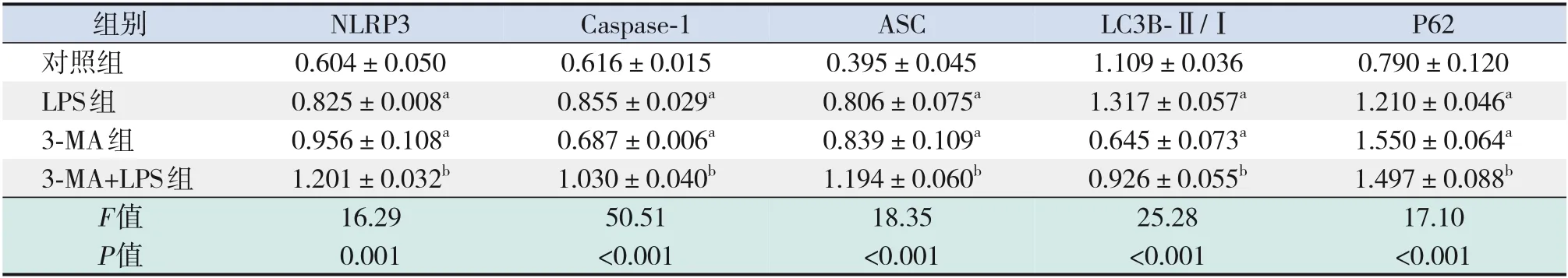
表3 自噬抑制劑3-MA干預(yù)后炎癥及自噬蛋白表達(dá)的比較 (±s,n=3)
注:a示與對(duì)照組比較,P<0.05;b示與LPS組比較,P<0.05。[LPS]脂多糖;[3-MA]3-甲基腺嘌呤。
組別對(duì)照組LPS組3-MA組3-MA+LPS組F值P值NLRP3 0.604±0.050 0.825±0.008a 0.956±0.108a 1.201±0.032b 16.29 0.001 Caspase-1 0.616±0.015 0.855±0.029a 0.687±0.006a 1.030±0.040b 50.51<0.001 ASC 0.395±0.045 0.806±0.075a 0.839±0.109a 1.194±0.060b 18.35<0.001 LC3B-Ⅱ/Ⅰ1.109±0.036 1.317±0.057a 0.645±0.073a 0.926±0.055b 25.28<0.001 P62 0.790±0.120 1.210±0.046a 1.550±0.064a 1.497±0.088b 17.10<0.001
2.5.2 自噬激動(dòng)劑RAPA對(duì)炎癥及自噬相關(guān)蛋白表達(dá)水平的影響 在自噬激動(dòng)劑RAPA 的處理下,自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)水平明顯升高,P62蛋白表達(dá)水平明顯降低;而炎癥指標(biāo)NLRP3、Caspase-1、ASC蛋白表達(dá)水平明顯降低,與對(duì)照組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05)。經(jīng)LPS(1 μg/mL,12 h)刺激后,RAPA+LPS 組自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)進(jìn)一步升高,P62蛋白表達(dá)則仍然是降低的;炎癥指標(biāo)NLRP3、Caspase-1、ASC蛋白表達(dá)水平仍呈降低趨勢(shì),與LPS組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖5和表4。
表4 自噬激動(dòng)劑RAPA干預(yù)后炎癥及自噬蛋白表達(dá)的比較 (±s,n=3)

表4 自噬激動(dòng)劑RAPA干預(yù)后炎癥及自噬蛋白表達(dá)的比較 (±s,n=3)
注:a示與對(duì)照組比較,P<0.05;b示與LPS組比較,P<0.05。[LPS]脂多糖;[RAPA]雷帕霉素。
組別對(duì)照組LPS組RAPA組RAPA+LPS組F值P值NLRP3 0.525±0.057 0.735±0.022a 0.143±0.017a 0.358±0.013b 59.26<0.0001 Caspase-1 0.795±0.031 0.948±0.018a 0.570±0.075a 0.573±0.085b 9.61 0.005 ASC 0.722±0.027 0.944±0.027a 0.247±0.038a 0.349±0.065b 58.79<0.0001 LC3B-Ⅱ/Ⅰ2.111±0.078 4.845±0.446a 11.700±0.507a 8.001±0.621b 80.56<0.0001 P62 0.906±0.026 1.066±0.029a 0.432±0.109a 0.452±0.142b 12.29 0.0023
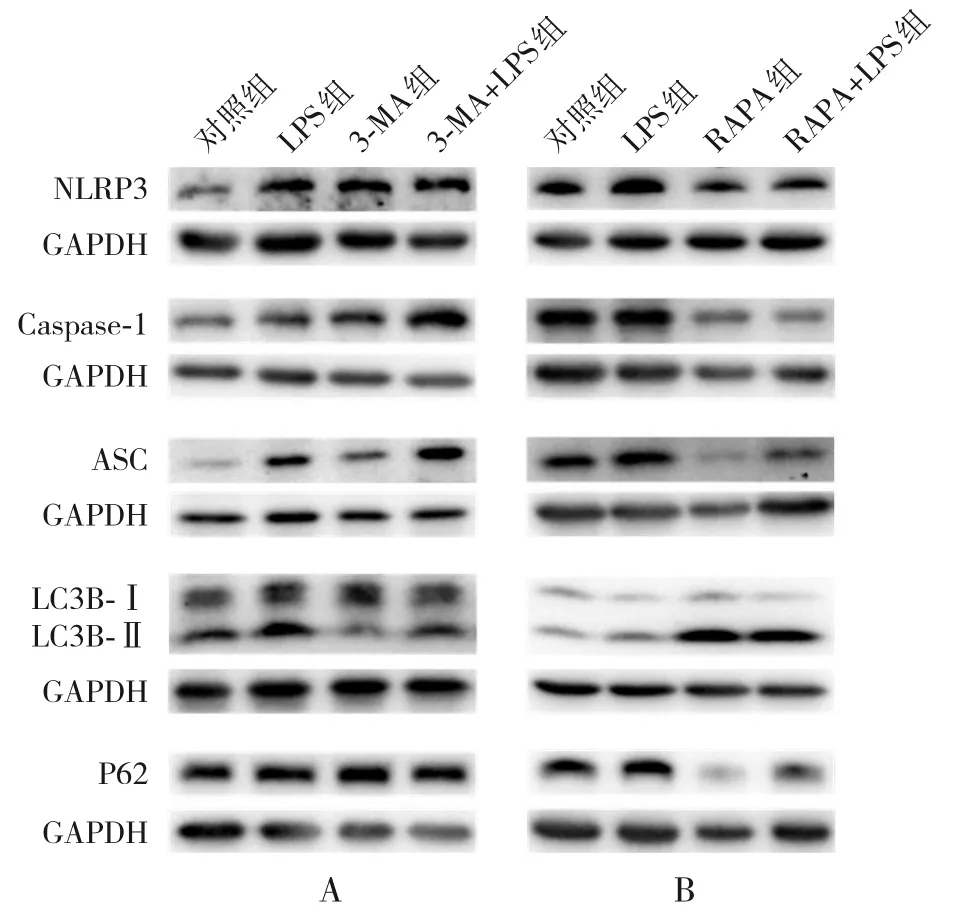
圖5 自噬抑制劑/激動(dòng)劑對(duì)炎癥及自噬蛋白表達(dá)的影響
2.5.3 自噬抑制/激動(dòng)劑對(duì)TLR4 蛋白表達(dá)水平的影響 在自噬抑制劑3-MA 的處理下,3-MA 組(0.531±0.036)較對(duì)照組(0.325±0.042)TLR4蛋白表達(dá)上調(diào);經(jīng)LPS(1 μg/mL,12 h)刺激后,3-MA+LPS 組(0.620±0.018)較LPS 組(0.475±0.032)TLR4蛋白表達(dá)水平進(jìn)一步增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);在自噬激動(dòng)劑RAPA 的處理下,RAPA 組(0.392±0.088)較對(duì)照組(0.825±0.039) TLR4 蛋白表達(dá)下調(diào);經(jīng)LPS (1 μg/mL,12 h)刺激后,RAPA+LPS 組(0.445±0.129)較LPS 組(1.003±0.046)TLR4 蛋白表達(dá)水平降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖6。
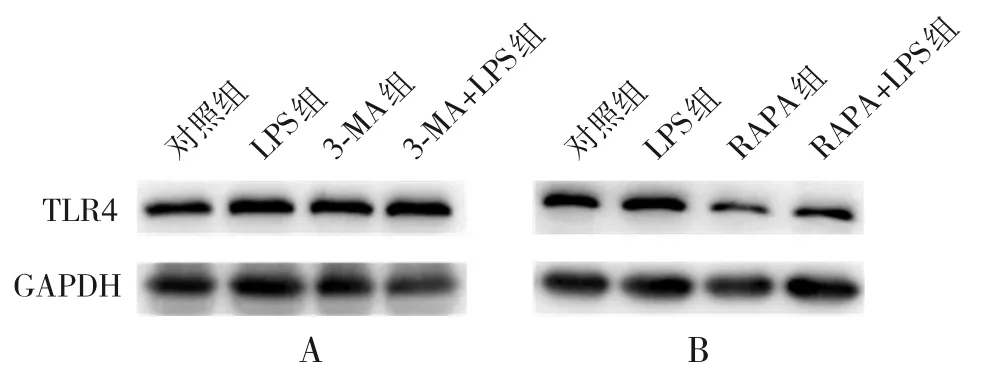
圖6 自噬抑制/激動(dòng)劑對(duì)TLR4 蛋白表達(dá)的影響
2.6 TLR4對(duì)A549細(xì)胞炎癥及自噬水平的影響
2.6.1 過表達(dá)TLR4 對(duì)A549 細(xì)胞炎癥及自噬水平的影響 過表達(dá)TLR4 后,自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)明顯降低,P62蛋白表達(dá)明顯升高;炎癥指標(biāo)Caspase-1、ASC 的蛋白表達(dá)水平呈升高趨勢(shì),與TLR4過表達(dá)對(duì)照組比較,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05)。 經(jīng)LPS (1 μg/mL, 12 h) 刺 激 后,TLR4過表達(dá)+LPS組自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)仍是降低的,P62蛋白表達(dá)則進(jìn)一步升高;炎癥指標(biāo)Caspase-1、ASC 蛋白表達(dá)水平進(jìn)一步升高,與TLR4過表達(dá)對(duì)照+LPS組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖7和表5。
表5 TLR4過表達(dá)后炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
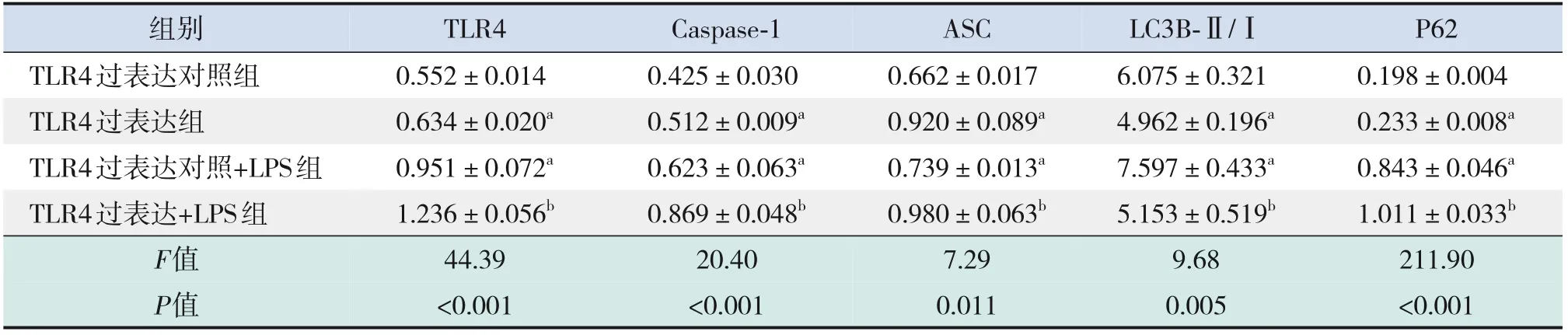
表5 TLR4過表達(dá)后炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
注:a示與TLR4過表達(dá)對(duì)照組比較,P<0.05;b示與TLR4過表達(dá)對(duì)照+LPS組比較,P<0.05。[LPS]脂多糖;[TLR4]Toll樣受體4。
組別TLR4過表達(dá)對(duì)照組TLR4過表達(dá)組TLR4過表達(dá)對(duì)照+LPS組TLR4過表達(dá)+LPS組F值P值TLR4 0.552±0.014 0.634±0.020a 0.951±0.072a 1.236±0.056b 44.39<0.001 ASC 0.662±0.017 0.920±0.089a 0.739±0.013a 0.980±0.063b 7.29 0.011 Caspase-1 0.425±0.030 0.512±0.009a 0.623±0.063a 0.869±0.048b 20.40<0.001 LC3B-Ⅱ/Ⅰ6.075±0.321 4.962±0.196a 7.597±0.433a 5.153±0.519b 9.68 0.005 P62 0.198±0.004 0.233±0.008a 0.843±0.046a 1.011±0.033b 211.90<0.001
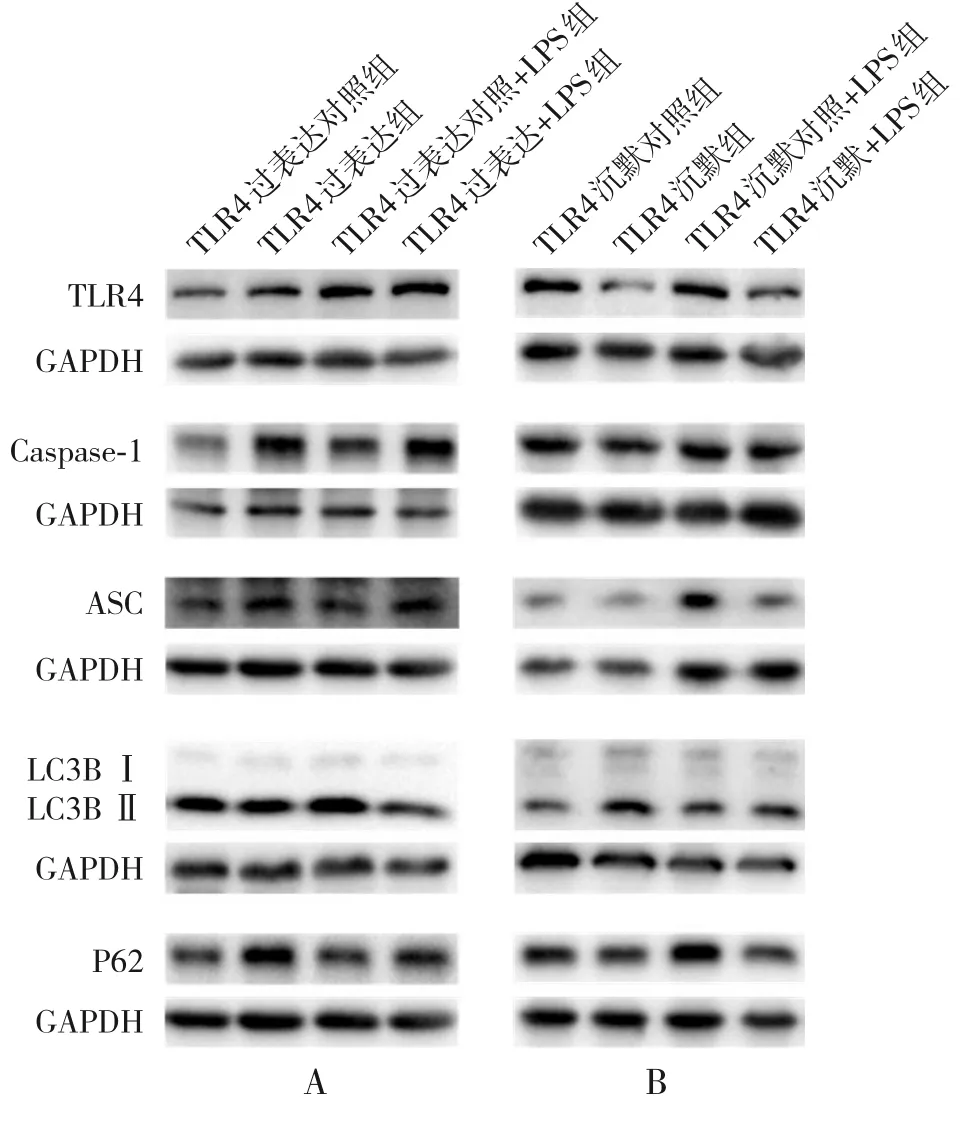
圖7 TLR4 過表達(dá)/沉默對(duì)A549 細(xì)胞中炎癥及自噬蛋白表達(dá)的影響
2.6.2 沉默TLR4 對(duì)A549 細(xì)胞炎癥反應(yīng)及自噬水平的影響 沉默TLR4 后,自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ表達(dá)升高,P62 蛋白表達(dá)下降;而炎癥指標(biāo)Caspase-1、ASC 蛋白表達(dá)水平明顯降低,與TLR4沉默對(duì)照組比較,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。經(jīng)LPS(1 μg/mL,12 h)刺激后,TLR4 沉默+LPS組自噬相關(guān)蛋白LC3B-Ⅱ/Ⅰ的表達(dá)進(jìn)一步升高,P62蛋白表達(dá)水平降低;炎癥指標(biāo)Caspase-1、ASC的蛋白表達(dá)水平進(jìn)一步降低,與TLR4 沉默對(duì)照+LPS 組比較,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖7和表6。
表6 TLR4沉默后炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)

表6 TLR4沉默后炎癥及自噬相關(guān)蛋白表達(dá)的比較 (±s,n=3)
注:a示與TLR4沉默對(duì)照組比較,P<0.05;b示與TLR4沉默對(duì)照+LPS組比較,P<0.05。[LPS]脂多糖;[TLR4]Toll樣受體4。
組別TLR4沉默對(duì)照組TLR4沉默組TLR4沉默對(duì)照+LPS組TLR4沉默+LPS組F值P值TLR4 0.831±0.038 0.563±0.087a 0.990±0.040a 0.756±0.062b 8.63 0.007 Caspase-1 1.024±0.026 0.900±0.023a 1.107±0.009a 0.982±0.042b 9.93 0.005 ASC 0.612±0.037 0.369±0.058a 0.794±0.037a 0.560±0.026b 18.07<0.001 LC3B-Ⅱ/Ⅰ4.185±0.155 8.890±1.185a 11.660±0.723a 30.010±5.661b 15.05 0.001 P62 0.842±0.009 0.699±0.020a 0.997±0.040a 0.765±0.031b 21.75<0.001
3 討論
ALI/ARDS 的病理生理特點(diǎn)是破壞肺泡毛細(xì)血管膜屏障,導(dǎo)致過度炎癥反應(yīng)和肺功能障礙[6]。因此,抑制炎癥對(duì)ALI/ARDS 至關(guān)重要。LPS 是革蘭陰性菌細(xì)胞壁的主要成分,可刺激機(jī)體產(chǎn)生一系列炎癥反應(yīng)。特別是當(dāng)LPS影響肺部時(shí),會(huì)誘發(fā)ALI,嚴(yán)重時(shí)可發(fā)展為ARDS。因此,LPS被廣泛用于ALI/ARDS臨床相關(guān)動(dòng)物或細(xì)胞模型的建立[7-8]。Ⅱ型肺泡上皮細(xì)胞的炎癥損傷是ALI/ARDS發(fā)病過程中的主要病理生理變化,LPS暴露可導(dǎo)致這一變化[9]。而人肺泡上皮細(xì)胞株A549 與Ⅱ型肺泡上皮細(xì)胞特征最為相似,是體外構(gòu)建ALI/ARDS炎癥模型使用最為廣泛的細(xì)胞系[10-11]。因此,本實(shí)驗(yàn)采用A549 細(xì)胞培養(yǎng)模擬LPS 誘導(dǎo)的炎癥反應(yīng)及肺損傷,是常用的替代原代細(xì)胞培養(yǎng)的方法。
在 本 研 究 中,A549 細(xì) 胞 經(jīng)LPS (1 μg/mL,12 h)刺激后,炎癥指標(biāo)NLRP3、Caspase-1和ASC蛋白表達(dá)水平均升高并達(dá)到高峰。這些結(jié)果表明由LPS 誘導(dǎo)的A549 細(xì)胞炎癥反應(yīng)模型成功建立。同樣條件下,自噬指標(biāo)LC3B-Ⅱ/Ⅰ、Beclin-1 和P62蛋白表達(dá)水平也升高達(dá)到高峰,這表明LPS雖然誘導(dǎo)自噬產(chǎn)生,但自噬流受到阻滯。自噬過程涉及幾個(gè)步驟:啟動(dòng)和成核、擴(kuò)增、自噬體形成、自噬體-溶酶體融合和降解。成核階段磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)復(fù)合物的核心成分Beclin-1被激活以調(diào)節(jié)自噬體的大小和數(shù)量[12]。成核后,LC3-Ⅰ與磷脂酰乙醇胺結(jié)合,形成僅在成熟的自噬體上表達(dá)的LC3-Ⅱ形式。LC3-Ⅰ向LC3-Ⅱ轉(zhuǎn)化的增加是自噬體形成的指標(biāo)[13]。自噬體與溶酶體的融合是自噬貨物降解的關(guān)鍵事件[14]。P62/SQSTM1作為一種機(jī)制來傳遞泛素化的蛋白質(zhì),通過與LC3相互作用靶向物質(zhì)于自溶酶體處降解[15]。當(dāng)自噬被抑制時(shí)P62 會(huì)積累,而當(dāng)自噬被誘導(dǎo)時(shí)可以觀察到P62 水平降低。因此,P62常用作研究動(dòng)態(tài)自噬流的標(biāo)志物。自噬流始于自噬體的形成,并以溶酶體的底物降解結(jié)束,LC3B 代表自噬流啟動(dòng),而P62 代表自噬流終止,完整通暢的自噬流才能使自噬真正發(fā)揮作用,達(dá)到降解物質(zhì)的目的。本研究CCK-8 實(shí)驗(yàn)結(jié)果顯示,LPS濃度過高或者刺激時(shí)間過長都會(huì)對(duì)細(xì)胞造成較大的損害,影響各實(shí)驗(yàn)指標(biāo)的表達(dá)。因此,結(jié)合上述實(shí)驗(yàn)結(jié)果,我們認(rèn)為1 μg/mL 濃度的LPS 刺激12小時(shí)是誘導(dǎo)A549細(xì)胞炎癥反應(yīng)模型,探究自噬作用的最適條件。
為進(jìn)一步探究自噬和炎癥反應(yīng)之間的關(guān)系,我們選擇在細(xì)胞模型上調(diào)節(jié)自噬來觀察炎癥反應(yīng)的變化。3-MA 是一種PI3K 抑制劑,通過阻止PI3KC3與beclin-1結(jié)合形成自噬體來抑制自噬,是常用的自噬抑制劑。RAPA通過抑制哺乳動(dòng)物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)復(fù)合物的活性來激活自噬,是常用的自噬激動(dòng)劑。在3-MA(5 mmol/L,12 h)的處理下,LC3B-Ⅱ/Ⅰ表達(dá)減少,P62表達(dá)增加,自噬受到抑制且自噬流受阻,而炎癥指標(biāo)NLRP3、Caspase-1和ASC蛋白表達(dá)水平升高;在此基礎(chǔ)上,LPS的刺激使P62蛋白表達(dá)水平進(jìn)一步升高,自噬流進(jìn)一步受到阻滯,同時(shí),NLRP3、Caspase-1 和ASC 蛋白表達(dá)水平也進(jìn)一步升高。而當(dāng)RAPA 激活自噬后,自噬流恢復(fù)通暢,炎癥反應(yīng)減輕。這些結(jié)果說明自噬流對(duì)炎癥反應(yīng)起到負(fù)調(diào)控的作用。這與許多研究結(jié)果一致,表明維持正常的自噬流具有潛在的抗炎作用,比如谷胱甘肽S-轉(zhuǎn)移酶P1 通過抑制PI3K-Akt-mTOR通路促進(jìn)自噬流通暢對(duì)LPS誘導(dǎo)的炎癥反應(yīng)發(fā)揮保護(hù)作用[16];雌激素相關(guān)受體α 通過增加自噬流和控制宿主腸道微生物群來改善結(jié)腸炎癥反應(yīng),從而充當(dāng)腸道穩(wěn)態(tài)的關(guān)鍵調(diào)節(jié)劑[17];LPS可誘導(dǎo)自噬流阻塞而促發(fā)炎癥反應(yīng),褪黑激素通過促進(jìn)自噬流而具有有效的抗炎作用[18]。這也說明,維持一定水平的自噬是必要的,自噬在炎癥反應(yīng)中可起到一定的細(xì)胞保護(hù)作用。
TLR4被稱為自噬的環(huán)境傳感器[19]。在本研究中,LPS的刺激和3-MA的自噬阻斷均可引起TLR4蛋白表達(dá)上調(diào),而RAPA 的自噬激活則引起TLR4蛋白表達(dá)下調(diào)。為了確定TLR4對(duì)自噬及炎癥反應(yīng)的影響,我們使用TLR4 過表達(dá)/空載質(zhì)粒和針對(duì)TLR4的siRNA/陰性對(duì)照siRNA轉(zhuǎn)染A549細(xì)胞,用LPS 處理細(xì)胞并評(píng)估自噬流。研究結(jié)果顯示,TLR4過表達(dá)組,LC3B-Ⅱ/Ⅰ表達(dá)減少,P62表達(dá)升高,自噬水平降低,自噬流阻滯;TLR4 沉默組,LC3B-Ⅱ/Ⅰ表達(dá)升高,P62表達(dá)減少,自噬水平升高,自噬流通暢,表明TLR4對(duì)自噬流具有負(fù)調(diào)控作用。在LPS 的刺激下,TLR4 過表達(dá)+LPS 組LC3B-Ⅱ/Ⅰ表達(dá)仍是降低的,P62表達(dá)則進(jìn)一步升高,自噬流進(jìn)一步受到阻滯;而沉默TLR4+LPS組自噬水平進(jìn)一步升高,自噬流通暢,說明LPS 經(jīng)TLR4 對(duì)自噬流具有負(fù)調(diào)控作用。同時(shí)我們發(fā)現(xiàn),當(dāng)自噬流阻滯時(shí),炎癥反應(yīng)進(jìn)一步升高;當(dāng)自噬流通暢時(shí),炎癥反應(yīng)減輕。自噬被認(rèn)為是炎癥反應(yīng)的主要負(fù)調(diào)節(jié)因子[20]。本研究證明TLR4介導(dǎo)自噬流在LPS 誘導(dǎo)的A549 細(xì)胞炎癥反應(yīng)中發(fā)揮負(fù)調(diào)控作用。自噬對(duì)細(xì)胞的保護(hù)作用是建立在自噬流通暢的基礎(chǔ)上,自噬流的通暢性抑制了LPS引起的炎癥級(jí)聯(lián)反應(yīng),這可能為ARDS有效的抗炎治療提供一種新方法。
本實(shí)驗(yàn)仍有不足之處。在細(xì)胞系選擇方面,沒有使用原代肺泡上皮細(xì)胞,研究的借鑒意義相對(duì)受限,另外尚未進(jìn)行在體動(dòng)物實(shí)驗(yàn)驗(yàn)證,有待下一步深入研究。自噬流的檢測(cè)方法除了免疫印跡法,還有自噬mRFP-GFP-LC3雙標(biāo)示蹤法等,均有待后續(xù)補(bǔ)充。本研究中,我們對(duì)自噬的研究著眼于自噬流這一關(guān)鍵點(diǎn),初步闡述自噬對(duì)ARDS中炎癥反應(yīng)的調(diào)控機(jī)制,這可能僅僅是自噬復(fù)雜調(diào)控網(wǎng)絡(luò)中的一小部分,關(guān)于肺上皮細(xì)胞自噬的上游信號(hào)或調(diào)節(jié)因子我們依然知之甚少。自噬在肺損傷中扮演著“雙刃劍”的角色,值得我們進(jìn)行更多地探索。新生兒作為一個(gè)特殊的階段,新生兒疾病的防治一直在不斷更新與完善。通過自噬來了解和重新認(rèn)識(shí)新生兒ARDS是一個(gè)新角度,可能為新生兒ARDS防治找到新的突破口,為降低新生兒疾病的發(fā)生率、病死率等作出貢獻(xiàn)。
利益沖突聲明:所有作者均聲明不存在利益沖突。

