QuEChERS-LC-MS/MS法測定干制紅棗中多菌靈的殘留量
曾敏 楊晉青 俞曉琴 陳慧*
(1.浙江五芳齋實業股份有限公司; 2.上海市質量監督檢驗技術研究院)
0 引言
紅棗作為一種具有中國特色的水果,有著很好的營養與藥用價值,一直被開發和研究。隨著近年來紅棗栽培面積的擴大,其生長過程中病蟲害的發生率也不斷增加,而且由于其果皮質地脆嫩,采收后需經貯藏、干燥、晾曬、加工等干制過程,極易感染細菌而引起腐爛變質。為了保證紅棗產量,棗農會適時噴灑農藥。
多菌靈為一類廣譜劑農藥,對人、畜均低毒。對許多作物的病害都有一定防治效果,可進行葉面噴灑、播種與土壤處理等,因此也常作為防治紅棗病害的農藥。GB 2763—2021《食品安全國家標準 食品中農藥最大殘留限量》規定:多菌靈在棗(鮮)中的最高殘留限量為0.5 mg/kg、檢測方法標準為GB/T 20769—2008《水果和蔬菜中450種農藥及相關化學品殘留量的測定 液相色譜-串聯質譜法》和NY/T 1453—2007《蔬菜及水果中多菌靈等16種農藥殘留測定 液相色譜-質譜-質譜聯用法》。但是對于干制紅棗卻缺乏具體的質量限量規定和具體的測定辦法,僅認為干制水果可以依據GB/T 20769和NY/T 1453所規定的辦法檢測。隨著干制紅棗在紅棗產業中的比重越來越大,農藥殘留問題也應該引起重視。為了保障紅棗質量,最大限度地減少農藥殘留對人類生活的影響,亟需開發高效、準確的檢測方法。
目前的檢驗技術手段有氣質聯用法(GC-MS)、氣相色譜法(GC)、液相色譜法(HPLC)、液質聯用法(HPLC-MS)和紅外光譜法等,前處理技術大多采用固相萃取技術,但前期處理費時而且操作較復雜、所產生主要問題重現性差和回收率較低。此外,由于干制紅棗中糖分含量較高,有機溶劑的提取效率和準確度均較低。“QuEChERS”算法由于具備快捷、簡便、經濟、有效、平穩、安全可靠等優勢,越來越多地運用于農產品的農藥殘留檢測。為有效監測干制紅棗中多菌靈的存在狀況,本方法利用了“QuEChERS”的前處理工藝,并結合液相色譜-串聯質譜法的監測手段,通過比較不同“QuEChERS”凈化包的凈化效率,建立了干制紅棗中多菌靈的殘留檢測方法,為多菌靈在干制紅棗上的殘留檢測提供技術支持。
1 材料與方法
1.1 材料與試劑
氯化鈉(分析純);超純水;乙腈(色譜純);QuEChERS萃取鹽包(含無水硫酸鎂6 g 和乙酸鈉1.5 g);QuEChERS專用凈化管A(15 mL離心管中裝MgSO1200 mg、乙二胺-N-丙基硅烷400 mg)、QuEChERS專用凈化管B(15 mL離心管中裝MgSO1200 mg、PSA 400 mg、十八烷基鍵合相硅膠 400 mg)、QuEChERS專用凈化管C(15 mL離心管中裝MgSO1200 mg、PSA 400 mg、C18 400 mg,石墨化碳黑45 mg);Carbon/NH專用固相萃取柱(500 mg,6 mL)。標準品:多菌靈(純度不低于98.0%,100 μg/mL)。
1.2 儀器與設備
液相色譜儀;串聯質譜儀;其他設備包括渦旋多空共混器;超聲清洗儀;氮吹濃縮儀;離心機;0.22μm有機相濾膜。
1.3 實驗方法
色譜柱:3 μm,2.1 mm×100 mm,柱溫為:35 ℃;建議進樣量:2 μL;流動相:乙腈和0.1%甲酸水溶液,梯度洗脫的條件見表1。
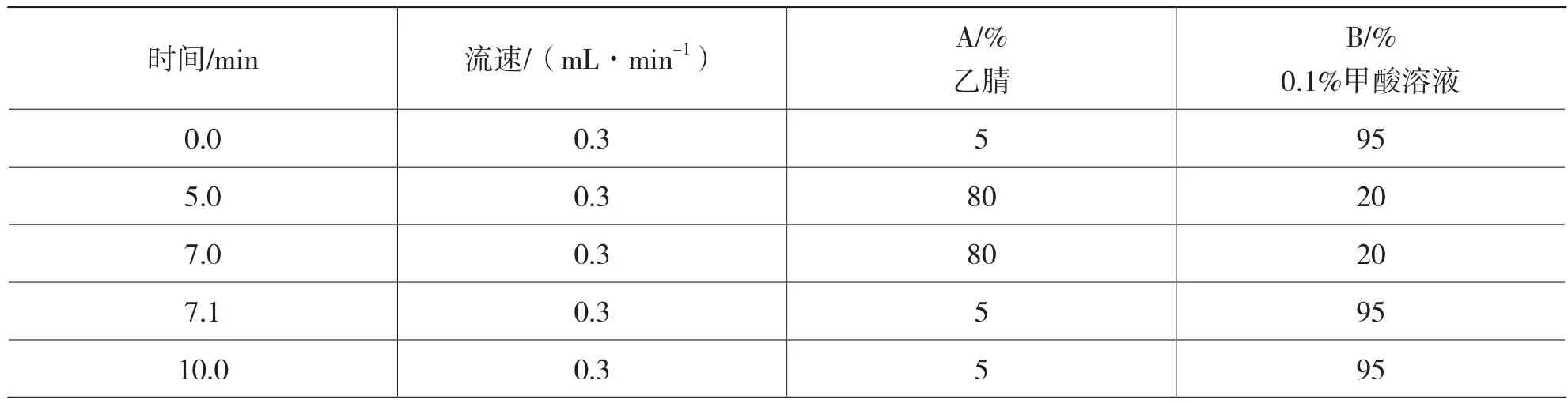
表1 梯度洗脫表

表2 多菌靈的質譜分析參數
準確稱取共計約5 g粉碎、混勻的干制紅棗樣品,精確至0.01 g,將其置于塑料離心管(50 mL)中,先加入超純水約10 mL,渦旋混勻,靜置10 min,再準確量取加入乙腈 20 mL,馬上渦旋、振蕩混勻,超聲處理15 min,在其中加入無水硫酸鎂6 g和 乙酸鈉1.5 g,立即渦旋、振蕩混勻,9 000 r/min離心1 min。準確移取10 mL上層乙腈相于裝有1200 mg硫酸鎂、400 mg PSA、400 mg C18粉末的離心管中,立即渦旋振蕩2 min,再置于9000 r/min離心1 min后靜置,取上層清液用0.22 μm濾膜過濾于進樣瓶中,上機測定。
多菌靈標準工作溶液的配制方法為:量取適量濃度為100 μg/mL多菌靈標準品,使用乙腈配制1.0 μg/mL的標準工作溶液。
多菌靈標準曲線工作溶液的配制方法為:精確移取適量的多菌靈標準工作使用液,用乙腈稀釋后成標準濃度為2.5 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100 ng/mL的標準曲線工作溶液。
紅棗基質工作曲線溶液的配制方法:將空白試樣按樣品處理方式進行處理,以獲得工作凈化液。精確量取適量的多菌靈標準工作溶液,用該工作凈化液稀釋成濃度為2.5 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100 ng/mL的紅棗基質工作曲線溶液。
2 結果與分析
2.1 儀器采集條件的確定
本實驗通過ESI源以及MRM模式對多菌靈進行研究。將1 μg/mL的標準工作溶液以流動注入的形式注入離子源,然后采用ESI正離子或負離子的模式開展全掃描,掃描后得知多菌靈在ESI正離子模式下響應值更高,于是選擇采用正離子數字化掃描,以確認母離子質荷比為 192。同時,通過優化檢測條件(如噴霧電壓、霧化壓力、干燥氣壓)及去簇電壓,確保母離子的豐度和穩定性最優化,獲得最優的去簇電壓;在Product模式下,選擇對母離子響應最高的子離子2 個分別為定量子離子和定性子離子。接著在MRM采集模式下,分別對子離子的相互碰撞能量加以優化,得到各自最優的碰撞能量,建立MRM采集方法。圖1為多菌靈MRM定量離子色譜圖。

圖1 多菌靈標準溶液的MRM定量離子色譜圖
采用2.1 mm×100 mm, 3 μm色譜柱,分別對比了水和乙腈,含甲酸水溶液(0.1%)/乙腈和含甲酸水溶液(0.1%)+5 mmol/L乙酸銨溶液/乙腈為流動相時的色譜的分離情況特點。含甲酸(0.1%)的流動相離子化分離時效果好,且靈敏度較高。在流動相中添加入乙酸銨溶液則可以優化色譜峰形,但靈敏度也會下降;另外,因為進樣體積比較小,在流動相中如不加入乙酸銨溶液,多菌靈的色譜峰形和保留時間都較為理想。因此,選取了乙腈和含甲酸水溶液(0.1%)的流動相,在1.3.1色譜條件下,進行了梯度洗脫實驗。在柱溫(35 ℃)和流速(0.3 mL/min)條件下,進樣量為2 μL時,可獲得干制紅棗樣品基質中多菌靈檢測結果的穩定和優異的分離效果。
2.2 樣品前處理條件的確定
本實驗比較了干制紅棗加水浸潤與否對提取效率的影響。稱取樣品后,根據樣品自身含水量的多少,在加入提取溶劑之前首先加入10 mL純水以充分浸潤樣品。浸潤10 min,渦旋1 min后,再加入提取溶劑進行提取實驗,結果見圖2。實驗結果表明,充分浸潤樣品后,目標物的提取效率明顯增加。由于樣品含糖量較高,若不經過加水充分浸潤,直接加入提取溶劑容易造成樣品結團,導致目標物難以被充分提取出來,導致提取效率很低。
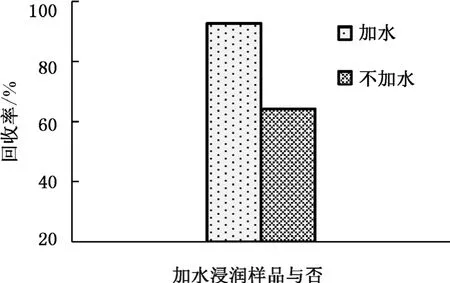
圖2 加水浸潤樣品對提取效率的影響
本實驗以乙腈和1%乙酸乙腈溶液作為萃取試劑后開展對比試驗,對待測樣品中多菌靈的加標萃取效果,結果見圖3。圖3表明,乙腈和乙酸乙腈(1%)溶液作為萃取試劑后的平均回收率分別為95.1%、74.4%,因此,乙腈的萃取效率相對較好。因多菌靈其本身為一種兩性物質,其水解度受pH值波動的影響很大。在酸性環境下,多菌靈易溶于水,多菌靈在中性和偏堿性水溶液中其水溶性變化較小,多菌靈更容易被化學有機溶劑萃取。故確定乙腈作為萃取試劑。
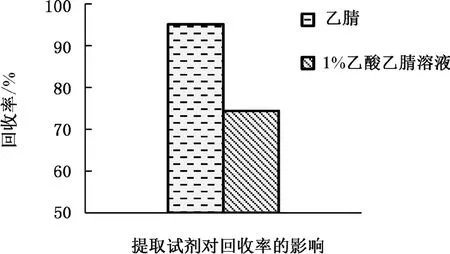
圖3 不同萃取試劑的回收率
本實驗比較了超聲輔助提取時間對多菌靈回收率的影響。選擇的基質為干制紅棗等空白樣品,多菌靈的加標濃度為10 μg/kg。考察在5 min、10 min、15 min、20 min等各種超聲的時間下,多菌靈的回收率,結果見圖4。圖4表明,超聲提取10 min時多菌靈回收率達最高,隨著超聲持續時間的繼續增加,多菌靈回收率呈現明顯下降趨勢,究其原因可能由于雜質成分被萃取出來使得多菌靈核心目標物的離子化效率減低,導致總回收率有所降低。基于以上情況,本試驗采用超聲輔助處理10 min。
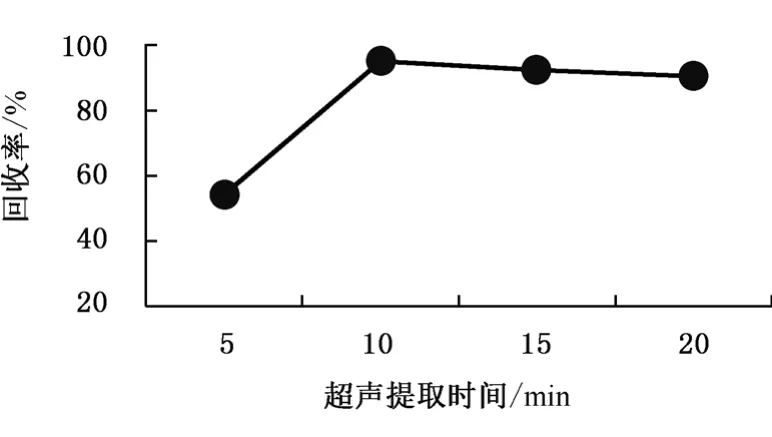
圖4 不同超聲提取時間的回收率
本實驗對比了QuEChERS不同類型的凈化包對多菌靈回收率的效果。取含有濃度為10 ng/mL多菌靈的干制紅棗工作曲線溶液,對含有不同類型凈化劑的3個QuEChERS凈化包和1個固相萃取柱(具體成分見1.1)進行處理效果凈化比較,處理后的平均回收率結果見表3。實驗結果顯示,在各種凈化方式中,多菌靈的回收率分別為88.6%、96.7%、67.3%和62.4%。凈化包B的最終回收率最高;但凈化包A、凈化包C和萃取柱D的最終回收率相對較低。主要是因為凈化包A中不含有C18吸附劑,因此去雜效果并不理想,對基質干擾過多而產生的回收率也較低;而凈化包C中含有石墨化炭黑,因此可以對具有平面結構的農藥產生很大的吸收效果,在去除雜質的同時對多菌靈也產生了不同程度的吸附,使得回收率較低;而萃取柱D的操作則較為繁瑣,去除紅棗中所含的極性有機酸、大量糖類等元素的作用并不明顯,同時也會受洗脫次數的影響使得回收率也較低;最后,通過移取10 mL提取液到含有1200 mg MgSO、400 mg PSA、400 mg C18粉末的凈化包B來凈化并除去提取液中的雜質組分,進而達到了對干棗樣品的凈化除雜并降低基質干擾的效果。
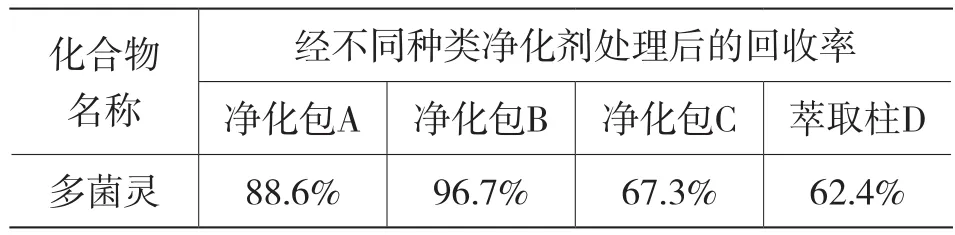
表3 經不同種類凈化方式處理后的回收率
2.3 線性范圍和基質效應
本實驗采用標準工作溶液在1.3規定的試驗條件下開展測定,以多菌靈標準溶液質量濃度為橫坐標,峰面積為縱坐標,繪制多菌靈的工作標準曲線,按公式 (1) 計算基質效應(ME),多菌靈溶液的標準曲線工作溶液和紅棗基質工作曲線溶液(1.3.4)的線性方程見表4。在2.5 ng/mL~100 ng/mL的范圍內線性關系良好,相關系數大于0.995。同時具有良好的基質抑制效應。
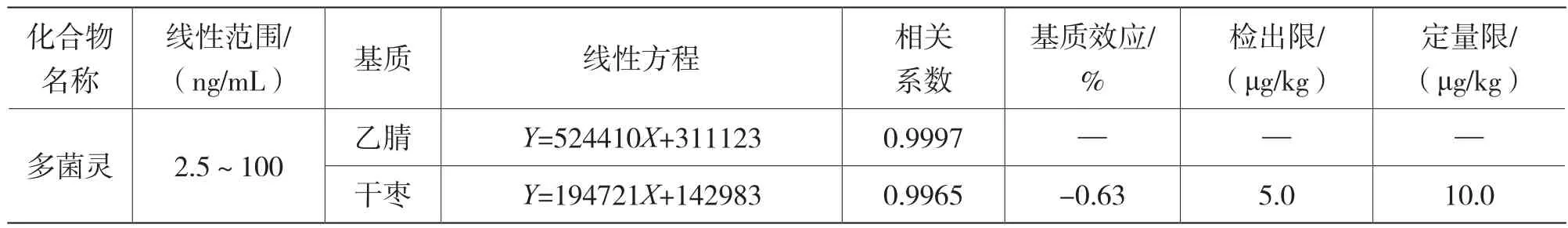
表4 多菌靈的線性范圍、線性方程、相關系數、基質效應、檢出限及定量限
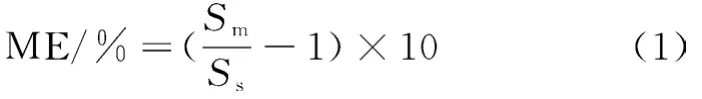
式中,和分別表示基質工作曲線溶液和標準曲線工作溶液的斜率。當ME>0時,說明為基質增強效應;ME<0,說明為基質抑制效應。
2.4 方法的檢出限和定量限
在空白樣品基質內添加相應含量的標準工作溶液,在2.3的試驗條件下進行測試,按信噪比等于3計算該方法檢出限,按信噪比等于10計算該方法定量限,結果見表4。多菌靈在干制紅棗基質中的檢出限為5.0 μg/kg,定量限為10.0 μg/kg。
2.5 方法的回收率和精密度
在不含多菌靈的陰性干制紅棗樣本中添加3個標準水平(10.0 μg/kg、20.0 μg/kg 和 100 μg/kg)的標準工作溶液,靜置30 min,按以上樣品處理方式進行檢測,每個加入水平重復測定6 次,計算多菌靈標準工作溶液加入后其回收率及相對標準偏差(RSD)(=6),測定結果見表5。表5表明,多菌靈在干制紅棗中平均回收率為86.9%~109.1%,RSD為3.01%~7.27%,以上說明該檢測技術的回收率良好、重復性較好。
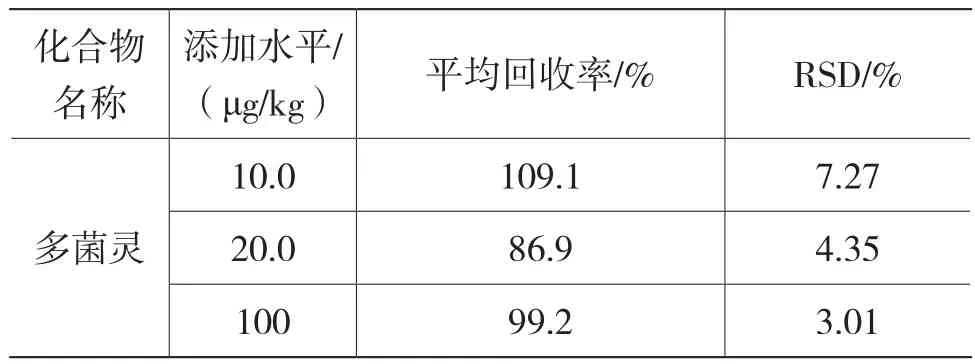
表5 多菌靈在3個添加水平下的平均回收率及其RSD值(n=6)
2.6 實際樣品檢測結果
采用本試驗所建立的方法對10批次干制紅棗樣品進行多菌靈的檢測,其中有2個樣品檢出多菌靈殘留,含量分別為 28.4 μg/kg 和 41.1 μg/kg。
3 結語
本研究利用QuEChERS-LC-MS/MS檢測技術,在優化樣品前處理和儀器采集條件的基礎上,建立了一種高效準確、靈敏度高和重現性好的測定干制紅棗中多菌靈殘留量的檢測方法。用乙腈超聲輔助提取干棗樣本中的多菌靈,經QuEChERS包凈化,凈化液采用0.22 μm濾膜過濾,使用液相色譜-串聯質譜儀(LC-MS/MS)檢測。選用Waters Atlantis T3 C18(3 μm,2.1 mm×100 mm) 色譜柱進行分離處理,電噴霧離子化、正離子掃描及動態多反應監測模式檢驗,最終通過基質工作曲線外標法進行定量。多菌靈在2.5 ng/mL~100 ng/mL范圍內線性關系良好,相關系數為0.9965。3個多菌靈添加水平的平均回收率為86.9%~109.1%,RSD為3.01%~7.27%,定量限為10.0 μg/kg。該方法能夠很好解決實際干制紅棗產品對多菌靈殘留量的檢測需求。

