妊娠期糖尿病孕婦及2型糖尿病患者腸道菌群的特點分析
青 瑤, 周環宇, 周超夢, 宋 哲, 韋金華, 高劍波, 4
(1. 蚌埠醫學院 研究生院, 安徽 蚌埠, 233000; 2. 大連醫科大學 研究生院, 遼寧 大連, 116000;3. 南京醫科大學附屬常州第二人民醫院 產科, 江蘇 常州, 213000;4. 南京醫科大學附屬常州第二人民醫院 內分泌代謝科, 江蘇 常州, 213000)
2型糖尿病(T2DM)是一種以胰島素抵抗和慢性低度炎癥為特征的代謝性疾病,可引起眼、腎臟、心臟、血管等重要組織器官慢性損害,病情嚴重時可危及生命。T2DM好發于40歲以上人群,但隨著現代化生活方式的轉變,其發病年齡日趨年輕化[1]。部分年輕T2DM女性患者由妊娠期糖尿病(GDM)孕婦產后進展而來, 20%~50%的GDM孕婦在產后5年內可進展為T2DM[2]。
GDM是懷孕期間首次出現的不同程度的糖代謝異常,是孕期最常見的并發癥之一[3]。GDM會對母親及后代的健康產生短期和長期的不利影響,例如剖宮產、巨大兒、新生兒低血糖癥等不良妊娠結局,母親及其后代罹患肥胖、心血管疾病、T2DM等疾病的風險增加[4]。GDM嚴重威脅母親及其后代的生命健康,因此有必要在孕期進行有效干預,從而預防或減少母親及其后代相關代謝性疾病的發生。目前, GDM的發病機制尚不明確,可能與T2DM的發生機制相似[5], 現有研究[6]顯示腸道菌群紊亂與T2DM的發生發展密切相關。本研究分析了GDM孕婦和T2DM患者腸道菌群特點,探討腸道菌群影響GDM和T2DM發生的可能機制,尋找差異菌群,以期為未來臨床應用腸道微生態制劑治療GDM和T2DM提供參考依據。
1 資料與方法
1.1 一般資料
選取2018年2月—2021年3月南京醫科大學附屬常州第二人民醫院產科、內分泌科、體檢科的61例女性為研究對象。將GDM孕婦納為G組(n=15), 該組符合2010年國際糖尿病與妊娠研究組(IADPSG)關于GDM的診斷標準[7]; 健康孕婦納為N組(n=18); T2DM患者納為D組(n=14), 該組符合1999年世衛組織(WHO)關于T2DM診斷標準[8]; 健康女性納為A組(n=14)。4組納入標準為: ① 20~40歲的中國女性; ② 采樣前1個月內未使用抗生素治療, 2周內未服用益生菌制劑者; ③ 無炎癥性腸病、腸易激綜合征等胃腸道疾病者; ④ 無腫瘤病史及心、肝、腎等臟器功能不全者; ⑤ 無自身免疫性疾病和甲狀腺等其他內分泌疾病者。本研究經南京醫科大學附屬常州第二人民醫院倫理委員會審批,所有參與者均簽署知情同意書。
1.2 方法
在清晨采集參與者新鮮糞便樣本,為了避免糞便表面和尿液污染,用無菌勺收集糞便內部樣品3~5 g, 置于無菌密閉管中,立即放入-80 ℃冰箱保存。同時收集所有參與者的信息,如年齡、身高、體質量、體質量指數(BMI)、血壓、總膽固醇、甘油三酯等臨床資料。
根據操作說明書使用QIAGEN公司的QIAamp PowerFecal Pro DNA Kit提取糞便細菌總DNA, 使用Qubit Fluorometer檢測DNA的濃度,采用1%瓊脂糖凝膠電泳的方法檢測DNA的完整性,將質量合格的DNA樣品送往武漢華大基因有限公司,構建測序文庫和進行Illumina HiSeq2500平臺高通量測序。
1.3 生物信息學分析
下機對原始數據進行數據過濾,得到的高質量Clean data用于后期分析; 通過reads之間的overlap關系(重疊關系)將reads拼接成Tags; 然后把Tags聚類成OTU, 再與數據庫進行比對、物種注釋; 之后基于OTU和物種注釋結果進行樣品物種多樣性分析、組間物種差異分析等。
1.4 統計學分析
采用SPSS 21.0軟件對結果進行統計學分析。計量資料中符合正態分布者用均值±標準差表示,組間比較采用獨立樣本t檢驗; 不符合正態分布者以中值(最小值,最大值)表示, 2組間比較采用Mann-WhitneyU檢驗; 所有統計學檢驗采用雙側檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1 臨床資料比較分析
G組口服葡萄糖耐量試驗(OGTT)1 h血糖、口服OGTT 2 h血糖水平高于N組,年齡、BMI大于N組,差異有統計學意義(P<0.05或P<0.01); 2組孕周、身高、體質量、收縮壓、舒張壓、空腹血糖、甘油三酯、總膽固醇比較,差異無統計學意義(P>0.05)。D組空腹血糖水平高于A組,體質量、BMI大于A組,差異有統計學意義(P<0.05或P<0.01); 2組年齡、身高、收縮壓、舒張壓、甘油三酯、總膽固醇水平比較,差異無統計學意義(P>0.05)。見表1、表2。
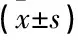
表1 G組與N組臨床資料比較分析
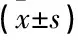
表2 D組與A組臨床資料比較分析
2.2 樣本OTU統計分析
G組與N組共33個樣本中獲得2 536 388條有效原始序列,每個樣本平均76 860條序列,平均序列利用率為97.86%, 所有序列按照97.00%的相似性水平聚類,總共得到665個OTUs。D組與A組共28個樣本中獲得2 097 298條有效原始序列,每個樣本平均74 903條序列,平均序列利用率為99.19%, 樣本序列按照97.00%的相似性水平聚類,總共得到686個OTUs。
G組與N組共有的OTUs數目為523個,表明2組樣本相似性較高, G組特有的OTUs數目為69個, N組特有的OTUs數目為73個,表明2組物種豐度存在差異; 其中,與N組相比, G組樣本的OTU數目偏少,說明GDM孕婦的物種豐度略低于健康孕婦(圖1A)。D組與A組共有的OTUs數目為461個,表明2組樣本相似性較高, D組特有的OTUs為70個, A組特有的OTUs為155個,表明2組物種豐度存在差異;與A組相比, D組樣本的OTU數目較少,說明T2DM患者的物種豐度低于健康女性(圖1B)。

A: G組和N組OTU分布Venn圖; B: D組與A組OTU分布Venn圖。G代表GDM孕婦, N代表健康孕婦; D代表T2DM患者, A代表健康女性。不同顏色代表不同的組,重疊部分為2組共有的OTUs,非重疊部分為各組特有的OTUs。圖1 G組和N組、D組與A組OTU分布Venn圖
2.3 腸道菌群多樣性分析
2.3.1 Alpha多樣性分析: 對G組與N組、D組與A組的Alpha多樣性指數進行統計學分析,結果顯示, G組、N組、D組、A組的Observed species指數分別為(232.53±55.42)、(221.72±58.16)、(174.86±63.40)、(239.64±73.04); G組、N組、D組、A組的Shannon指數分別為(3.53±0.44)、(3.47±0.56)、(2.66±0.63)、(3.00±0.61)。
G組與N組的Observed species指數、Shannon指數水平比較,差異無統計學意義(P>0.05), 表明GDM孕婦與健康孕婦的腸道菌群Alpha多樣性無顯著差異。D組Observed species指數水平低于A組,差異有統計學意義(P<0.05), 表明T2DM患者腸道中菌群的豐富度低于健康女性。D組與A組的Shannon指數水平比較,差異無統計學意義(P>0.05), 表明T2DM患者與健康女性的腸道菌群多樣性無顯著差異。見圖2。

A: G組與N組Alpha多樣性分析; B: D組與A組Alpha多樣性分析。G代表GDM孕婦, N代表健康孕婦; D代表T2DM患者, A代表健康女性。Observed species指數反映群落中物種的豐富度, Shannon指數反映群落中物種的多樣性。圖2 G組與N組、D組與A組Alpha多樣性分析
2.3.2 Beta多樣性分析: 對G組與N組、D組與A組的Beta多樣性進行統計學分析,結果顯示, G組和N組的腸道菌群各自聚集,區分良好,表明GDM孕婦與正常孕婦的菌群組成結構存在著差異(見圖3A)。D組和A組的腸道菌群各自聚集,區分良好,表明T2DM患者與健康女性的菌群組成結構存在著差異(見圖3B)。
2.4 腸道菌群結構分析
G組和N組中共檢測出11種細菌門類,包括厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、疣微菌門(Verrucomicrobia)等。2組主要由厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)組成(見圖4A)。對G組與N組的門水平物種豐度進行統計學分析,結果顯示, G組與N組相比,厚壁菌門(Firmicutes)的豐度升高,擬桿菌門(Bacteroidetes)的豐度降低,差異有統計學意義(P<0.05)。
D組和A組中共檢測出12種細菌門類,包括擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)、梭桿菌門(Fusobacteria)、放線菌門(Actinobacteria)等, 2組主要由擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)組成(見圖4B)。對D組與A組的門水平物種豐度進行統計學分析,結果顯示, D組與A組相比,變形菌門(Proteobacteria)、放線菌門(Actinobacteria)的豐度均降低,差異有統計學意義(P<0.05)。

A: G組與N組PLS-DA分析; B: D組與A組PLS-DA分析。G代表GDM孕婦, N代表健康孕婦; D代表T2DM患者, A代表健康女性。橫縱坐標表示相對距離,無實際意義,一個點代表一個樣本,大卵圓形表示G組與N組、D組與A組的腸道菌群各自聚集,區分良好。圖3 G組與N組、D組與A組PLS-DA分析

A: G組與N組物種豐度柱狀圖; B: D組與A組物種豐度柱狀圖。G代表GDM孕婦, N代表健康孕婦; D代表T2DM患者, A代表健康女性。橫坐標表示樣本名稱,縱坐標表示注釋到的物種相對豐度,右側不同顏色表示不同的物種,所有樣品中豐度均小于0.5%的物種全部合并成其他。圖4 G組與N組、D組與A組物種豐度柱狀圖
2.5 腸道菌群差異分析
LEfSe分析發現, G組與N組的腸道菌群區分良好,提示GDM孕婦與健康孕婦菌群結構明顯不同(見圖5A)。LDA分析結果顯示,厚壁菌門(Firmicutes)、梭菌綱(Clostridia)、梭菌目(Clostridiales)、擬桿菌綱(Bacteroidia)、擬桿菌目(Bacteroidales)、擬桿菌屬(Bacteroides)、毛螺菌屬(Lachnobacterium)在2組中存在顯著差異; 其中,在屬水平上, G組與N組相比,毛螺菌屬(Lachnobacterium)的豐度降低,差異具有統計學意義(P<0.05)。
LEfSe分析發現, D組與A組的腸道菌群區分良好,提示T2DM患者與健康女性菌群結構明顯不同(見圖5B)。LDA分析結果顯示,氨基酸球菌科(Acidaminococcaceae)、考拉桿菌屬(Phascolarctobacterium)、瘤胃球菌科(Ruminococcaceae)、毛螺菌屬(Lachnospiraceae)、羅氏菌屬(Roseburia)、乳桿菌目(Lactobacillales)、蘇黎世桿菌屬(Turicibacter)等49個菌群在2組中存在顯著差異; 其中,在屬水平上, D組與A組相比,考拉桿菌屬(Phascolarctobacterium)的豐度升高,羅氏菌屬(Roseburia)、蘇黎世桿菌屬(Turicibacter)等產丁酸鹽細菌豐度降低,鏈球菌屬(Streptococcus)、放線菌屬(Actinomyces)、糞球菌屬(Coprococcus)、變形桿菌屬(Proteus)等人體共生菌豐度降低,差異有統計學意義(P<0.05), 但P值經過FDR校正后,發現只有鏈球菌屬(Streptococcus)、放線菌屬(Actinomyces)仍具有統計學差異(P<0.05)。

A: G組L與N組LEfSe分析聚類圖; B: D組與A組LEfSe分析聚類圖。G代表GDM孕婦, N代表健康孕婦; D代表T2DM患者, A代表健康女性。圖中從內到外5個圈依次是門、納、目、科、屬水平的物種。不同顏色表示不同分組,與分組相同顏色的節點表示在該分組中起到重要作用的微生物群,一個節點代表一個菌群。其中,黃色節點表示的是在不同分組中沒有起到重要作用的微生物類群。圖5 G組L與N組、D組與A組LEfSe分析聚類圖
3 討 論
女性孕期體內會發生激素、免疫、代謝等方面的變化,在孕晚期容易出現胰島素敏感性降低[9],相應的腸道菌群也會發生顯著改變[10]。目前,研究[6]顯示腸道菌群在驅動代謝性疾病方面發揮重要作用,包括肥胖、T2DM。一項研究[11]發現, GDM孕婦的菌群豐度低于健康孕婦,而Alpha多樣性高于正常孕婦, GDM孕婦腸道中厚壁菌門、毛螺菌屬等水平升高,擬桿菌門、薩特氏菌屬水平降低,厚壁菌門/擬桿菌門(F/B)比值升高,與本研究結果有相似之處。本研究中,與健康孕婦相比, GDM孕婦的腸道菌群豐度下降, Alpha多樣性無差異,這可能與孕周不同有關。前者孕周在28周之后,本研究孕周在24~28周。研究[12]發現,孕婦孕晚期的腸道菌群Alpha多樣性較孕中期增加。
厚壁菌門和擬桿菌門是人體腸道菌群中的優勢菌門,兩者通過調控脂肪及膽汁酸等代謝通路,維持機體的能量平衡[13]。厚壁菌門被稱為“肥胖細菌”,在肥胖人群中明顯富集[14], 擬桿菌門剛好相反。因此,可以推測GDM孕婦腸道內菌群比例在高脂飲食誘導下發生紊亂,促進厚壁菌門的生長,抑制擬桿菌門的生長,導致機體從食物中吸收大量的能量并儲備起來,引起肥胖、胰島素抵抗、血糖升高等。因此,該比值的研究成果提示腸道菌群在未來有望成為預測GDM發病的生物標志。毛螺菌屬可通過分解膳食纖維產生短鏈脂肪酸(SCFAs), SCFAs可以為宿主細胞提供能量,維持腸上皮細胞完整性、抑制炎癥和調節腸黏膜免疫[15]。該菌屬在GDM孕婦中減少,無法給腸道細胞提供足夠的能量,抗腸道炎癥作用被削弱,引起腸黏膜屏障破壞、有害菌及炎癥因子入血,誘發GDM孕婦體內慢性低度炎癥反應,損害胰島β細胞及其他臟器,導致胰島素分泌受限、胰島素抵抗。因此,產SCFAs類有益菌有望成為臨床上治療GDM的新方法。
在正常情況下,腸道內各菌群處于動態平衡中,對維持腸黏膜屏障完整性和調控機體免疫、代謝等方面具有重要的意義[16]。當高脂飲食等引起腸道菌群結構紊亂時,腸道中革蘭氏陰性菌增多,其外膜的主要成分脂多糖(LPS)在細菌裂解后被大量釋放。高脂飲食可破壞腸黏膜屏障,促使大量LPS透過腸屏障入血,作用于免疫細胞表面Toll樣受體,誘發機體低度代謝性炎癥反應,損害胰島β細胞及其他臟器,導致胰島素分泌受限和胰島素抵抗,最終發展為糖尿病[6]。相關研究[17-18]發現, T2DM患者變形菌門豐度明顯升高。本研究結果顯示,變形菌門豐度在T2DM患者中降低,這可能與不同的測序方法、性別、種族、年齡等因素有關。研究[19]發現, T2DM患者血液中炎性細胞因子如白細胞介素(IL)-6、IL-10、腫瘤壞死因子-α(TNF-α)、C反應蛋白(CRP)等升高,提示腸道菌群紊亂引起的“代謝性內毒素血癥”可能是導致T2DM的重要環節。
羅氏菌屬、蘇黎世桿菌屬是目前已知的產丁酸細菌, QIN J J等[17]發現, T2DM患者中羅氏菌屬(Roseburia)的豐度降低,該菌屬與血糖濃度呈負相關,接近顯著水平(P=0.06)。KARLSSON F H等[20]發現,該菌屬與改善胰島素敏感性有關,可較好地識別出T2DM患者和糖耐量異常群體。研究[21-22]發現,高豐度的考拉桿菌與胃腸健康、高胰島素敏感性和減少全身炎癥有關,該菌屬在本研究T2DM患者腸道中富集,可能受該類患者主觀上限制碳水化合物攝入的影響,其與碳水化合物攝入量有關,被認為是有前景的碳水化合物攝入量的生物標志物[23]。健康的腸道菌群表現為菌群數量豐富,結構復雜且穩定,對外界環境壓力具有強大的抵抗力,反之,則表現為腸道菌群豐度及多樣性降低、有益菌比例相對下降、致病菌比例相對升高、菌群結構發生劇烈變化以及對外環境壓力的抵抗力喪失[24]。本研究中, T2DM患者的菌屬OTU豐度、物種豐富度以及數十個菌屬的數量均比健康女性低,表明T2DM患者腸道中的菌群結構發生劇烈改變。因此,未來可能通過調節腸道菌群進而實現治療T2DM。
綜上所述,與健康女性相比, GDM孕婦和T2DM患者的腸道菌群發生明顯改變,該研究成果可為未來在臨床嘗試應用腸道微生態制劑治療GDM和T2DM提供參考依據。

