鴿源性大腸桿菌的分離鑒定及茶多酚對其體外抑菌效果的研究
鐘雅靜,朱少平,陳艾玲,馬婷婷,鄧 珊,黃燕華,3,付 晶
(1.仲愷農業工程學院健康養殖創新研究院,廣州 510225;2.仲愷農業工程學院動物科技學院,廣州 510225;3.嶺南現代農業科學與技術廣東省實驗室,廣州 510640)
大腸桿菌(Escherichiacoli)引起的鴿大腸桿菌病是肉鴿養殖業中常見的細菌性疾病之一,主要經呼吸道和消化道感染,全年均可發生,各年齡段的鴿都可感染。該病以精神沉郁、食欲減退和腹瀉等為臨床癥狀,心包炎、敗血癥和腹膜炎等為典型病理變化[1-2],并且常與其他病毒病及支原體病混合感染,增加患病鴿的死亡率,給肉鴿養殖業造成巨大的經濟損失。與此同時,養殖生產中抗生素的濫用,使大腸桿菌耐藥菌株快速形成,并且在鴿肉和鴿蛋中藥物殘留現象日趨嚴重,給人類健康帶來極大威脅。因此,探尋安全、有效和綠色防治大腸桿菌病的抗生素替代品,成為肉鴿養殖業的研究熱點之一。
茶多酚(TP)主要來源于茶葉,由30多種多酚類物質組成,兒茶素的含量占其總含量中的60%~80%,具有抑菌、抗病毒、抗氧化和免疫調節等生物活性功能[3]。研究表明,茶多酚的抑菌作用具有高效廣譜性和選擇性,對變形球菌[4]、金黃色葡萄球菌[5]、鼠傷寒沙門氏菌[6]和大腸桿菌[7]等多種腸道致病菌均有抑制效果,還能促進益生菌的增殖[8]。因此,將茶多酚作為植物性抑菌劑運用于腸道細菌性疾病的防治具有一定的前景。但目前茶多酚對鴿細菌性疾病影響的研究仍未見報道。
廣州市某規模化鴿場部分種鴿出現精神沉郁,食欲和渴欲降低或廢絕,羽毛松亂,呆立,消瘦和排黃白色或黃綠色稀糞等癥狀,疑似鴿大腸桿菌病。基于此,本研究在無菌條件下采集發病鴿的糞便,通過細菌分離純化、革蘭氏染色鏡檢、16S rRNA基因測序和構建系統進化樹等技術對病原菌進行鑒定,并檢測病原菌的藥物敏感性和毒力基因攜帶情況,旨在確定廣州市某規模化鴿場腹瀉病例的病原菌。同時觀察茶多酚對該病原菌的體外抑菌效果,以期為茶多酚對鴿大腸桿菌病的防治提供一定的科學依據。
1 材料與方法
1.1 菌株
試驗致病菌株分離自廣州市某規模化鴿場的病料樣品。大腸桿菌標準菌株ATCC 25922購自青島海博生物技術有限公司。
1.2 主要試劑與儀器
營養瓊脂培養基、麥康凱瓊脂培養基、伊紅美藍瓊脂培養基、三糖鐵瓊脂培養基、LB肉湯培養基、MH瓊脂培養基、甘油、瓊脂粉和胰蛋白胨均購自青島海博生物技術有限公司;10種藥敏紙片均購自溫州市康泰生物科技有限公司;2×TaqMasterMix和DM2000 DNA Maker均購自江蘇康為世紀生物技術股份有限公司;Gene Red核酸染料購自天根生化科技(北京)有限公司;革蘭氏染色試劑盒、50×TAE溶液和茶多酚(純度≥98.0%)均購自北京索萊寶科技有限公司;細菌總RNA提取試劑盒購自北京全式金生物技術股份有限公司;反轉錄試劑盒購自TaKaRa公司;ABI PowerUPTMSYBRTMGreen預混液購自賽默飛世爾科技公司。
恒溫氣浴振蕩器購自常州市國旺儀器制造有限公司;生化培養箱購自上海慧泰儀器制造有限公司;普通PCR儀、化學發光熒光成像儀和熒光定量PCR儀均購自伯樂公司;紫外分光光度計購自上海美譜達儀器有限公司。
1.3 病原菌的分離純化和染色鏡檢
在無菌超凈臺內,將適量糞便樣品稀釋于5 mL無菌生理鹽水制備懸濁液,混勻后吸取100 μL懸濁液涂布于營養瓊脂培養基,37 ℃生化培養箱中培養12 h,觀察并記錄菌落生長情況;隨后挑取培養基中的單菌落進行純化培養,重復該操作3次,純化后的病原菌與50%甘油1∶1混合保存;挑取純化后的菌落分別接種于三糖鐵、麥康凱和伊紅美藍瓊脂培養基中,在37 ℃生化培養箱中培養12~24 h,觀察并記錄菌落形態,同時挑取典型菌落進行常規革蘭氏染色鏡檢。
1.4 病原菌的16S rRNA基因測序和系統進化樹的構建
滅菌槍頭挑取病原菌單菌落溶解于100 μL ddH2O制備細菌模板,采用細菌16S rRNA通用引物(27F:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′)進行PCR擴增。PCR反應體系共25 μL:2×TaqMasterMix 12.5 μL,細菌模板1.25 μL,引物27F和1492R各1.25 μL,ddH2O 8.75 μL。PCR反應條件:94 ℃預變性2 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸2 min,共32個循環;72 ℃再延伸10 min,最后4 ℃保存。反應結束后,取1 μL的PCR擴增產物在2.0%瓊脂糖凝膠進行電泳,并于化學發光熒光成像儀上觀察并拍照記錄。將PCR擴增陽性產物送往生工生物工程(上海)股份有限公司進行16S rRNA基因測序,并將測序結果上傳至NCBI網站的GenBank數據庫中進行Blast序列相似性比對分析。采用Mega 5.0軟件中鄰接法(Neighbor-Joining)構建基于病原菌、不同宿主的大腸埃希氏菌和5種常見致病性大腸埃希氏菌16S rRNA序列的系統進化樹。
1.5 病原菌的藥物敏感性試驗
試驗采用紙片擴散法,以大腸桿菌ATCC 25922作為質控菌株。向新鮮病原菌菌液中加入生理鹽水,調制菌液濁度至0.5麥氏單位,用無菌鋼珠將適量的菌液均勻涂布于MH瓊脂培養基的表面,待培養基表面稍干后貼上藥敏片,37 ℃生化培養箱中培養16~20 h,使用游標卡尺測量抑菌圈的直徑(mm),并以抗菌藥物敏感性判定標準[9]判斷病原菌對各抗生素的敏感性。
1.6 檢測病原菌攜帶的毒力基因
參考已報道的序列[10-12]合成大腸桿菌毒力基因fliC、fimH、iroN、hlyF、papC、vat、ibeA和iss的引物,引物信息見表1,參照1.4中的PCR方法檢測病原菌攜帶的毒力基因。

表1 毒力基因引物Table 1 Primers of virulence gene
1.7 茶多酚的體外抑菌效果
1.7.1 茶多酚對病原菌的最低抑菌濃度(MIC)和最低殺菌濃度(MBC) 參考高瑞娟等[13]報道的方法、試驗操作和判定標準測定茶多酚對病原菌的MIC和MBC。茶多酚的質量濃度分別為125、250、500、1 000、2 000、4 000和8 000 μg/mL。
1.7.2 茶多酚對病原菌生長的影響 取適量4 mg/mL茶多酚溶液與等量雙倍濃度LB肉湯培養基混合,配制2 000 μg/mL的茶多酚母液培養基。將茶多酚母液培養基倍比稀釋至濃度分別為125、250、500和1 000 μg/mL的茶多酚培養基。空白對照組為LB肉湯培養基,不作任何處理。取混勻、等量的新鮮病原菌菌液分別接種于各組的培養基中,在37 ℃ 200 r/min恒溫氣浴振蕩器培養,接種后的第0、2、4、6、8、10、12和24 h使用紫外分光光度計測定各組培養基在600 nm時的吸光值(D600 nm值),每組3個重復。
1.7.3 茶多酚對病原菌運動的影響 試驗處理及分組同1.7.2。取混勻、等量的新鮮菌液2 μL分別接種于各組的半固體瓊脂培養基平板的中心,在37 ℃生化培養箱培養12 h,觀察、拍照并測量記錄各組平板中病原菌從接種點向四周擴散生長的運動直徑(mm),每組3個重復。
1.7.4 茶多酚對病原菌毒力基因表達量的影響 試驗設置不同濃度茶多酚組和空白對照組,茶多酚組試驗濃度根據1.7.2和1.7.3試驗結果決定,培養基的配制同1.7.2。取混勻、等量的新鮮病原菌菌液分別接種于各組的培養基中。各組培養基在37 ℃ 200 r/min恒溫氣浴振蕩器培養12 h后,取適量菌液按照細菌總RNA提取試劑盒和反轉錄試劑盒的說明提取細菌RNA并制備cDNA模板。根據1.6的結果,采用實時熒光定量PCR法測定各組細菌毒力基因的表達,以大腸桿菌管家基因uidA為內參基因。PCR反應體系20 μL:SYBR Green MasterMix 10 μL,cDNA 1 μL,上、下游引物各1 μL,ddH2O 7 μL。PCR反應條件:95 ℃預變性2 min;95 ℃變性15 s,60 ℃退火1 min,共循環40次;測定熔解曲線,通過公式RQ=2-△△CT計算目基因的相對表達量。
1.8 統計與分析
試驗數據采用GraphPad Prism 5進行單因素方差分析(One-way ANOVA);并采用Tukey法進行多重比較,以P<0.05表示差異顯著,P>0.05表示差異不顯著。
2 結 果
2.1 病原菌的分離純化和染色鏡檢
病原菌在三糖鐵瓊脂培養基接種病原菌后,培養基斜面先呈黃色后轉為紅色,底部始終保持黃色,并且有氣泡產生(圖1A);在營養瓊脂培養基上長出白色、中間隆起、邊緣整齊、表面光滑的圓形菌落(圖1B);在麥康凱瓊脂培養基上長出鮮桃紅色、菌落中心呈深桃紅色、圓形、扁平、邊緣整齊、表面光滑的菌落(圖1C);在伊紅美藍瓊脂培養基上長出帶有金屬光澤的黑色、中間隆起、圓形、表面光滑、邊緣整齊的菌落(圖1D);病原菌革蘭氏染色、鏡檢后可見粉紅色,兩端鈍圓,單個、成對或成叢排列,無莢膜和芽孢的短小桿菌(圖1E),與革蘭氏陰性菌形態相符。根據臨床癥狀、分離培養特性和細菌形態學觀察的結果,初步證實病原菌為大腸桿菌,命名為GG20210604。
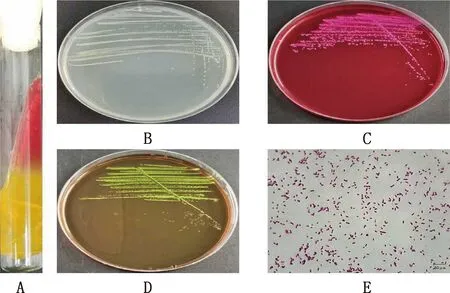
A,在三糖鐵瓊脂培養基上的菌落形態;B,在營養瓊脂培養基上的菌落形態;C,在麥康凱瓊脂培養基上的菌落形態;D,在伊紅美藍瓊脂培養基上的菌落形態;E,革蘭氏染色鏡檢形態(1 000×) A,Colony morphology in TSI medium;B,Colony morphology in NA medium;C,Colony morphology in MAC medium;D,Colony morphology in EMB medium;E,Gram stain morphology (1 000×)圖1 病原菌分離純化和染色鏡檢Fig.1 Isolation,purification and microscopic examination of pathogenic bacteria
2.2 16S rRNA基因測序和系統進化樹的構建
將GG20210604的16S rRNA擴增產物在2.0%瓊脂糖凝膠電泳后得到單一條帶,條帶大小約1 500 bp(圖2),經16S rRNA基因測序證實,該PCR擴增產物大小為1 445 bp,與預期的基因片段大小相符。將GG20210604的16S rRNA序列在NCBI進行Blast相似性比對分析,結果顯示GG20210604與GenBank中收錄的大腸桿菌(登錄號:CP057638.1)相似性最高,為99.8%。系統進化樹分析發現,GG20210604與大腸桿菌在同一分支(圖3)。結合上述菌落和革蘭氏染色形態以及16S rRNA基因測序和系統進化樹結果,最終確定GG20210604為大腸桿菌。
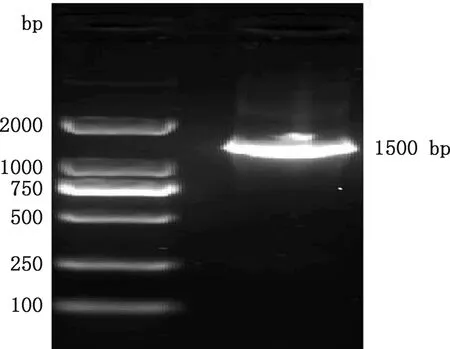
圖2 GG20210604的16S rRNA基因片段PCR擴增結果Fig.2 PCR amplification results of 16S rRNA gene fragment of GG20210604

圖3 基于 16S rRNA基因序列的系統進化樹Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
2.3 藥物敏感性試驗
由表2可知,GG20210604對頭孢唑林、慶大霉素、磺胺甲噁唑、頭孢呋辛、頭孢哌酮和丁胺卡那敏感,對鏈霉素和頭孢噻吩中度敏感,對環丙沙星和氨芐西林耐藥。

表2 藥敏試驗結果Table 2 Drug sensitivity test results
2.4 毒力基因檢測結果
由圖4可知,GG20210604毒力基因檢測中,PCR擴增出與fliC、fimH、iroN和hlyF基因預期大小一致的條帶,未擴增出與papC、vat、ibeA和iss基因預期大小一致的條帶,說明GG20210604攜帶fliC、fimH、iroN和hlyF毒力基因。
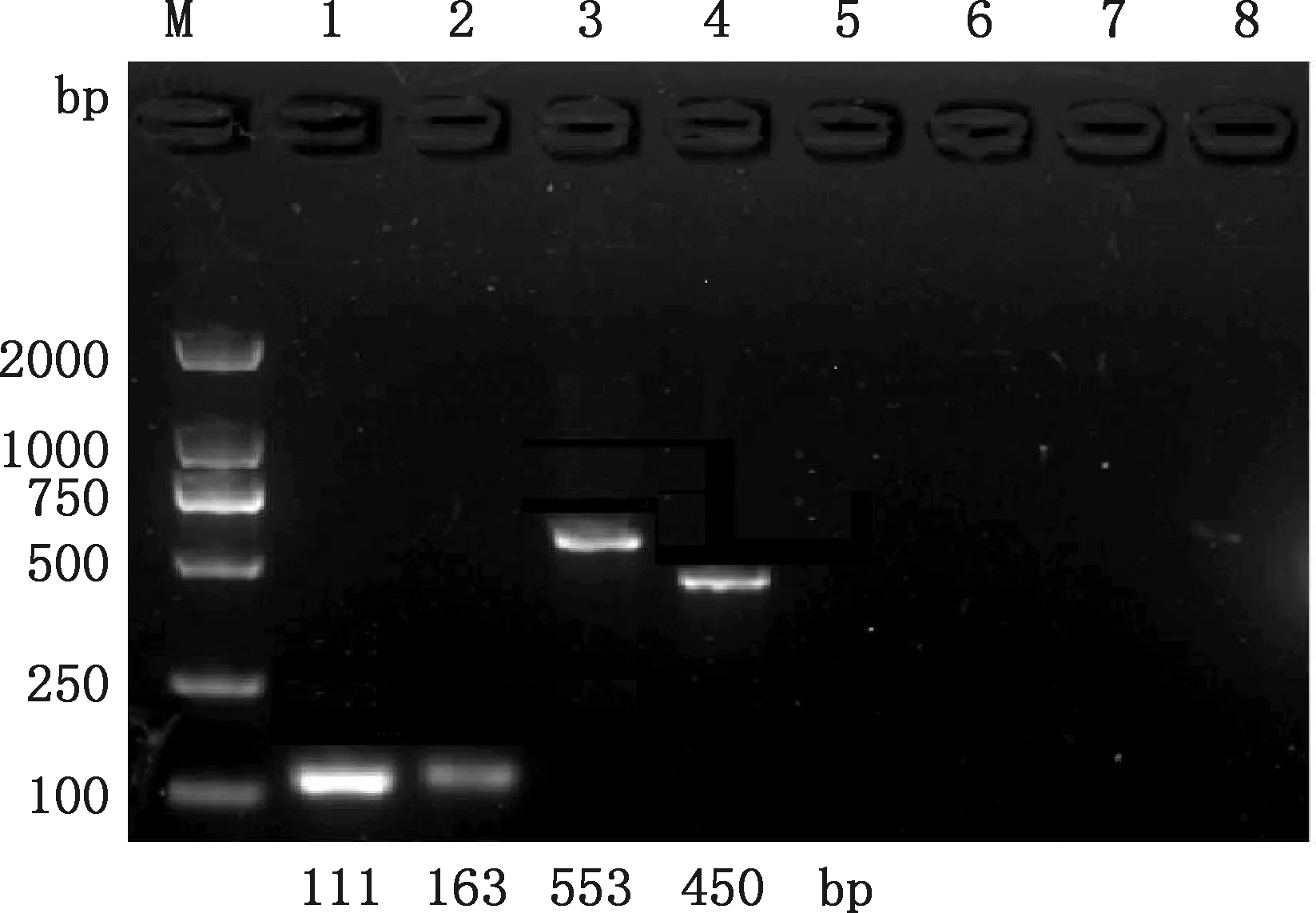
M,DM2000 DNA Marker;1,fliC基因;2,fimH基因;3,iroN基因;4,hlyF基因;5,papC基因;6,vat基因;7,ibeA基因;8,iss基因;M,DM2000 DNA Marker;1,fliC gene;2,fimH gene;3,iroN gene;4,hlyF gene;5,papC gene;6,vat gene;7,ibeA gene;8,iss gene圖4 GG20210604毒力基因的PCR擴增結果Fig.4 PCR amplification results of virulence genes of GG20210604
2.5 茶多酚的體外抑菌效果
2.5.1 茶多酚對GG20210604的MIC和MBC 37 ℃生化培養箱中培養24 h后,陰性孔內肉湯澄清,無細菌生長。對照孔內可見肉湯渾濁,細菌生長良好。茶多酚對GG20210604的MIC和MBC均為4 000 μg/mL。
2.5.2 茶多酚對GG20210604生長的影響 由圖5可知,與空白對照組相比,250、500和1 000 μg/mL茶多酚組各階段的吸光值均顯著降低(P<0.05),說明茶多酚能有效減緩GG20210604的生長速率。其中,500和1 000 μg/mL茶多酚對GG20210604生長的抑制效果無顯著差異(P>0.05)。
2.5.3 茶多酚對GG20210604運動的影響 由圖6可知,與空白對照組相比,各濃度茶多酚組GG20210604的運動直徑均顯著降低(P<0.05),125、250、500和1 000 μg/mL茶多酚組的GG20210604運動直徑分別為空白對照組的46.01%、13.34%、11.54%和8.56%。

A,GG20210604在茶多酚半固體瓊脂培養基的運動圖;B,茶多酚對GG20210604運動直徑影響的柱狀圖 A,GG20210604 movement image in TP soft agar plates;B,Histogram of the effect of TP on the diameter of GG20210604圖6 茶多酚對GG20210604運動的影響Fig.6 Effect of TP on the movement of GG20210604
2.5.4 茶多酚對GG20210604毒力基因表達的影響 綜上,當茶多酚濃度為500和1 000 μg/mL時,對GG20210604生長和運動的影響無顯著差異,因此本試驗只檢測250和500 μg/mL茶多酚對GG20210604毒力基因表達的影響。結果見圖7,與空白對照組相比,250 μg/mL茶多酚組GG20210604的fimH基因的表達顯著降低(P<0.05);250和500 μg/mL茶多酚組GG20210604的fliC、iroN和hlyF基因的表達均顯著降低(P<0.05)。

圖7 茶多酚對GG20210604毒力基因表達的影響Fig.7 Effect of TP on virulence gene expression of GG20210604
3 討 論
近年來肉鴿養殖業發展十分迅速,但隨之而來的養殖密度增大、鴿舍通風不良導致氨氣等有害氣體含量高和飼養管理不當等因素導致的傳染病暴發屢見不鮮。鴿大腸桿菌病是危害肉鴿養殖業發展的常見傳染病之一[2],本研究從疑似感染大腸桿菌病的鴿糞便中分離到1株致病菌株,經分離純化、染色鏡檢、16S rRNA基因測序和系統進化樹分析,證實該菌株是大腸桿菌,并命名為GG20210604。從藥敏試驗結果觀察到,GG20210604對環丙沙星和氨芐西林耐藥,菌株耐藥性的產生可能與生產管理中抗生素使用頻繁、使用種類單一以及耐藥質粒的水平傳播有關,建議該鴿場在今后臨床治療中合理規范用藥,采取聯合、交替用藥方式,避免多重耐藥菌株的產生。同時可以選擇中獸藥、植物提取物等天然抗菌劑進行治療,減少耐藥菌株的出現。大腸桿菌的致病性通常由多種毒力因子如黏附素、攝鐵系統、脂多糖和侵襲素等相互協調發揮作用,已有研究表明,大腸桿菌的致病性與攜帶的毒力因子的數量具有顯著相關性[14]。因此檢測大腸桿菌攜帶毒力基因對于其致病能力的評估有重要意義。Ewers等[15]認為,非致病性大腸桿菌沒有或至多含有3個毒力基因,而致病性大腸桿菌至少含有4個毒力基因。iutA、hlyF、iss、iroN和ompT5個基因與禽致病性大腸桿菌的致病性顯著相關[16]。毒力基因檢測結果表明,GG20210604攜帶fliC、fimH、iroN和hlyF4種毒力基因。根據GG20210604的藥物敏感性和毒力基因檢測結果并結合病死鴿臨床癥狀,提示GG20210604具有一定毒力,對宿主具有較強的致病性,養殖戶應加強日常飼養管理,加大對鴿大腸桿菌病的防控力度。
大量研究表明,茶多酚可通過破壞細菌細胞壁膜結構、改變菌體正常形態、細胞內容物外泄、抑制蛋白質合成與表達、影響細菌DNA的轉錄與復制和與金屬離子絡合等方式發揮抑菌的生物特性[3]。本試驗通過茶多酚對GG20210604的體外抑菌試驗發現,茶多酚對鴿源性大腸桿菌具有良好的抑菌效果。試驗結果表明,茶多酚對GG20210604的MIC和MBC均為4 000 μg/mL。Ma等[7]試驗中,茶多酚對ETEC K88的MIC和MBC分別是5 000和10 000 μg/mL,與本試驗結果不相同,可能與菌株的來源和耐藥性以及茶多酚的純度等原因有關。茶多酚對GG20210604生長影響的結果顯示,當茶多酚的濃度≥250 μg/mL時,菌株在指數期的生長顯著減緩,說明茶多酚對鴿源性大腸桿菌的生長具有抑制作用,并且呈現濃度依賴性。Xiong等[17]研究指出,茶多酚可以誘導大腸桿菌發生內源性氧化應激,從而抑制細菌的生長。Si等[18]研究發現,以茶多酚的主要成分表沒食子兒茶素沒食子酸酯(EGCG)和沒食子兒茶素(EGC)處理細菌后,細菌形態由長桿狀變為短棒狀或球狀,可能是由于細胞分裂受阻所致。茶多酚對GG20210604運動影響的結果表明,茶多酚顯著抑制了GG20210604向培養基四周擴散,有效降低了其運動能力,與于淑池等[19]的研究結果一致。腸道致病細菌的運動能力是重要的致病因素之一,可以幫助細菌附著于宿主體內并遷移到營養物質豐富的位置進行增殖,并且細菌的運動能力對生物膜形成以及在宿主表面的黏附聚集過程中具有重要作用[20]。而鞭毛是介導細菌運動能力的主要器官。提示茶多酚能夠干擾鞭毛的正常功能,從而調控鴿源性大腸桿菌的運動能力,并且可能影響鴿源性大腸桿菌的生物膜形成和黏附功能。
毒力基因在細菌致病性中起重要作用。Schneier-Rayman等[21]研究結果表示,0.55 mg/mL EGCG使變形鏈球菌株的gtfC、gtfB和ftf毒力基因表達降低70%~90%。在Apisada等[5]的研究中,500 mg/L EGCG可以使金黃色葡萄球菌溶血活性相關基因表達下調75%,但葡萄糖攝取系統和膜轉運相關基因表達上升,推測金黃色葡萄球菌可能通過加強葡萄糖的吸收,促進細胞膜的修復,進而抵抗EGCG的損傷。大腸桿菌fliC基因編碼的鞭毛蛋白是鞭毛的主要結構亞基,研究表明,fliC基因對細菌的運動、毒力因子的釋放、生物膜形成和對外界壓力的抵抗有重要作用[22]。菌毛是細菌在宿主黏膜細胞黏附定居的第一武器,常見的菌毛有Ⅰ型菌毛、P菌毛和Curli菌毛等,其中Ⅰ型菌毛最為常見。黏附素蛋白fimH是菌毛長度和數量的調控因子,同時是Ⅰ型菌毛與D-甘露糖特異性結合的黏附素,可特異性與紅細胞和酵母細胞結合,為細菌進一步侵入機體、引發感染創造條件[23]。iroN是參與細菌內部鐵離子吸收和轉運的相關基因,而鐵離子是細菌在生長繁殖過程中必需的離子之一,如果鐵離子的吸收或轉運障礙,細菌就不能正常的生長和繁殖[24]。溶血素hlyF可以促進外膜囊泡的分泌,將細菌的毒力因子、遺傳因子和免疫調控因子等運輸到宿主細胞,并且能誘導宿主細胞發生自噬[25]。茶多酚對GG20210604毒力基因表達影響的結果顯示,經茶多酚處理后,該菌株的毒力基因fliC、iroN、fimH和hlyF的表達均被顯著下調,其中,fliC毒力基因表達下調的結果與茶多酚對GG20210604運動的抑制結果相一致。較為有趣的是,與空白對照組相比,當茶多酚濃度為500 μg/mL時,對fimH基因的表達無顯著影響,而250 μg/mL茶多酚則顯著降低了fimH基因的表達,推測茶多酚抑制不同毒力基因表達的適宜劑量存在差異性,造成該現象的具體原因有待進一步研究。Lagha等[26]研究指出,茶多酚螯合鐵離子的能力是茶多酚發揮抑菌作用的原因之一。白細胞毒素LtxA是放線菌分泌的外膜囊泡蛋白,可通過凋亡效應誘導淋巴細胞死亡,Chang等[27]研究表明,EGCG可改變LtxA的二級結構,阻止LtxA與細胞膜的膽固醇結合。由此推測,茶多酚可能會通過抑制GG20210604毒力基因的表達,降低大腸桿菌對外界環境的抵抗力,并且螯合鐵離子和改變蛋白質的結構抑制GG20210604黏附、侵襲、鐵攝取和增殖等生理過程達到抑菌效果。
目前,細菌性疾病的防控是肉鴿養殖業面臨的巨大挑戰之一。茶多酚主要來源于茶葉,具有高效廣譜的抑菌作用,且病原菌不易產生耐藥性,是一種綠色、天然的植物性抑菌劑。本研究的試驗結果與前人研究結果相符合,均肯定了茶多酚對大腸桿菌具有抑制作用。但本研究發現茶多酚抑制不同毒力基因表達的適宜劑量存在差異性。因此,在實際生產中需合理安排茶多酚用藥量。隨著對茶多酚抑菌機理的深入了解以及茶多酚生產工藝不斷升級、優化,茶多酚在今后的細菌性疾病的防控中具有良好的發展前景。
4 結 論
本研究從鴿糞便中分離得到1株大腸桿菌,命名為GG20210604。該菌株對環丙沙星和氨芐西林有一定的耐藥性,且攜帶fliC、fimH、iroN和hlyF4種毒力基因,具有一定的致病性。此外,體外抑菌試驗結果表明,茶多酚對該菌株的MIC和MBC均為4 000 μg/mL,125~1 000 μg/mL的茶多酚均可不同程度地抑制該菌株的生長、運動和毒力基因的表達。本研究可為茶多酚應用于鴿大腸桿菌臨床感染的預防和治療提供參考。

