鋰離子電池低溫電解液的研究現狀與發展趨勢
喬 昕,陶園學,鄭 瑩,崔昌盛,胡棋威,裴 波
應用研究
鋰離子電池低溫電解液的研究現狀與發展趨勢
喬 昕1,陶園學1,鄭 瑩2,崔昌盛1,胡棋威1,裴 波1
(1. 武漢船用電力推進裝置研究所化學電源事業部,武漢 430064;2. 中國艦船研究設計中心,武漢 430064)
低溫鋰離子電池的開發是目前儲能技術研究的巨大挑戰之一。現階段使用的商用電解液在低溫下離子電導率低、易凝固,直接對電池的低溫性能產生嚴重影響。因此對低溫電解液的研究與改性是合理設計低溫鋰離子電池的關鍵。本文分析了電池低溫性能的影響因素,從鋰鹽、溶劑與添加劑三個方面綜述了國內外研究現狀,對不同改進策略進行了分類與討論,最后對未來低溫電解液的研究方向和前景進行了展望。
鋰離子電池 低溫電解液 鋰鹽 溶劑 添加劑
0 引言
相比于傳統的動力電池如鉛酸電池、鎳鎘電池等,具有無記憶效應、能量密度高、自放電小、輸出電壓高、循環壽命長等優點的鋰離子電池已成為目前動力電池發展的主流。但隨著鋰離子電池深入應用于船舶、航天以及軍用領域,對鋰離子電池的工作環境提出了更高的要求。其中,實現良好的低溫性能(低于-40 ℃)是目前商業化鋰離子電池最大的挑戰之一。由于目前廣泛使用的電解液的熔點高于-20 ℃,鋰離子電池的普遍工作溫度為-20~60 ℃,要實現更低的工作溫度,就勢必要對低溫電解液進行設計和開發。
電解液的組成成分主要為鋰鹽、溶劑與添加劑,其低溫性能受到多種因素的影響:1)從動力學角度來說,溫度越低,電解液中鋰離子的擴散速率越慢,電荷轉移阻抗也就越大,電極上的活性物質無法從電解液中快速得到鋰離子,造成反應極化的增大;2)低溫下分子的熱運動減慢,致使電解液的黏度增大,溶劑離子遷移率降低,離子電導率隨之降低;3)首次充放電過程中由電解液參與反應在電極表面形成的SEI膜是鋰離子的良好導體,而在低溫下SEI膜的導離子能力顯著下降,從而進一步減慢了反應速率。綜上可知,電解液的改性是開發低溫鋰離子電池的關鍵策略。本文綜述了近年來低溫電解液的研究,從鋰鹽、溶劑、電解液添加劑三個方面進行總結,并展望未來低溫電解液的改進方向。
1 鋰鹽
電解液中的鋰鹽是提供鋰離子傳輸擴散的基礎。最早所使用的鋰鹽為LiClO4(高氯酸鋰)、LiAsF6(六氟砷酸鋰),但由于LiClO4安全性能較差,LiAsF6毒性較大,均不適用于商業化[1]。目前廣泛商用的鋰鹽為LiPF6(六氟磷酸鋰),它具有較高的電化學穩定性與電導率,并易溶于有機溶劑。但LiPF6的熱穩定性較差,遇水易分解生成LiF和HF,對電極材料和集流體造成腐蝕[2]。又由于LiPF6一般僅使用于熔點高的EC溶劑中才能形成穩定的SEI膜,在低溫條件下,EC對LiPF6的溶解度下降造電解質成分析出,因此LiPF6難以適用于低溫環境。在低溫條件下使用的鋰鹽需要具有良好的熱穩定性與成膜性,目前較多研究的主要為硼酸鹽類、含氟甲基類以及亞胺類鋰鹽。
1.1 硼酸鹽類
LiBF4(四氟硼酸鋰)相比于LiPF6,其電化學穩定性與電導率較低,因此較少在室溫環境下使用。然而LiBF4熱穩定性高,電荷轉移阻抗小,對水不敏感,因此在低溫條件下能夠表現出更好的性能。在PC/EC/EMC混合溶劑中使用LiBF4作為鋰鹽,電池在-30 ℃下容量能保持室溫時的86%,即使在-50 ℃下仍能夠正常放電[3]。但LiBF4的成膜性較差,單獨作為鋰鹽使用時會造成SEI的不穩定,在首圈充放電過程中易形成溶劑化鋰。
LiBOB(雙草酸硼酸鋰)具有良好的耐過充性、吸濕性與成膜性,在熔點低的PC溶劑中使用,能夠在負極表面形成穩定的SEI膜[4]。但LiBOB難溶于DMC、DEC、EMC等鏈狀的碳酸酯溶劑,導致在低溫下電解液黏度高,在-50℃下已經無法放電。因此LiBOB通常作為鋰鹽添加劑或與其他鋰鹽配合使用。Zhang等人[5]將摩爾比為0.98:0.02的LiBF4/LiBOB鋰鹽應用于LiNiO2/石墨電池體系,在-40 ℃低溫下,能夠實現相比于常溫63%的放電容量。將LiBOB與LiBF4按物質的量1:1混合形成的LiODFB(二氟草酸硼酸鋰)同時具備了成膜性與低溫性好的優點[6]。不僅如此,LiODFB還具有抑制電解液氧化,鈍化鋁箔的作用,表現出明顯優異的低溫放電性能。
1.2 含氟甲基類
含有CF3SO2-基團的鋰鹽,如LiCF3SO3(三氟甲磺酸鋰)、LiCH(CF3SO2)2、LiC(CF3SO2)3等,被視為有前景的低溫電解液鋰鹽。含氟磺酸鋰鹽由于其陰離子中引入了-F、-SO2這類吸電子基團,使得陰離子半徑較大,提高了鋰鹽的電化學穩定性和熱穩定性,同時較強的電荷離域作用使得鋰鹽更容易解離[7]。LiCF3SO3具有較好的循環性能,但使用于有機溶劑時電解液腐蝕鋁的電位僅為3.1V,容易腐蝕集流體。LiC(CF3SO2)3熔點為273 ℃左右,熱分解溫度達到了340 ℃,且不會對鋁箔造成腐蝕,是目前穩定性最好的有機電解質類鋰鹽。由于在電解質鋰鹽中LiC(CF3SO2)3具有最大的陰離子半徑,其易電離的特性使電解液能夠達到相對更高的電導率[8]。1mol/L的LiC(CF3SO2)3電解質溶液電導率可達到1.0×10-2S/cm,即使在-30 ℃低溫下電導率仍保持在1.0×10-3S/cm以上。
1.3 亞胺類
含有CF3SO2-以及氟烷氧基的亞胺鋰鹽,如LiFSI(雙氟磺酰亞胺鋰)、LiTFSI(雙三氟甲磺酰亞胺鋰)等,具有良好的溶解性和較高的氧化電位。此外,由于陰離子中酰胺上的氮連接強吸電子基團,氮上負電荷的分散分布,利于解離出Li+。在亞胺鋰鹽中,LiTFSI的研究最為廣泛,相比于含氟甲基類鋰鹽具有更高的穩定性。LiTFSI的熔點在237℃左右,熱分解溫度高達360 ℃,室溫下電導率為4.0×10-3S/cm,并能夠在負極表面形成穩定、低電阻的SEI膜。Mandal等人[9]將0.9 mol/L的LiTFSI在EC/DMC/EMC混合溶劑中作為電解液使用,在-40 ℃條件下實現了2.0×10-3S/cm的電導率。但LiTFSI仍不可避免會產生腐蝕鋁箔或銅箔集流體的現象。
目前主要使用的電解液鋰鹽及其優缺點如表1所示,需根據每種鋰鹽自身的性質選擇合適的使用環境。在低溫條件下,鋰鹽選用LiODFB、LiTFSI等能夠實現更良好的電池性能。
2 溶劑
電解液中溶劑的質量占比超過了80%,溶劑的各種重要性質如黏度、介電常數、熔點、沸點、閃點等會顯著影響電解液的電導率和循環性能。目前鋰離子電池電解液最常用的溶劑為有機溶劑,以碳酸酯類為主,同時也有使用羧酸酯類和亞硫酸酯類溶劑。碳酸酯類溶劑又可分為以EC(碳酸乙烯酯)、PC(碳酸丙烯酯)為主的環狀碳酸酯和以DEC(碳酸二乙酯)、DMC(碳酸二甲酯)、EMC(碳酸甲乙酯)為主的鏈狀碳酸酯。羧酸酯類溶劑主要有MF(甲酸甲酯)、MA(乙酸甲酯)、EA(乙酸乙酯)等。亞硫酸酯類溶劑有DMS(亞硫酸二甲酯)、DES(亞硫酸二乙酯)等。對于電解液的低溫性能來說,溶劑的熔點和沸點是最關鍵的影響因素,部分溶劑的凝固會造成電解液導電能力的顯著下降。常用有機溶劑的分類與熔沸點參數如圖1所示。羧酸酯、亞硫酸酯類溶劑具有更低的熔點,可作為良好的低溫溶劑。EC等溶劑具有高介電常數與良好的成膜性,在形成SEI的過程中起到關鍵作用,但無法滿足低溫電解液的溫度需求,一般需要與低熔點的其他溶劑混合,形成二元、三元或四元等多元共混溶液使用。低溫溶劑的綜合性能提升還需通過合理設計來實現。
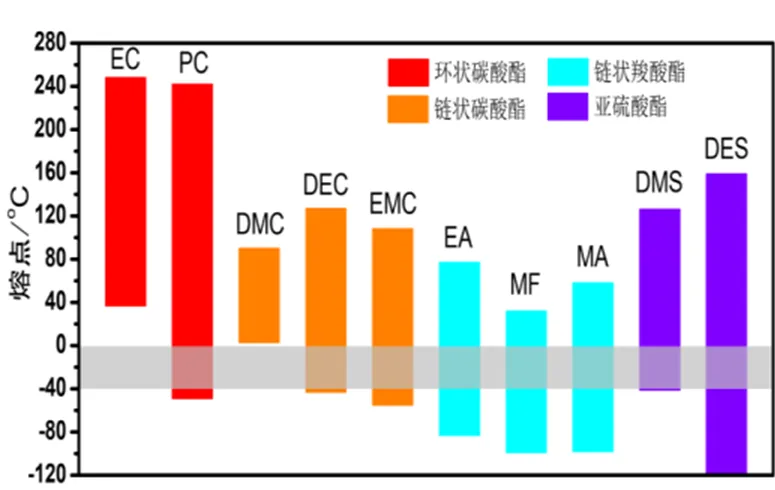
圖1 常用有機溶劑的分類與熔沸點參數
2.1 環狀碳酸酯類
電解液的離子電導率直接受溶劑的介電常數與黏度所影響。一般來說,介電常數越高,鋰鹽的電離程度就越大,離子電導率越高;而黏度越大,離子遷移數降低,離子電導率越低。環狀碳酸酯相比于鏈狀,其結構具有更大的極性,因此其介電常數明顯更高;而環狀結構的作用力更大,也使環狀碳酸酯同時具備了高熔點和高黏度。EC的熔點接近40 ℃,低溫下黏度大幅提高甚至凝固,無法單獨使用。Plichta等人[10]將EC與DMC、EMC共混制備了三元溶劑,使用LiPF6作為鋰鹽,在-40 ℃下可正常工作。這一組成的電解液已在國內外作為通用的商業化鋰離子電池電解液使用。
PC的熔點能夠達到接近-50 ℃,能夠良好適用于低溫環境,但成膜性較差。相比于EC,PC的結構中多出一個甲基,易與鋰離子形成溶劑化鋰共嵌入石墨層間,造成結構的破壞。Wang等人[11]證明,EC可以有效抑制PC嵌入石墨負極,因此EC與PC的共溶劑可以改善鋰離子電池的低溫性能。此外,研究人員發現,Ca2+等具有路易斯酸特性的陽離子可以先于Li+與PC上的甲基發生溶劑化反應。在PC基溶劑體系中引入Ca[N(SO2CF3)2]2,可抑制溶劑化鋰的形成和嵌入石墨層間,防止負極結構坍塌。
2.2 鏈狀碳酸酯類
鏈狀碳酸酯相比于環狀,雖介電常數較低,且揮發性較大,溫度窗口較窄,但具有更低的黏度和熔點,因此鏈狀碳酸酯適合用作低溫共溶劑,常與環狀碳酸酯配合使用,彌補高熔點與高黏度的缺陷,優化電解液的低溫性能。Smart等人[12]研究了EC/DEC/DMC/EMC的四元低溫電解液溶劑體系,通過DEC和EMC調節共溶劑熔點、DMC調節共溶劑黏度。此共溶劑與1.0 mol/L的LiPF6配制電解液,在-20 ℃下循環容量能保持室溫時的80%,在-40℃低溫下離子電導率仍能達到1.32 mS/cm,并在循環中可得到70%的室溫容量。肖等人[13]研究了不同鏈狀碳酸酯與EC共混形成的多元溶劑體系,優化各溶劑成分的配比含量,最終得到DMC/EMC/EC共溶劑體積比為25: 66.7: 8.3時,在-40 ℃下0.1C放電容量能夠保持室溫下的90%。低熔點的EMC作為共溶劑極大拓寬了電解液的使用溫度范圍,用于提升低溫性能十分有效。王等人通過對LiCoO2/Li電池體系的研究,發現在EMC: EC: PC體積比為4: 1: 1時得到了最高的放電容量。任等人研究了EMC/EC/PC三元溶劑體系的“質量三角模型”,得到結果-40 ℃低溫下EMC:EC:PC質量比為0.59: 0.22: 0.19時電解液的離子電導率達到最高的0.745 mS/cm。
2.3 羧酸酯類
鏈狀羧酸酯類溶劑具有比鏈狀碳酸酯更低的熔點與黏度,并在低溫下具有相對更高的電導率,因此也常用作電解液的溶劑。羧酸酯類溶劑由于沸點較低,更適用于低溫溶劑體系。韓等人將MA與EC按體積比1:1配制溶劑,相比于商業化的電解液溶劑EC/DMC,能實現更高的循環容量與效率。Herreyre等人[14]研究了羧酸酯和碳酸酯的混合溶劑體系,發現將低熔點的EA和MB組成二元/三元混合溶劑,電解液的離子電導率在-20 ℃下可達到7mS/cm,在-35 ℃下可達到5mS/cm,遠高于一般使用的電解液(-20℃下離子電導率為2mS/cm)。使用PC/EC/MB溶劑體系的電解液,在-30℃下電池的放電容量保持率可實現98%的初始容量。EinEli等人使用MF:EC體積比為3:1的共溶劑,有效拓寬了電解液體系的低溫范圍,分別使用1mol/L LiAsF6和1mol/L LiMe(三(三氟甲烷磺酰基)甲基化鋰)作為鋰鹽,在-40 ℃下分別達到了8.4和5.4 mS/cm的離子電導率。
2.4 亞硫酸酯類
亞硫酸酯類溶劑普遍具有較低的熔點,又由于自身的S=O鍵而具有較強的極性,其中S原子上的兩個未成鍵電子可與Li結合。亞硫酸酯的介電常數明顯高于鏈狀碳酸酯,而黏度又低于環狀碳酸酯,并同時具備良好的低溫性能與成膜性能,因此亞硫酸酯既可作為溶劑單獨使用,也可用作共溶劑與添加劑。如分解電壓高于4.5 V的PS(亞硫酸丙烯酯)與DMS能夠完全滿足電解液溶劑的需求,而分解電壓僅有3.5 V的ES(亞硫酸乙烯酯)和DES更多作為添加劑使用。Wrodnigg等人[15]研究了亞硫酸酯類的混合溶劑,發現ES、DES、DMS與EC配制成共溶劑,能得到比碳酸酯和羧酸酯更好的導電性能和低溫性能,且更有利于在石墨表面形成更穩定的鈍化層。ES與PS有助于在石墨負極中嵌入Li,添加PS能夠有效防止PC溶劑分子在石墨負極的嵌入,因此PC也常與亞硫酸酯搭配作為低溫溶劑使用。Zhang等人分別將體積比為3:7的EC/EMC和體積比為1:1:3的PC/EC/EMC作為溶劑,1mol/L的LiPF6作為鋰鹽,對比性能發現,PC與EMC共混的溶劑體系能夠明顯改善電池的低溫性能。
3 添加劑
鋰離子電池電解液添加劑能夠以極小的添加量起到對電解液性能的明顯改善,在基本不增加電解液成本的前提下大幅提高電池性能,因此電解液添加劑也成為了一個研究熱點。電解液添加劑可以起到改善SEI成膜性、阻燃性、穩定性、浸潤性以及抗過充、高壓等作用。在低溫體系下,電解液添加劑的主要功能是幫助生成低阻抗的SEI膜,提高電導率,以實現鋰離子電池良好的低溫放電性能。常見的低溫電解液添加劑主要有亞硫酸酯類、碳酸酯類、砜類以及其他無機添加劑。
3.1 亞硫酸酯類
如前文所述,亞硫酸酯由于更高的電化學穩定性及更低的熔點和黏度,既可作為溶劑又可作為添加劑使用。亞硫酸酯類添加劑具有與碳酸酯相似的結構,但由于其中心位置的硫元素電負性強,使其在石墨負極表面具有更強的還原性,-SO3-基團上的氧原子會與Li+產生強烈的配位作用而形成陰離子自由基,其還原電位在1.7-2.1 V左右。因此亞硫酸酯作為添加劑使用時可以先于溶劑在石墨表面還原形成穩定的SEI膜,其主要成分為無機鹽Li2S、Li2SO3、Li2SO4和有機鹽ROSO2Li。姚等人將0.01%的DTD(硫酸亞乙酯)作為添加劑使用于EC/DMC/EMC作為溶劑、LiPF6作為鋰鹽的電解液中,顯著降低了MCMB/Li電池體系的阻抗,并提升了低溫放電性能,將放電容量由300 mAh/g提升至350 mAh/g。但亞硫酸酯電解液添加劑也存在明顯缺點,隨著電池循環次數的增加,亞硫酸酯在負極形成的SEI膜穩定性會降低,導致界面阻抗升高,極化趨于嚴重,可逆容量迅速衰減。
3.2 碳酸酯類
環狀不飽和碳酸酯如VC(碳酸亞乙烯酯)和VEC(碳酸乙烯亞乙酯)常用作有機成膜電解液成膜添加劑,其中,VC是商品化鋰離子電池電解液中使用最多、研究最多的低溫添加劑。VC具有環狀碳酸酯EC、PC相近的分子結構,但不飽和的C=C鍵使其具有更活潑的化學性質,在放電過程中可以在更高的電位下斷鍵,并生成大分子聚合物參與形成SEI膜。VC在電解液中的使用量一般不超過2%,卻能夠改善高低溫下SEI膜的穩定性,顯著提高電池的首圈效率與循環壽命。王等人[16]在電解液中引入VC添加劑改善電極界面性能,電池在-20℃下的放電平臺提高了約25%,放電容量明顯提升。VEC由于相比VC多出一個富電子的C=C鍵,較不易與酯類基團的雙鍵發生反應,因此具有比VC更高的穩定性。但VEC由于具有較高的熔沸點,更適合于在較高溫度下使用。
FEC(氟代碳酸乙烯酯)是另一種特別有效的低溫添加劑,并已廣泛使用于商用電解液中。Xu[17]提出在EC、PC的甲基或亞甲基位置引入-F、-Cl等取代基得到的新型碳酸酯溶劑體系具有更低的熔點和更高的閃點,能夠穩定提升電池的低溫性能與安全性能。在結構上,FEC相比于EC多一個氟取代基團,-F具有極強的吸電子能力,使FEC能夠在較高的電位下即在負極界面還原并鈍化電極表面,對電極產生良好的保護作用。此外,FEC還可以失去一個HF分子生成VC,HF能與SEI中的堿性成分反應生成均勻的LiF成分的SEI層,從而抑制鋰枝晶的生成,提高電池的安全性。Liao等人將2%體積含量的FEC用作磷酸鐵鋰電池的電解液添加劑,結果發現添加FEC的電解液低溫下界面阻抗明顯降低,電池在-20℃下0.5 C的循環比容量提升了接近10 mAh/g。
3.3 砜類
砜類化合物如MPS(苯甲砜)、MVS(甲基乙烯基砜)、EVS(乙基乙烯基砜)、環丁砜等,具有耐高壓、極性強、電化學穩定性高的特點,且與石墨相容性好,能夠在負極形成穩定鈍化層,已在電解液中廣泛應用。但砜類化合物由于黏度較高,對隔膜的浸潤性較差,不能單獨作為溶劑使用,而作為添加劑引入碳酸酯溶劑體系則表現出良好的性能。Wagner等人[18]將MVS和EVS作為成膜添加劑使用于PC基溶劑體系,僅2%的添加量即能夠抑制石墨片層的脫落,明顯提升電池的低溫長循環比容量。
3.4 其他添加劑
除了最常見的有機電解液添加劑外,很多無機物也能作為添加劑有效發揮作用。最早期的無機成膜添加劑主要為SO2、CO2等的小分子無機物。Aurbach等人[19]早在1994年就在LiAsF6/MF電解液體系中引入少量CO2作為添加劑,能夠在負極表面生成穩定的Li2CO3鈍化層,明顯提高了電池的循環性能。相比于C-O鍵,Si-O鍵更強,也使得硅類化合物的氧化穩定性更高。Bhattacharyya等人首先發現將少量SiO2引入LiPF6/EC+DMC電解液體系中,在-23℃低溫下能夠明顯提升電解液的電導率。Hamenu等人使用了一種綠色環保的途徑制備了Li-SiO2納米鹽,并作為添加劑用于鈷酸鋰/石墨電池體系,在低溫-20 ℃下有效降低了電池阻抗并提高了EC基電解液的離子電導率。此外,有機硅類化合物如硅氧烷類也得到了相應研究。Louis等人在電池中使用了1%質量分數的PDMS-A(聚二甲基硅氧烷)添加劑,在石墨負極表面還原生成大量的Si,并形成致密的SEI層,有利于提升電池的放電容量。
4 總結與展望
隨著新能源應用于各個行業中,在低溫等特殊工作環境下的鋰離子電池得到了廣泛研究,并已取得大量進展。相比于電極材料,對低溫電解液的改善與優化更易于實現,同時也是最關鍵的突破口。對低溫電解液的合理設計需將鋰鹽、溶劑與添加劑三者有效結合,共同開發新的體系,以發揮協同作用。對于鋰鹽來說,各類有機配合物鋰鹽,大多是通過引入強吸電子性的原子(如氟原子)或基團(如磺酸基、芳香基)來增大陰離子半徑,使陰離子電荷趨于分散,從而降低鋰鹽的晶格能,增大溶解度,以此提高鋰鹽的水解穩定性、熱穩定性與電化學穩定性。目前鋰鹽的研究方向一方面是控制陰離子的結構,開發新型的有機陰離子半徑更大的鋰鹽;另一方面是將兩種或多種鋰鹽搭配使用,以彌補不同類鋰鹽的缺點,得到低溫下各方面性能更好的新型鋰鹽。溶劑方面,首先應選用低熔點的溶劑體系如PC、羧酸酯類或亞硫酸酯類與高介電常數的溶劑如EC共混構成多元溶劑,再通過如PS等溶劑改善與電極的兼容性,開發出多功能的新型電解液溶劑。對于溶劑本身性質可能造成的成膜性差、循環性能低的問題,可通過多種有機無機添加劑進行優化,如VC、FEC等添加劑能夠大幅提高電解液的穩定性,從而顯著提升低溫放電容量。另一方面,合理調控添加劑用量與比例也能夠實現更好的低溫性能。低溫電解液及低溫鋰離子電池的研究進展將會極大程度地推動電動汽車、船舶、航天事業以及各類民用、軍用儲能設備的大力發展。
[1] 韓周祥. 鋰離子電池導電鋰鹽研究進展[J]. 電池工業,2006, 11(5): 333-337.
[2] Yamaki J-i, Shinjo Y, Doi T, et al. The rate equation of decomposition for electrolytes with LiPF6in Li-ion cells at elevated temperatures[J]. Journal of The Electrochemical Society, 2015, 162(4): A520-A530.
[3] Zhang S S, XuK, Jow T R.A new approach toward improved low temperatureperformance of Li-ion battery[J].Electrochemistry Communications 2002, 4: 928-932.
[4] Xu K, Zhang S S, Lee U, et al. LiBOB: Is it an alternative salt for lithium ion chemistry?[J]. Journal of Power Sources, 2005, 146(1-2): 79-85.
[5] Zhang S S, XuK, Jow T R. The low temperature performance of Li-ion batteries[J]. Journal of Power Sources, 2003, 115(1): 137-140.
[6] Zhang S S. An unique lithium salt for the improved electrolyte of Li-ion battery[J]. Electrochemistry Communications, 2006, 8(9): 1423-1428.
[7] McKenzie I, Harada M, Kiefl R F, et al.Beta-NMR measurements of lithium ion transport in thin films of pure and lithium-salt-doped poly(ethylene oxide)[J]. Journal of the American Chemical Society, 2014, 136(22): 7833-7836.
[8] DomineyL A, Koch V R, Blakley T J. Thermally stable lithium salts for polymer electrolytes[J]Electrochimica Acta, 1992, 37(9): 1551-1554.
[9] Mandal B K, Padhi A K, Shi Z, et al. New low temperature electrolytes with thermal runaway inhibition for lithium-ion rechargeable batteries[J]. Journal of Power Sources, 2006, 162(1): 690-695.
[10] Plichta E J,Behl W K.A low-temperature electrolyte for lithium and lithium-ion batteries[J]. Journal of Power Sources, 2002, 88: 192-196.
[11] Wang C S,Appleby A J, Little F E.Irreversible capacities of graphite anode for lithium-ion batteries[J]. Journal of Electroanalytical Chemistry, 2002, 519: 9-17.
[12] Smart M C, RatnakumarB V, BeharA, et al. Gel polymer electrolyte lithium-ion cells with improved low temperature performance[J]. Journal of Power Sources, 2007, 165(2): 535-543.
[13] 肖利芬,艾新平,楊漢西,等.鋰離子電池用低溫電解質溶液研究[J].電池,2004,34(1): 10-12.
[14] HerreyreS,HuchetO,Barusseau S, et al.New Li-ion electrolytes for low temperature applications[J]. Journal of Power Sources, 2001, 97-98: 576-580.
[15] Wrodnigg G H, Wrodnigg T M, Besenhard J O, etal. Propylene sulfite as film-forming electrolyte additive in lithium ion batteries[J]. Electrochemistry Communications, 1999,1: 148-150.
[16] 王洪偉, 杜春雨, 王常波. 鋰離子電池的低溫性能研究[J]. 電池, 2009(4): 208-210.
[17] Xu K. Electrolytes and interphases in Li-ion batteries and beyond[J]. Chemical Review, 2014, 114(23): 11503-11618.
[18] Wagner R, Brox S, Kasnatscheew J,etal. Vinyl sulfones as SEI-forming additives in propylene carbonate based electrolytes for lithium-ion batteries[J]. Electrochemistry Communications, 2014, 40: 80-83.
[19] Aurbach D, Ein-Eli Y, Chusid O, etal. The correlation between the surface chemistry and the performance of Li-carbon intercalation anodes for rechargeable "rocking-chair" type batteries[J]. Journal of The Electrochemical Society, 1994, 141(3): 603-611.
Research and development on low-temperature electrolytes for Li-ion batteries
Qiao Xin1,Tao Yuanxue1,Zheng Ying2,Cui Changsheng1,Hu Qiwei1,Pei Bo1
(1. Wuhan Institute of Marine Electric Propulsion, Wuhan 430064, China; 2. China Ship Development and Design Center, Wuhan 430064, China)
TM912
A
1003-4862(2022)10-0092-06
2022-04-25
喬昕(1996-),男,助理工程師。研究方向:能源化學工程。E-mail:qiaoxin96115@163.com

