面向肺功能檢測的便攜式電阻抗成像系統開發
李芳,方海東,吳陽,高貴鋒,劉凱,姚佳烽
(1. 南京航空航天大學 機電學院,江蘇 南京 210016;2. 三江學院 機械與電氣工程學院,江蘇 南京 210012;3. 深圳市安保科技有限公司,廣東 深圳 518052)
0 引言
近年來,受肺部疾病影響的人數日益增加。新型冠狀病毒肺炎是一種具有嚴重傳染性的疾病,常伴有發熱、咳嗽、乏力、呼吸困難等臨床表現,近期在全球范圍內流行[1]。急性呼吸窘迫綜合征是一種潛在的致命性肺損傷,死亡率高達75%以上[2]。慢性阻塞性肺疾病是一種具有氣流受限特征的長期反復性疾病,具有患病人數多、死亡率高、社會經濟負擔重等特點,高居全球死亡原因的第四位[3]。而肺功能檢測能及時發現肺部的變化,因此,肺功能檢測對肺部疾病的診斷是必需的。
X光、CT、超聲等傳統成像手段雖能滿足臨床疾病診斷和評估的需要,但會對患者造成一定的傷害,而且無法做到實時監測,因此迫切需要一種便攜、無創、實時、無輻射的功能成像方法,對肺功能進行動態監測與評估,這對及時掌握患者的肺部狀況,調整呼吸康復方案具有重要的臨床意義。電阻抗成像技術(electrical impedance tomography, EIT)具有非侵入、無害、低成本等優點[4],能夠配合其他影像學成像技術檢測肺功能的變化,很好地滿足了上述需求。
國內外研究者針對肺功能檢測開發了不同的EIT系統。韓國首爾大學的AKHTARI-ZAVARE M等提出了一種可穿戴式的實時三維肺通氣監測電阻抗成像系統,能夠實現無線通信[5]。英國密德薩斯大學的BARDILL A等提出的穿戴式電阻抗成像系統,可同時進行肺功能和心率監測[6]。天津科技大學的陳曉艷等設計了一種能獲得清晰的肺呼吸過程圖像的電阻抗成像系統[7]。上海交通大學的WANG G X等提出一種基于頻分復用的電阻抗實時肺生理成像系統[8]。
上述EIT系統具有較高信噪比和成像速度,但人機交互部分和成像算法依賴PC平臺,設備體積大、操作復雜、功能冗余,限制了EIT系統在臨床、家庭健康監測等需要便攜式設備領域的發展。隨著嵌入式技術飛速發展,ARM系列處理器的運算速度已經與Intel媲美且具有豐富的外設接口。本文采用ARM+FPGA雙核架構,在ARM上運行嵌入式Linux系統,能在嵌入式系統上直接實現圖像重構算法,并通過LCD觸摸屏實現人機交互功能。
1 系統設計
1.1 系統硬件設計
本文提出的便攜式電阻抗成像系統框架如圖1所示,主要由4個模塊組成:ARM+FPGA最小系統、信號激勵電路、末端傳感器連接電路和信號采集電路。本系統首先由FPGA讀取存儲在ROM中的離散正弦數據,并通過DDS信號發生模塊傳輸到高速DAC芯片,接著通過采樣電阻將DAC輸出的電流信號轉化為電壓信號。該電壓信號經過增益可調的運放放大后,可以選擇兩種不同的激勵方式。電流激勵是將該電壓信號作為電壓控制恒流源的輸入,輸出的電流信號通過模擬多路復用電路傳輸到16電極傳感器陣列,注入到場域中。電壓激勵則直接作用。采集測得的信號先經過電壓跟隨器進行緩沖,再經過抗混疊濾波器濾除高頻噪聲以減少信號混疊,接著通過ADC驅動電路的ADC芯片進行高速采集,完成模數轉換。采集到的離散信號經快速傅里葉變換[9](fast fourier transformation, FFT),獲取幅值數據,通過SPI串行通信協議傳入ARM中的Linux系統進行圖像重構,實現一體化的EIT成像系統。
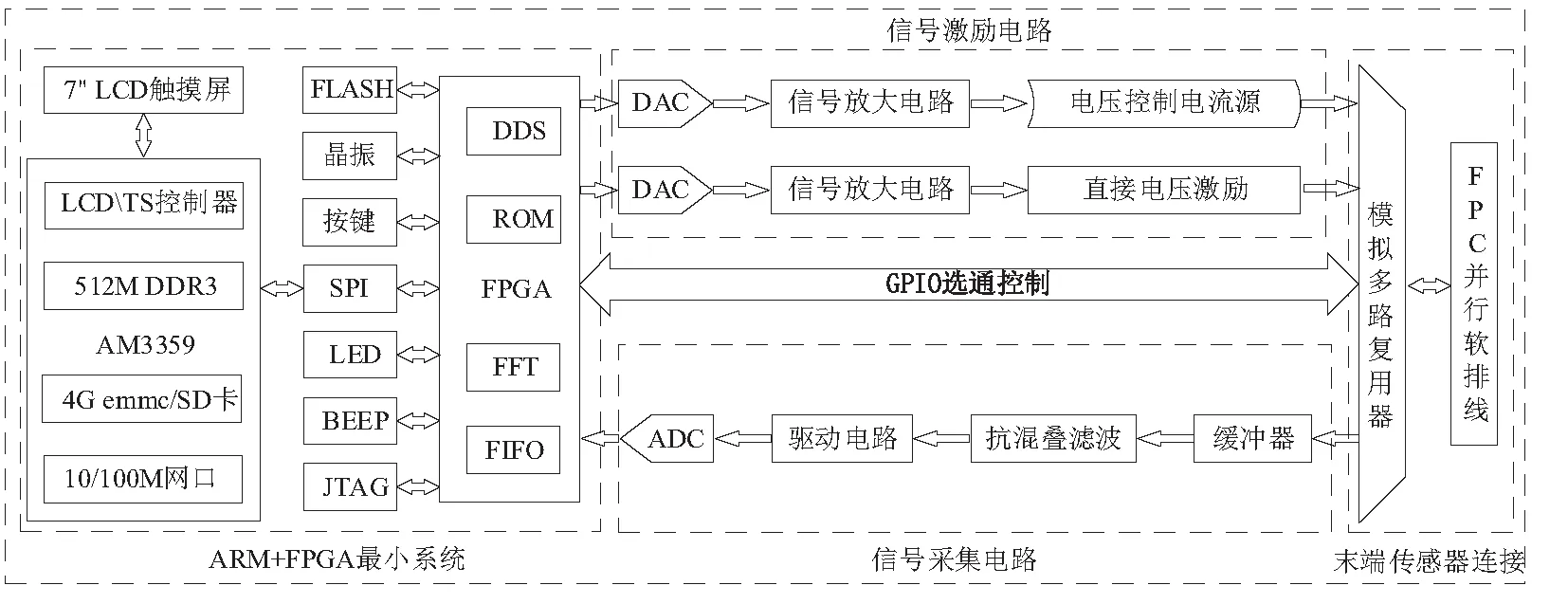
圖1 EIT系統硬件框架
1.2 系統軟件設計
本文提出的便攜式電阻抗成像系統的軟件設計基于FPGA和ARM雙核進行,主要可分為兩大部分。其中,FPGA驅動程序主要實現對底層外圍器件的邏輯控制和部分數據處理;ARM端則主要實現系統通信接口設計和界面程序設計,側重于脫離PC平臺的人機交互。軟件模塊的整體框架如圖2所示。
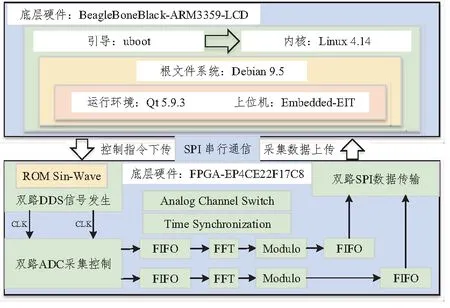
圖2 EIT系統軟件框架
1.3 圖像重構算法
本文采用的圖像重構算法是Tikhonov-Noser組合正則化(NR Tikhonov-Noser)算法[10]。該組合正則化方程如式(1)所示。
(1)
式中:J是正問題求解得到的雅可比矩陣;I是單位矩陣;λN是Noser算法的正則化參數;λT是Tikhonov算法的正則化參數;p是根據測量電壓計算得到的投影向量。該非迭代的圖像重構算法具有準確的計算結果、優越的抗噪聲能力和較小的計算量,適合應用在本文設計的電阻抗成像系統中。
2 實驗分析
本文開發的便攜式電阻抗成像系統實物圖如圖3所示。該系統在空間上可分為三層,頂層為LCD觸摸屏,中間層為基于FPGA的外圍電路,底層為插接的Beagle Bone Black最小系統板。本節主要針對該系統進行性能分析和圖像重建實驗。

圖3 便攜式電阻抗成像系統實驗平臺
2.1 性能分析
1)通道一致性測試
采用圖4所示標定板進行通道一致性測試。該標定板使用電阻網絡來模擬場域內的阻抗分布,電阻均采用0.1%精度的低溫漂電阻。

圖4 系統標定板電路原理圖及PCB板
將該標定板通過FPC軟排線接入到EIT系統中。實驗過程控制電壓為2 Vpp,頻率為100 kHz,重復測量20次,得到的U型圖如圖5(a)所示。
每次測量的208個數據所組成的16個U型曲線基本保持一致,說明該系統的通道一致性較好。
2)重復性和信噪比測試
為量化系統的重復性,引入相對標準差(RSD)表征系統的重復性,按式(2)給出的方法計算[11]。
(2)

信噪比(SNR)是系統中信號功率與噪聲功率的比值,也是EIT系統的常用性能指標,按式(3)計算。
(3)
計算結果如圖5(c)所示。可以看出:不同通道的信噪比存在一定差異,整體的信噪比集中在60 dB附近,最小值也>45 dB,最大值接近70 dB。

圖5 系統性能分析結果圖
2.2 實驗測試
1)水槽成像實驗
采用直徑為100 mm的圓形水槽和直徑為25 mm的橡膠棒進行水槽成像實驗。為了模擬生物組織,采用香蕉泥作為背景電介質。實驗過程中正弦激勵電流的控制電壓為2 Vpp,選取在頻率為1 kHz、10 kHz、100 kHz、500 kHz、1 MHz和1.5 MHz的條件下進行實驗。首先在僅放香蕉泥時收集參考數據,然后再放入橡膠棒分別進行單目標和雙目標實驗。使用TK組合正則化算法進行成像,選取傳統TK的懲罰項kt值為0.000 01,Noser項系數kn值為90,結果如圖6所示(0:電導率低;1:電導率高)。單目標實驗的成像結果在最低頻率時有非常理想的效果,而隨著頻率的增大,橡膠棒開始逐漸變形,在1 MHz以上時橡膠棒已經趨向于橢圓形。同時隨著頻率的升高,背景香蕉泥的電導率逐漸變大,顏色變為深紅色。雙目標實驗在1 kHz~500 kHz之間成像結果差異不大,在1 MHz以上時,橡膠棒同樣出現變形。

圖6 不同頻率下單目標和雙目標水槽實驗成像圖
為了量化EIT圖像重構的質量,更好地反映成像質量好壞,引入圖像誤差IME和圖像相關系數ICC進行評價[12],如式(4)和式(5)所示。
(4)
(5)

分別計算不同頻率下的單目標和雙目標水槽實驗成像圖對應的圖像誤差和圖像相關系數,結果如表1所示。單目標實驗IME最小為1.10,ICC最大為0.86。雙目標實驗IME最小為1.00,ICC最大為0.84。整體上在帶寬范圍內,所有目標物均能達到較好的成像效果。
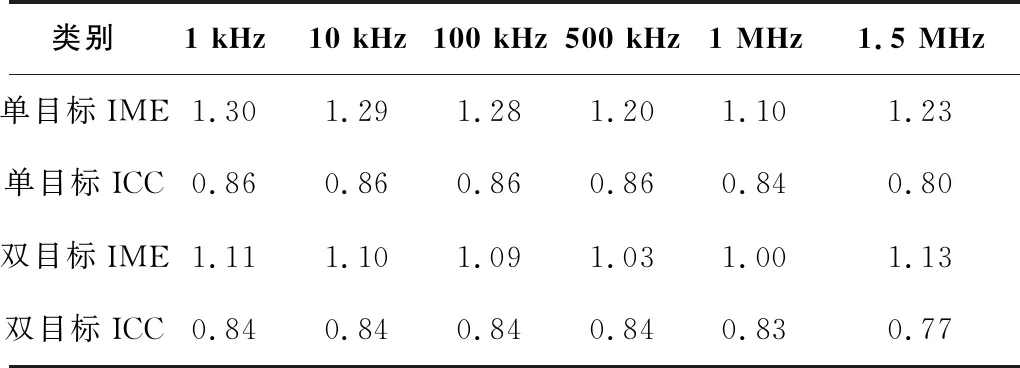
表1 圖像誤差和圖像相關系數結果
2)人體肺呼吸成像實驗
對22歲健康男性志愿者進行人體肺呼吸成像實驗。使用16電極柔性帶作為實驗末端傳感器,如圖7所示。將長40 mm、寬20 mm的矩形扣式醫用電極片通過按扣固定在柔性帶上,保證16電極之間間距均勻。順時針沿著保持坐姿的待測志愿者的第4-第5肋骨間水平粘貼預先處理好的柔性帶。粘貼之前需要使用醫用酒精擦拭皮膚與電極接觸位置,并在每個電極上均勻涂抹導電膏,以提高接觸性,保證信號采集質量。

圖7 柔性帶示意圖和實驗圖
實驗過程中采用幅值為1 mA、頻率為100 kHz的正弦激勵電流進行相鄰激勵、相鄰測量,選擇呼氣末狀態作為參考,測量連續呼吸過程。使用TK組合正則化算法進行成像實驗,結果如圖8所示(0:電導率低;1:電導率高)。該圖反映了一個完整的呼吸過程,先吸氣后呼氣,吸氣時肺部輪廓范圍內的顏色逐漸加深,而呼氣時顏色又重新變淺。這說明該EIT系統能夠實時清晰地監測到人體呼吸過程肺部面積從小到大再變小的過程,也反映出呼吸過程中肺部阻抗的動態變化,如圖9所示。吸氣時,隨著肺部吸入氣體的增加,肺部阻抗值增大;而呼氣時,隨著肺部氣體的減少,肺部阻抗值又重新減小(本刊黑白印刷,相關疑問可咨詢作者)。

圖8 呼吸過程肺成像結果圖
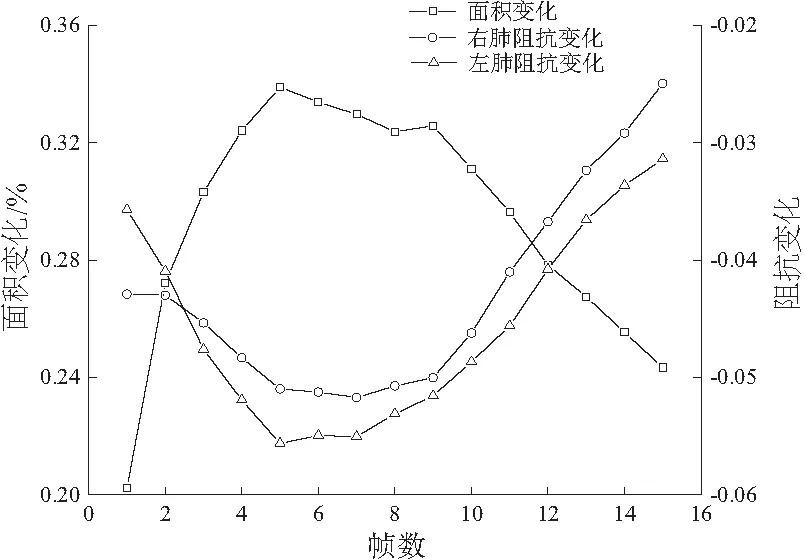
圖9 肺部面積與阻抗對應關系圖
3 結語
本文設計了一款面向肺功能檢測的便攜式電阻抗成像系統,擺脫了PC平臺的限制,采用ARM和FPGA雙核架構進行設計,能夠在LCD觸摸屏動態顯示成像結果,并進行人機交互。對系統硬件和軟件部分進行設計。使用標定板進行性能分析,證明該系統的通道一致性和重復性較好,整體的信噪比在60 dB左右。在水槽中分別進行單目標與多目標成像實驗,計算得到圖像誤差最小分別為1.10和1.00,圖像相關系數最大分別為0.86和0.84;人體肺呼吸成像實驗的結果表明:該系統能夠實時監測到人體呼吸過程肺部面積的變化,實現動態成像。

