利用菊花B病毒外殼蛋白特異片段進行多克隆抗體的制備與分析
王 瑋 杜雪潔 陳衛(wèi)良 陳正賢 毛碧增
(浙江大學生物技術研究所/農業(yè)農村部作物病蟲分子生物學重點實驗室/浙江省作物病蟲生物學重點實驗室,浙江 杭州 310058)
杭白菊(ChrysanthemummorifoliumRamat.)因具有散風清熱、平肝明目、清熱解毒等藥理作用深受人們的喜愛[1-3]。杭白菊生產中主要以扦插、分株等無性繁殖方式繁殖種苗,但該方法會使植物病毒隨著繁殖代數增加而積累,嚴重降低菊花的產量和品質。菊花B病毒(Chrysanthemum virus B,CVB)是危害最嚴重的病毒之一。菊花感染CVB后,輕癥表現為葉片斑駁,重癥表現為花朵畸形和重度花葉[4]。據報道,CVB在全球各地的菊花基地普遍存在,嚴重阻礙了菊花產業(yè)健康持續(xù)發(fā)展[5]。
CVB是乙型線狀病毒科(Betaflexiviridae)麝香石竹潛隱病毒屬(Carlavirus)的成員。其病毒粒子呈略彎曲線狀,長度為685 nm,直徑為12 nm,常分散于寄主組織的細胞質中。CVB病毒基因組長約8.8 kb,為正單鏈RNA[6-7]。病毒基因組包含6個開放閱讀框(open reading frame,ORF)。ORF5編碼的外殼蛋白(coat protein,CP)是該病毒編碼病毒外殼的唯一亞基,大小約為34 kDa[6,8-9]。CVB的鈍化溫度范圍為70~75℃[10]。
目前病毒的檢測方法有逆轉錄PCR(reverse transcription PCR, RT-PCR)、電鏡檢測法、血清檢測、環(huán)介導恒溫擴增法(loop-mediated isothermal amplification,LAMP)等[11],其中血清學檢測因其成本低、操作簡便等優(yōu)點受到廣泛的關注。血清學檢測所用抗體包括多克隆抗體(polyclonal antibody,PAb)和單克隆抗體(monoclonal antibody,MAb),但多克隆抗體可以識別多個表位,可能會導致高度交叉反應,造成其特異性較差,從而限制了其應用[12]。上世紀60年代,Hakkaart等[13]利用菊花B病毒粒子制備多克隆抗體,檢測發(fā)現制備的抗體無法有效區(qū)分菊花B病毒與馬鈴薯M病毒、香石竹潛隱病毒和馬鈴薯S病毒。Singh等[14]通過在大腸桿菌中表達CVB CP,制備多克隆抗體,但研究缺少特異性方面的相關分析。單克隆抗體針對單一抗原決定簇,特異性較好,但操作簡單復雜,對設備的要求較高[15-16]。
因此,本研究利用基因工程的方法表達特定的單一抗原決定簇,用多克隆抗體的制備方法獲得單克隆抗體的效果,從而簡便地獲得具有高特異性的抗體。具體思路為分析CVB CP的三維空間結構,根據其外露基團的氨基酸序列,設計相應的特異DNA序列片段,通過在大腸桿菌中表達融合蛋白,以此作為抗原,免疫新西蘭大白兔,對獲得的抗血清和純化后獲得的抗體進行效價、特異性等分析,旨在為CVB的田間快速檢測和科學防治提供技術支撐,也為今后利用多克隆抗體制備途徑獲得特異性抗體研究提供思路和借鑒。
1 材料與方法
1.1 材料與試劑
感染CVB的菊花葉片采自浙江桐鄉(xiāng)杭白菊生產基地。感染甘薯羽狀斑駁病毒(sweet potato feathery mottle virus,SPFMV)的甘薯葉片、感染馬鈴薯X病毒(potato virus X,PVX)的煙草葉片均保存于浙江大學生物技術研究所。
E.coliBL21(DE3)和DH5α感受態(tài)細胞,北京擎科生物;pET-28a表達載體,湖南優(yōu)寶生物;DNA Marker、T4連接酶,寶日醫(yī)生物(北京)有限公司;BamHI和XhoI限制性內切酶,美國Thermo fisher;HRP標記羊抗兔IgG,北京康為世紀;雙組份TMB顯色液,北京博奧森公司;ECL發(fā)光液,杭州弗德生物;Ni-NTA重力柱、Protein A親和層析柱,常州天地人和公司。
1.2 儀器與設備
imark酶標儀,美國Bio-rad公司;5424高速冷凍離心機,德國Eppendorf公司。
1.3 試驗方法
1.3.1CVBCP基因片段的選擇與合成 根據已報道的CVB CP序列(UniProt登錄號A0A3G5AWF4),本研究利用SWISS-MODEL(http://swissmodel.expasy.org/)分析CVB CP空間結構,選擇暴露在分子表面的基團,該基團由25個氨基酸組成,并根據大腸桿菌密碼子的偏愛性,優(yōu)化該基團的DNA序列。DNA合成時將選擇的75 bp的DNA序列片段重復4次,片段之間用10氨基酸長度的連接鏈(NH2- GGGGSGGGGS-COOH)串聯以提高柔性。序列兩端分別添加限制性內切酶BamHI(5′-GGATCC-3′)和XhoI(5′-CTCGAG-3′)的酶切位點。
1.3.2CVBCP基因片段表達載體的構建與克隆 將合成的目的DNA片段和pET-28a(+)質粒用限制性內切酶BamHI和XhoI雙酶切,經1%瓊脂糖凝膠電泳檢測后通過DNA回收試劑盒純化[寶日醫(yī)生物(北京)],使用T4連接酶,16℃條件下連接5 h。連接產物轉化E.coliDH5α,涂布于含有卡那霉素的溶菌肉湯(Luria-Bertani,LB)固體培養(yǎng)基,然后挑選單克隆進行雙酶切驗證。將經驗證的重組質粒命名為pET-28a-CVB。將構建的重組質粒pET-28a-CVB轉入BL21(DE3)感受態(tài)細胞中,獲得陽性克隆。
1.3.3 陽性克隆的表達及SDS-PAGE檢測 將陽性克隆按1%(V/V)比例接種至含有卡那霉素的LB培養(yǎng)基中,37℃、150 r·min-1條件下震蕩培養(yǎng)至OD600值為0.4~0.6,加入異丙基硫代半乳糖苷(Isopropyl-β-D-Thiogalactoside,IPTG)至終濃度1 mmol·L-1,于37℃、200 r·min-1條件下繼續(xù)培養(yǎng)4 h,以不加IPTG為對照。培養(yǎng)后,菌液于12 000 r·min-1下離心10 min,棄上清。所得菌體用超聲破碎法裂解,12 000 r·min-1下離心10 min,所得上清液即為提取粗提液。取8 μL粗提液加入2 μL 5 × Loading Buffer沸水煮沸10 min,進行聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel,SDS-PAGE)分析。
1.3.4 表達蛋白的提取與純化 根據操作指南利用Ni-NTA重力柱純化粗提液獲得目的蛋白,通過SDS-PAGE分析其純度。
1.3.5 抗血清的制備和效價分析 用純化的表達蛋白(1 mg·mL-1)作為免疫原免疫新西蘭大白兔制備多克隆抗體。具體方法如下:將1 mg純化蛋白和完全佐劑(初次免疫)或不完全佐劑(增強免疫)等量混合均勻,進行皮下多點注射,每點為0.2 mL,共進行4次免疫,首免后第14天進行二免,二免到四免間隔時間為7 d。7 d后采集全血,分離得到抗血清。取1 μg純化的表達蛋白為抗原,抗血清按4倍梯度從1∶500稀釋至1∶2 048 000,間接酶聯免疫(enzyme linked immunosorbent assay,ELISA)法測定抗血清的效價[17]。
1.3.6 抗體的制備和蛋白免疫印跡法(western blot, WB)檢測 用Protein A親和層析柱純化兔抗血清,從而獲得兔抗CVB多克隆抗體IgG。以純化抗體(1∶1 000 稀釋)為一抗,以辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗兔為二抗,進行抗體B檢測[18]。
1.3.7 CVB CP多克隆抗體的特異性檢測 稱取0.1~0.2 g健康和感染CVB的菊花葉片、感染SPFMV的甘薯葉片、感染PVX的煙草葉片,加入液氮研磨,提取總蛋白。蛋白樣品經煮沸變性后進行SDS-PAGE電泳。采用濕轉法將膠中蛋白轉至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(美國Millipore公司)上,然后將膜浸沒在5%脫脂牛奶中,4℃條件下過夜封閉。以制備的CVB CP多克隆抗體作為一抗(1∶1 000), HRP標記的羊抗兔IgG作為二抗(1∶5 000), 通過增強化學發(fā)光(enhanced chemi luminescence,ECL)顯色試劑盒(杭州弗德生物)按說明書顯色。
2 結果與分析
2.1 CVB CP片段的選擇與合成
利用SWISS-MODEL分析,獲得CVB CP空間結構,根據親水性和二級結構域選擇了一個裸露在外由25個氨基酸(L N K A Y N N D T F G N F D S A I T G G R Q G PA)組成的基團(圖1)。根據大腸桿菌密碼子的偏愛性,對25個氨基酸基團對應的75 bp DNA序列進行優(yōu)化,通過連接鏈(NH2-G G G G S G G G GS-COOH)串聯的方法將4段75 bp 的DNA序列片段進行組合,兩端添加限制性內切酶酶切位點,序列見圖2,委托杭州華安公司合成。
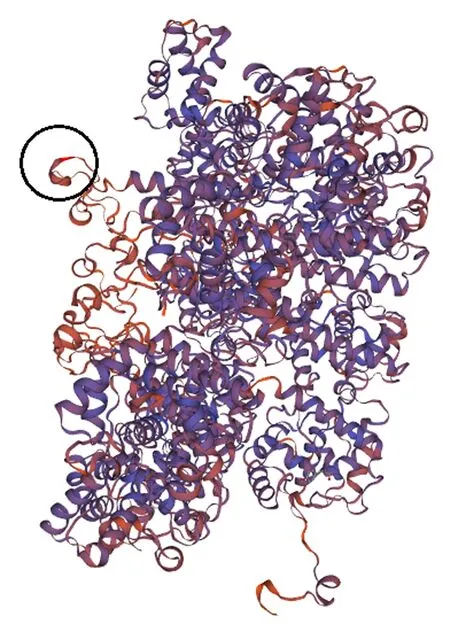
注:圓圈所示為選擇的基團。Note: Circle indicates the chosen group.圖1 CVB CP的三級結構以及選擇基團Fig.1 Tertiary structure of CVB CP and the chosen group
2.2 CP片段表達載體的構建與鑒定
將目的片段和pET-28a(+)質粒用限制性內切酶BamHI和XhoI雙酶切,回收后用T4連接酶連接。連接產物轉化E.coliDH5α,涂布于含有卡那霉素的LB固體培養(yǎng)基,然后挑選單克隆提取質粒。用BamHI和XhoI雙酶切重組質粒,獲得402 bp大小的預期目的片段(圖3),表明原核表達載體構建成功,將經過驗證的重組質粒命名為pET-28a-CVB。
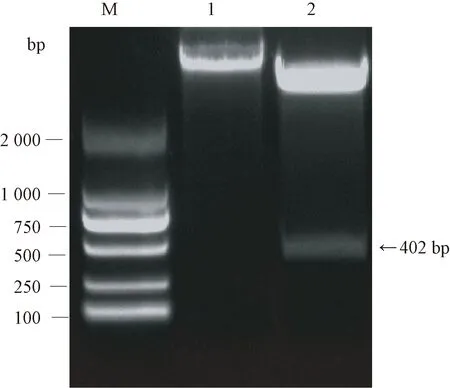
注:M:DNA Marker;1:未經酶切的pET-28a-CVB質粒;2:雙酶切后的 pET-28a-CVB質粒。Note: M: DNA Marker. 1: Recombinant plasmid pET-28a-CVB without enzyme digestion. 2: Double enzyme digestion of recombinant plasmid pET-28a-CVB.圖3 pET-28a-CVB的雙酶切驗證Fig.3 Identification of recombinant plasmid pET-28a-CVB by double enzyme digestion
2.3 重組蛋白的原核表達
將pET-28a-CVB質粒轉化大腸桿菌菌株E.coliBL21(DE3),在37℃條件下LB中震蕩培養(yǎng)至OD600值為0.4~0.6時,加入IPIG至終濃度為1 mmol·L-1,繼續(xù)培養(yǎng)4 h,收集菌體進行SDS-PAGE電泳。在IPTG誘導下,發(fā)現在14 kDa左右位置有一條特異性蛋白條帶,表明目的蛋白表達成功(圖4)。
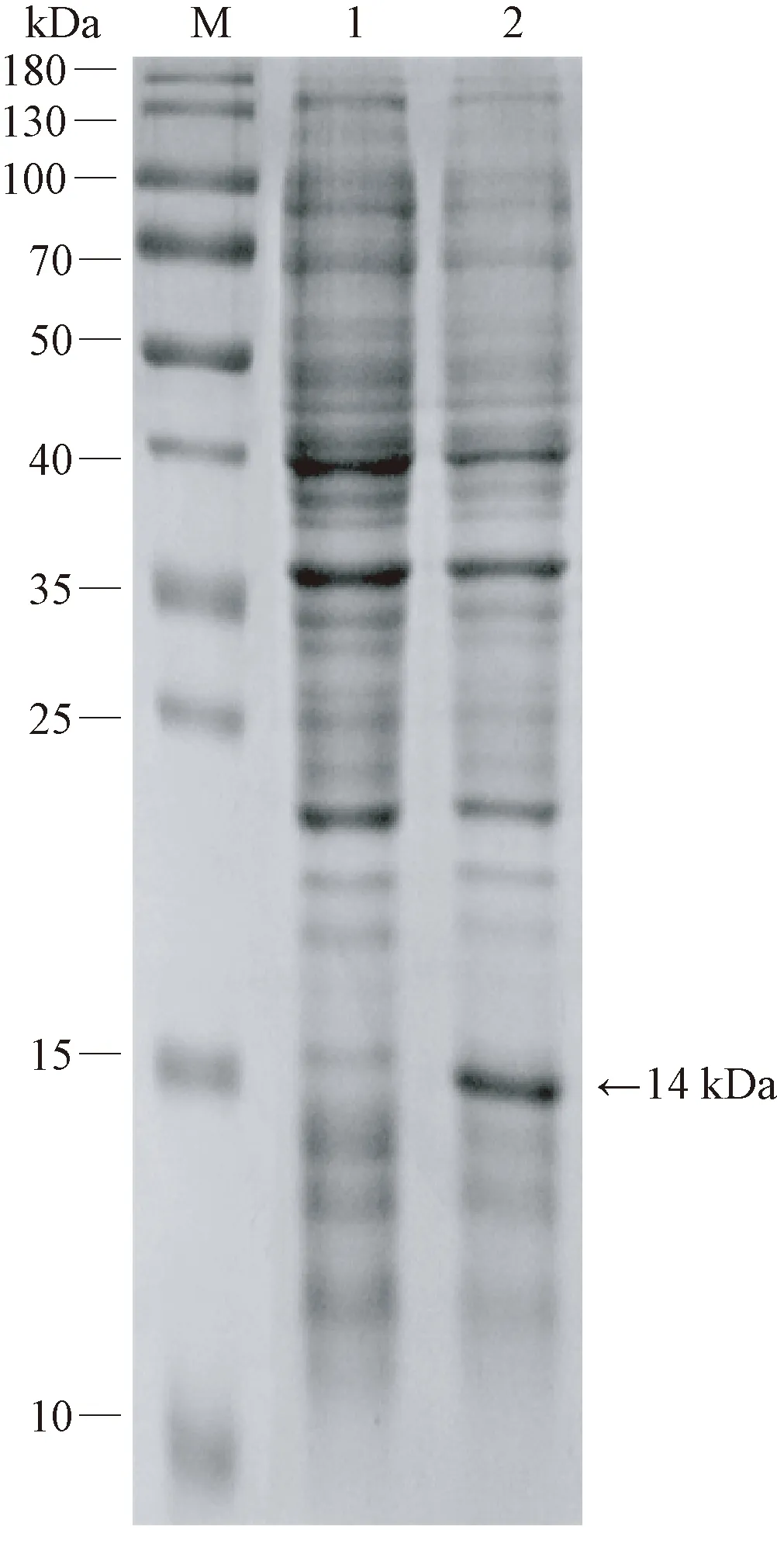
注:M:蛋白Marker;1:未經IPTG誘導;2:經1 mmol·L-1IPTG誘導。Note: M: Protein Marker. 1: Induced without IPTG. 2: Induced by 1 mmol·L-1 IPTG.圖4 重組蛋白的原核表達Fig.4 Prokaryotic expression of recombinant protein
2.4 重組蛋白的純化
用鎳離子親和層析柱進行純化后得到了高純度的表達蛋白,發(fā)現在14 kDa左右位置有特異性蛋白條帶,表明目的蛋白純化成功(圖5)。

注:M:蛋白 Marker;1:純化后的重組蛋白。Note: M: Protein Marker. 1: Purified recombinant protein. 圖5 重組蛋白的純化Fig.5 Purification of recombinant protein
2.5 抗血清效價分析
以純化的表達蛋白為抗原,免疫新西蘭白兔獲得抗血清。抗血清梯度稀釋后,進行間接ELISA檢測,所用抗原為1 μg純化的表達蛋白。使用酶標儀讀取450 nm處的OD值(表1),以N表示陰性血清的OD平均值,以P代表陽性樣品的OD平均值,若P/N>2.0,則視為陽性,否則為陰性[17]。結果表明,抗血清經512 000倍稀釋,仍能檢測到1 μg抗原。

表1 不同稀釋倍數下的OD450值Table 1 Determination of OD450 value at different dilution times
2.6 抗體的制備和WB檢測
抗血清用Protein A親和純化后,得到濃縮后的抗體IgG,濃度為15.0 mg·mL-1。
分別取10、5、1、0.5 ng抗原,將獲得的抗體進行 1∶1 000 稀釋,并進行WB檢測,結果如圖6。結果表明,0.5~10 ng的抗原均檢測到特異性條帶,說明制備的CVB CP片段多克隆抗體具有較高的檢測敏感度。
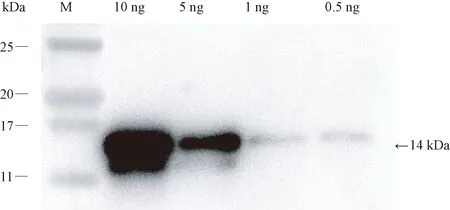
圖6 抗體的WB檢測Fig.6 Antibody detection by WB
2.7 多克隆抗體對植株病毒的特異性檢測
分別提取0.1~0.2 g健康菊花葉片、感染CVB的菊花葉片、感染SPFMV的甘薯葉片、感染PVX的煙草葉片的總蛋白,進行SDS-PAGE電泳和轉膜,以 1∶1 000 比例稀釋的純化好的抗體為一抗,進行WB檢測。結果發(fā)現,抗體與感染CVB的菊花樣品在預期大小位置處發(fā)生特異性反應,而與健康菊花樣品、感染SPFMV的甘薯樣品和PVX的煙草樣品無交叉反應,表明抗體能夠特異性結合CVB CP,具有良好的特異性(圖7)。
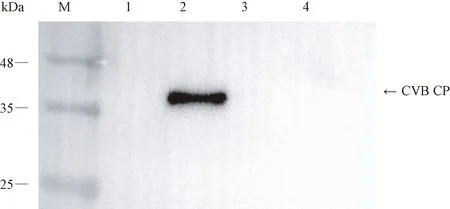
注:M:蛋白Marker;1:健康菊花;2:感染CVB的菊花;3:感染SPFMV的甘薯;4:感染PVX的煙草。Note: M: Protein Marker. 1: Healthy chrysanthemum. 2: Chrysanthemum infected with CVB. 3: Ipomoea batatas Lam infected with SPFMV. 4: Nicotiana benthamiana infected with PVX.圖7 兔多克隆抗體對植株病毒的WB檢測Fig.7 WB of plant viruses using rabbit polyclonal antibody
3 討論
至今已知侵染菊花的病毒達20多種。目前我國已報道存在的菊花病毒病有12種[19-24]。其中CVB是浙江省桐鄉(xiāng)基地中最常見的病毒,給當地杭白菊產業(yè)帶來了極大的危害。快速特異性檢測CVB在生產上具有重要意義。其中血清學檢測因其具有操作簡便、成本低等優(yōu)點,如今已在病毒檢測方面得到了廣泛的應用。病毒的CP參與了侵染寄主的過程[25],同時也常作為植物病毒血清學檢測的靶位,如香蕉條紋病毒(banana streak virus,BSV)、辣椒輕度斑駁病毒(pepper mild mottle virus,PMMoV)、馬鈴薯卷葉病毒(potato leafroll virus,PLRV),洋蔥黃矮病毒(onion yellow dwarf virus,OYDV)等[26-29]。但傳統(tǒng)方式制備的多克隆抗體,因其可以識別多個抗原決定簇,導致其特異性較差。目前鮮見針對CVB CP單一抗原決定簇制備抗體的報道。
相比多克隆抗體,單克隆抗體的優(yōu)點在于特異性高、生物活性完全相同、理化性狀一致、產量高、重復性強等,但其生產周期長、成本高、對技術要求高[30]。本研究利用基因克隆和基因表達的方法獲得特定的單一抗原決定簇,用多克隆抗體的制備方法獲得相應的CVB抗體,從,結果看該途徑制備成本較低,獲得的抗血清具有很高的效價(達到1∶512 000)、特異性強,由此可見本研究的研制途徑是科學合理的,可為今后類似研究提供思路和借鑒。由于實際生產中,菊花中病毒濃度較低,傳統(tǒng)純化病毒的方法很難獲得足量抗原,所以利用分子生物學技術在大腸桿菌中過表達目的蛋白,從而獲得大量高純度抗原的方法得到人們的青睞[31]。
SWISS-MODEL是全球第一個可用于蛋白質同源建模的全自動服務器,其在生成模型響應時間、結合位點和四維結構預測的模型質量以及可信度方面都表現出色,已成為應用最普遍的建模服務平臺之一[32-33]。在SWISS MODEL中輸入CVB CP氨基酸序列后,獲得的三維結構包括一段21個氨基酸組成的外露基團,構成了相對完整的二級結構,同時該片段具有親水性,因親水性片段容易形成抗原識別位點,推斷其具有較好的免疫原性。為了保護抗原決定簇的穩(wěn)定性,選擇片段時在外露基團左右二側各增加2個氨基酸序列,最終組成了含25個氨基酸的序列;為了提高抗原的免疫原性,將4個設計的氨基酸序列組合;為了保證融合蛋白的穩(wěn)定性及生物活性,在片段之間添加了由甘氨酸和絲氨酸殘基伸展組成的柔性連接肽(GGGGSGGGGS)[34]。同時結合大腸桿菌密碼子的偏愛性,設計了相應的DNA序列。結果表明,本研究制備的抗體具有高效價且可以與CVB CP特異性結合,證明該設計是合理、可行、經濟的。
4 結論
本研究根據SWISS-MODEL分析CVB CP空間結構,選擇暴露在外的片段進行DNA序列的優(yōu)化與合成,連接到表達載體pET-28a(+),在大腸桿菌BL21(DE3)工程菌株中獲得了理想的表達,并通過鎳離子親和層析柱獲得了高純度的表達蛋白,進而制備了特異性多克隆抗體。ELISA和WB分析表明,本研究所制備的抗血清具有高效價且純化獲得的抗體能特異結合天然病毒蛋白,可用于檢測植物材料中的CVB。

