水稻葉早衰突變體es33的鑒定和基因定位
郭鏵艷 葉勝海 翟榮榮 朱國富 俞法明 巫明明 葉 靖 張小明, *
(1 浙江師范大學生命科學學院,浙江 金華 321004;2 浙江省農業科學院作物與核技術利用研究所,浙江 杭州 310021)
葉片是植物進行光合作用的主要器官。水稻生長和發育過程中由葉片提供能量和營養,其過早衰老會直接影響植株的光合作用和呼吸作用。早期葉片衰老情況下,葉綠體破壞,葉綠素降解,光合色素含量急劇降低導致葉片顏色從綠色變為黃色、棕色和枯萎[1],有的出現衰老斑點;衰老的同時伴隨著其他細胞器的解體[2],水解酶活性升高、數量增多,加劇水解反應,導致可溶性蛋白含量降低[3]、rRNA和tRNA的合成減少[4],細胞內活性氧清除系統功能紊亂導致大量的活性氧[5]、自由基和丙二醛等有害物質積累,導致細胞膜被破壞,加劇衰老[6]。抽穗期水稻籽粒灌漿的營養物質主要來源于葉片的光合作用,水稻葉片早衰導致光合作用和呼吸作用下降,葉片功能期縮短,嚴重影響籽粒發育[7-8],導致產量與品質下降[9-11]。
水稻葉片提前進入衰老狀態即葉片早衰突變,為研究早衰及抗衰提供了豐富的材料和理論基礎。葉片早衰突變體分為葉片黃化、白化、有斑點等幾大類[12]。水稻葉片早衰多由一對隱性核基因控制,根據基因的功能將其分為葉綠素合成與降解途徑相關基因(OsSRLK[13]、OsPSE1[14]和OsPAO[15]等)、葉綠體發育相關基因(YPD1[16]、ELL1[17]、WGL5[18]、WLS5[19]、RLS3[20]和RLS1[21]等)、光合系統相關基因(PSL50[22])、蛋白質合成、降解及轉運途徑相關基因(SPL7[23]、SPL28[24]、ESL1[25]和LPS1[26]等)、細胞衰老凋亡相關基因(ES2[18]、OsNAP[27]和OsLED[6]等)、調控植物激素相關基因(LLB[28]、YL3[29]和OsDOS[30]等)、其他途徑相關基因(PLS5[31]等)。其中OsSRLK基因通過參與激素介導通路降解葉綠素,在水稻葉片衰老過程中起重要作用;OsPSE1基因突變導致葉綠素缺失,葉片黃化枯死;OsPAO和OsRCCR1基因分別編碼一個脫鎂葉綠素加氧酶和紅色葉綠素代謝產物還原酶,這兩種酶是葉綠素降解途徑中的關鍵酶,在葉片衰老過程中酶活性顯著上調;YPD1基因調控葉綠體發育,基因突變導致植株分蘗期葉片早衰,細胞內活性氧積累,光合色素水平較低,葉綠體異常;ELL1基因參與葉綠體發育進程,基因突變導致植株葉綠體降解,葉片中H2O2和胼胝質積累,DNA降解嚴重、細胞異常死亡;WGL5基因編碼的蛋白是一個1-脫氧-D-木酮糖-5-磷酸合酶,該酶主要作用在卡爾文循環中,對植物光合作用影響較大,WGL5基因突變導致葉綠體異常發育,導致植株早期白化;PSL50基因通過調控光合系統的穩定以及光合脅適性,在水稻葉片衰老和熱脅迫響應中起雙重調控作用;SPL7基因編碼一種熱脅迫轉錄因子,對還原型輔酶Ⅱ(nicotinamide adenine dinucleodite phosphate, NADPH)氧化酶有調節作用,對蛋白去磷酸化的信號傳導通路有調控作用;ESL1基因編碼黃嘌呤脫氫酶,通過調節尿素的含量影響植物的生長發育;LPS1是一種泛素結合酶,參與ABA的代謝途徑;ES2基因編碼肌醇多磷酸激酶OsIPK2,調控細胞凋亡,控制葉片衰老;OsNAP基因通過茉莉酸通路實現對葉片衰老的調控;LLB基因直接或間接抑制茉莉酸和油菜素內酯介導的反應,影響水稻的防衛反應和生長應答,調控水稻葉片的衰老;YL3基因編碼轉錄因子OsNAC109,直接調控衰老和激素相關基因的轉錄,影響內源激素水平,影響衰老進程;OsDOS基因通過參與茉莉酸甲酯和細胞分裂素調控過程,從而調控葉片早衰;PLS5基因通過調控淀粉合成代謝途徑調控葉片淀粉積累。目前已經克隆的水稻葉片早衰基因用來研究高產優質稻米仍不夠,還需要深入了解葉片早衰基因的調控機制,為培育出抗早衰水稻新品種提供材料。
早衰突變體es33是由常規單季晚粳稻浙粳99經過甲基磺酸乙酯(ethyl methane sulfonate,EMS)化學誘變而來,在杭州和海南試驗基地進行多代種植,受環境影響小、突變性狀穩定,突變體從播種后第10天開始出現早衰表型,第2和第3葉的葉尖干枯變白,衰老持續到成熟期。本試驗對早衰突變體es33(earlysenescence33)的衰老進程、衰老指標進行鑒定,并定位早衰基因ES33以及后續基因功能研究,旨在為培育抗早衰新品種提供參考。
1 材料與方法
1.1 試驗材料
浙江省農業科學院作物與核技術利用研究所和浙江勿忘農種業股份有限公司選育的常規單季晚粳稻浙粳99經過化學試劑EMS處理誘變得到早衰突變體es33,在海南和杭州經過連續多代種植,使早衰性狀穩定遺傳。2019年7月在浙江省農業科學院海寧基地以es33為母本,分別與野生型浙粳99、秈稻明恢86雜交得到F1種子;將F1種子播種于浙江省農業科學院海南陵水南繁育種基地,F1自交,2020年4月得到F2種子,同年5月于浙江海寧基地播種F2種子,得到F2遺傳群體和定位群體。
1.2 早衰表型分析和成熟期農藝性狀的調查
1.2.1 早衰表型分析 取適量飽滿的突變體es33和野生型浙粳99的種子分別放于牛皮紙種子袋中,置于裝滿清水的發芽盒常溫下浸泡48 h,催芽48 h后播種于大田,播種后每天上午10:00左右到稻田隨機觀察并記錄突變體es33和浙粳99的生長情況,觀察期為一個月,記錄突變體es33早衰開始時間,并拍照。
1.2.2 農藝性狀的調查 于成熟期隨機選取突變體es33和野生型浙粳99植株各10株,分別測量株高、穗長、粒長和粒寬,調查單株分蘗數、每穗粒數和每穗實粒數,計算結實率,稱取千粒重,共10次重復,記錄并用SPSS 22軟件分析數據,分析突變體與野生型之間的差異。
1.3 光合色素含量和葉綠素熒光動力學參數的測定
1.3.1 光合色素含量的測定 苗期、分蘗初期和分蘗盛期,上午10:00在大田取突變體es33和浙粳99植株各3株,取相同部位的葉片0.1 g,剪成2 mm×2 mm左右的小片置于14 mL的離心管中,加入10 mL 95% 的乙醇,避光條件下置于4℃冰箱中浸提48 h,8 000×g高速離心5 min,UV-2550紫外可見分光光度計(日本島津)分別測量665、649和470 nm 3個波長處上清液的吸光度值,3次重復,利用Lichtenthaler[32]修正的公式計算葉片單位鮮重葉綠素a(chlorophyll a, Chla)、葉綠素b(chlorophyll b, Chlb)、類胡蘿卜素(carotenoid, Car)含量,取平均值:
Chla含量=(13.95×OD665-6.88×OD649)V/1 000W
(1)
Chlb含量=(24.96×OD649-7.32×OD665)V/1 000W
(2)
Car含量=(1 000×OD470+811.74×OD665-2 851.32×OD649)/245
(3)。
Chla含量、Chlb含量和Car含量單位為mg·g-1。V為葉綠素提取液總體積,mL;W為葉片鮮重,g。
1.3.2 葉綠素熒光動力學參數的測定 從大田取分蘗盛期突變體es33和野生型浙粳99植株各3株,黑暗處理20 min,使用PAM-2500 Imaging 葉綠素熒光快速成像儀(德國Walz)和Imaging win軟件處理和分析葉綠素熒光各項參數并成像,將待測植株相同部位的葉片放在儀器的鏡頭下,測定PSII最大能轉化效率(maximum photochemical,Fv/Fm)、光損傷程度Y(NO)值并成像,3次重復。
1.4 葉綠體超微結構的觀察和光合指標的測定
1.4.1 葉綠體超微結構的觀察 大田環境下突變體es33葉片出現早衰表型時,分別取突變體es33和野生型浙粳99相同部位的葉片,用手術刀切成2 mm×2 mm的小片,浸入2.5%戊二醛溶液,抽真空固定,4℃過夜;用0.1 mol·L-1的磷酸緩沖液(pH值7)漂洗樣品3次,每次15 min;用1%鋨酸溶液固定1~2 h后;經過0.1 mol·L-1的磷酸緩沖液(phosphate buffered saline, PBS)漂洗3次,依次用梯度濃度(30%、50%、70%、80%)的酒精脫水,每個濃度處理15 min后過渡到90%和95%丙酮溶液中脫水,分別處理15 min,最后用純丙酮處理2次,每次20 min。用同等體積Spurr包埋劑與丙酮混合液處理1 h,再用Spurr包埋劑與3倍體積丙酮混合液處理3 h。用純包埋劑Spurr處理樣品過夜。將經過滲透處理過的樣品包埋,70℃加熱過夜,使用EM UC7超薄切片機切片(德國徠卡)(每片70~90 nm),檸檬酸鉛溶液和醋酸雙氧鈾50%乙醇飽和溶液雙重染色10 min 后干燥過夜,用H-7650透射電子顯微鏡(日本日立)觀察葉綠體超微結構,采集圖像。
1.4.2 光合指標的測定 于分蘗盛期,選擇天氣晴朗、光合作用穩定的上午10:00,在田間用LI-6400XT便攜式光合作用測量系統(美國Li-COR)分別測定突變體es33和野生型浙粳99植株相同部位葉片的凈光合速率(μmol CO2·m-2·s-1)、氣孔導度(mmol·m-2·s-1)、胞間CO2濃度(μmol·mol-1)和蒸騰速率(g·(m-2·h-1),5次重復,取平均值,用SPSS 22軟件獨立樣本T檢驗分析數據。
1.5 早衰生理指標測定
分蘗盛期,大田中分別取3株突變體es33和野生型浙粳99相同部位的葉片,迅速放入液氮中,用生物檢測試劑盒(蘇州格銳思生物科技有限公司)分別測定鮮重0.1 g葉片中丙二醛(malonaldehyde,MDA)含量、過氧化氫(hydrogen peroxide,H2O2)含量、過氧化氫酶(catalase,CAT)活性、過氧化物酶(peroxidase,POD)活性、超氧化物歧化酶(superoxide dismutase,SOD)活性、超氧陰離子(superoxide anion,OFR)含量和超氧陰離子產生速率,3次重復,取平均值。
1.6 遺傳分析和基因定位
1.6.1 遺傳分析 以野生型浙粳99為母本,與穩定遺傳的早衰突變體es33雜交獲得F1種子,F1植株自交得到F2種子;播種F2種子,構建遺傳群體,觀察并統計F1和F2植株表型性狀分離情況,并進行遺傳分析。
1.6.2 基因定位 以穩定遺傳的早衰突變體es33為母本,以秈稻明恢86為父本,雜交獲得F1種子,F1植株自交得到F2種子;后播種F2種子,構建F2基因定位群體。
從F2定位群體中選擇570株具有早衰突變表型的單株作為定位植株,用CTAB法[33]分別提取母本、父本和F2早衰植株葉片DNA;根據浙江省農業科學院作物與核技術利用研究所常規稻實驗室己有的均勻分布在水稻12條染色體上174對簡單重復序列(simple sequence repeat, SSR)分子標記,通過PCR擴增和聚丙烯酰胺凝膠電泳,用10個早衰單株進行多態篩選和初步定位,確定葉片早衰基因ES33定位區間,之后在RiceVarMap(http://ricevarmap.ncpgr.cn/)設計Indel引物,用560個早衰單株進行精細定位。其中PCR擴增體系總計10 μL:2 × Taq master mix酶5 μL、目的DNA 1 μL、正、反向引物各1 μL、ddH2O 2 μL。PCR擴增程序為:95℃預變性5 min,94℃變性1 min,56℃退火45 s,72℃延伸1 min,32個循環;72℃延伸6 min,產物于4℃條件下保存。
1.7 基因重測序、候選基因的分析及尿酸含量的測定
1.7.1 基因重測序 在精細定位的基礎上,取早衰突變體es33苗期葉片,由北京諾禾致源生物信息科技有限公司完成基因ES33的重測序工作。
1.7.2 候選基因的分析 在利用分子標記和基因組重測序的基礎上,篩選到候選基因,設計候選基因突變位點測序引物(見附表1),在野生型浙粳99和早衰突變體es33之間進行PCR擴增和測序驗證。引物合成和測序工作由杭州擎科生物技術有限公司完成。
1.7.3 尿酸含量的測定 分蘗盛期,分別取3株突變體es33和野生型浙粳99相同部位的葉片,放入液氮中,用Grace尿酸含量生物檢測試劑盒測定鮮重0.1 g葉片中尿酸含量,3次重復。
1.8 基因突變位點氨基酸序列比對分析和同源性分析
在NCBI(https://www.ncbi.nlm.nih.gov/)網站上獲取不同物種的ES33基因cDNA序列及蛋白質黃嘌呤脫氫酶(XANTHINE DEHYDROGENASE,XDH)氨基酸序列,篩選出與水稻同源性較高的22個物種的氨基酸序列,用MEGA 7.0進行序列比對,構建系統發育樹。
2 結果與分析
2.1 早衰突變體es33的表型特征及農藝性狀分析
與野生型相比,葉片早衰突變體es33在播種后第10天出現早衰表型,第2和第3葉的葉尖干枯,到第28天除了新葉,其他葉片的葉尖均出現干枯現象(圖1),成熟后,對突變體和野生型進行農藝性狀統計分析,結果顯示,與野生型(WT)浙粳99相比,突變體es33的株高、單株分蘗、穗長、每穗粒數、每穗實粒數、結實率和千粒重都極顯著降低,粒寬顯著降低,而粒長無顯著差異(表1)。成熟期突變體es33植株整株葉片基本干枯,穗明顯比沂粳99短小(圖2)。

注:A、B、C、D分別是播種后第10、第14、第21和第28天野生型浙粳99和早衰突變體es33的表型。Note: A, B, C and D are the phenotypes of Zhejing 99 and early senescence mutant es33 at the 10th, 14th, 21th and 28th days after sowing.圖1 早衰突變體es33和浙粳99苗期表型Fig.1 Seedling phenotypes of early senescence mutant es33 and Zhejing 99

表1 早衰突變體es33和浙粳99的農藝性狀Table 1 Agronomic traits of early senescence mutant es33 and Zhejing 99

注:A:成熟期株型對比;B:成熟期葉形對比;C:成熟期穗型對比;D:成熟期粒型對比。Note: A: Comparison of plant type at maturity. B: Comparison of leaf shape at maturity. C: Comparison of panicle type at maturity. D: Comparison of grain shape at maturity.圖2 早衰突變體es33和浙粳99成熟期表型Fig.2 Maturity phenotypes of early senescence mutant es33 and Zhejing 99
2.2 早衰突變體es33光合色素含量和葉綠素動力學參數分析
2.2.1 光合色素含量變化分析 為了確定早衰突變體es33葉尖干枯表型是否由光合色素含量變化導致,測定了大田環境下生長的野生型浙粳99和早衰突變體es33在苗期、分蘗初期和分蘗盛期時相同部位葉片光合色素含量。結果顯示(圖3),早衰突變體es33在苗期,即早衰表型出現時期,葉綠素a和葉綠素b的含量分別顯著低于野生型18%和37%,類胡蘿卜素的含量無明顯變化,表明早衰突變體es33的葉尖早衰退綠表型主要由葉綠素a和葉綠素b含量下降所致;類胡蘿卜素的含量無明顯下降,導致葉尖發黃。分蘗初期,早衰突變體es33的葉綠素a、葉綠素b和類胡蘿卜素含量分別顯著低于野生型26%、9%和26%,差異均達極顯著水平。分蘗盛期,早衰突變體es33的葉綠素a、葉綠素b和類胡蘿卜素含量分別顯著低于野生型43%、48%和34%。上述結果表明,從苗期開始,突變體es33伴隨著光合色素含量的下降,以及隨著生長進程的推進,早衰逐漸嚴重,光合色素含量下降程度逐漸加大,由此推測突變體es33葉尖早衰表型與光合色素含量下降有關。

圖3 早衰突變體es33和浙粳99不同生長時期光合色素含量Fig.3 Photosynthetic pigment contents of early senescence mutant es33 and Zhejing 99 at different growth stages
2.2.2 葉綠素熒光動力學參數分析 在光合色素含量顯著下降的基礎上,為了比較野生型浙粳99與早衰突變體es33葉片之間光合效率的差異,在分蘗盛期對突變體和野生型進行了葉綠素熒光動力學參數的測定。其中Fv/Fm是最大光化學量子產量,亦稱最大PSII的光能轉換效率,Y(NO)是光損傷的重要標志,Y(NO)值越大,表明入射光超過了植物能接受的程度,植物已經受到損傷或者繼續照光的植物將受到損傷。結果顯示,與野生型浙粳99相比,早衰突變體es33 的Fv/Fm顯著降低(圖4),表示光轉換效率越低,Y(NO)值顯著增大,表明es33受到損傷較嚴重,早衰特征明顯。

注:A:分蘗盛期野生型和es33葉片Fv/Fm;B:分蘗盛期野生型和es33葉片Y(NO);C:分蘗盛期野生型和es33葉片葉綠素熒光動力學參數對比。Note: A: Wild type and es33 leaf Fv/Fm in tillering stage. B: Leaf Y(NO)of wild type and es33 in tillering stage. C: Histogram of comparison of chlorophyll fluorescence dynamic parameters between wild type and es33 leaves at tillering stage.圖4 早衰突變體es33和浙粳99分蘗盛期葉綠素熒光動力學參數Fig.4 Chlorophyll fluorescence kinetics parameters of early senescence mutant es33 and Zhejing 99 at tillering stage
2.3 早衰突變體es33葉綠體超微結構的變化和光合指標分析
2.3.1 葉綠體超微結構變化分析 為了探究早衰突變體es33發生早衰的過程中伴隨的葉綠體超微結構變化,在苗期突變體es33開始出現早衰表型時,用透射電鏡觀察了野生型和突變體葉綠體的超微結構。結果顯示,野生型浙粳99葉綠體形狀規則,基粒數較多,類囊體片層結構排列緊密有序,早衰突變體es33葉綠體發育畸形、形狀不規則,基粒數明顯減少,類囊體疏松紊亂,嗜鋨顆粒明顯增多、變大(圖5),推測葉片早衰表型與葉綠體發育不正常有關。

注:A、B、C為野生型浙粳99葉綠體超微結構圖;D、E、F為早衰突變體es33葉綠體超微結構圖;G為基粒;OG為嗜鋨顆粒。Note: A, B, and C are the chloroplast ultrastructure of the wild type Zhejing 99. D, E, and F are the chloroplast ultrastructure of the early senescence mutant es33. G: Grana. OG: Osmophilic gramules.圖5 早衰突變體es33和浙粳99分蘗盛期葉綠體超微結構Fig.5 Chloroplast ultrastructure of early senescence mutant es33 and Zhejing 99 at tillering stage
2.3.2 光合指標變化分析 分蘗盛期,與野生型浙粳99相比,早衰突變體es33葉綠體結構發生了變化,推測其光合性能受到影響,用光合作用測量系統測得分蘗盛期野生型和突變體的光合指標,結果如表2所示。突變體es33凈光合速率極顯著低于野生型,氣孔導度顯著低于野生型,蒸騰速率顯著低于野生型,胞間CO2濃度與野生型無顯著差異,說明葉綠體結構的變化進一步影響了突變體es33的光合性能。

表2 早衰突變體es33和野生型浙粳99的光合性能Table 2 Photosynthetic properties of early senescence mutant es33 and wild type Zhejing 99
2.4 早衰突變體es33早衰生理指標變化分析
為了得知變體es33植株胞內有害物質和活性氧含量的變化,檢測了突變體和野生型各項生理指標。結果顯示,突變體es33的MDA、H2O2、OFR等有害物質的含量極顯著高于野生型(圖6),CAT活性、POD活性、SOD活性極顯著低于野生型,說明突變體細胞已受到極大的損傷。

圖6 早衰突變體es33和浙粳99分蘗盛期生理指標Fig.6 Physiological parameters of early senescence mutant es33 and Zhejing 99 at tillering stage
2.5 早衰突變體es33遺傳分析和基因ES33的定位
2.5.1es33的遺傳分析 為了分析突變體es33早衰表型的遺傳特性,將其與野生型浙粳99雜交,觀察F1和F2表型,并統計數量。結果顯示,F1植株均為野生型表型,沒有出現早衰現象,F2植株出現早衰性狀分離,總株數為2 196株,其中正常表型株數為 1 655 株,早衰表型株數為541株,用SPSS軟件卡方檢驗進行遺傳分析,結果顯示(表3),正常植株與早衰植株的分離比符合3∶1的孟德爾分離定律,說明es33受單隱性核基因控制。

表3 es33突變基因的遺傳分析Table 3 Genetic analysis of es33 mutant gene
2.5.2 早衰基因ES33的定位 根據實驗室己有的均勻分布在水稻12條染色體上的174對SSR標記和后續設計的9對InDel分子標記對早衰基因ES33進行定位,通過PCR擴增和聚丙烯酰胺凝膠電泳,用10個早衰單株進行多態篩選和初步定位,將基因ES33初步定位在水稻第3號染色體上,用8對InDel引物對560個早衰單株連鎖分析,最終將該基因定位在STS-15(17.9 Mb)和G24(18.8 Mb)標記之間(圖7),物理距離為0.9 Mb(圖7)。

注:n:群體大小。Note: n: Number of group.圖7 早衰基因ES33定位圖Fig.7 Map of the early senescence gene ES33
2.6 早衰基因ES33重測序、突變位點及尿酸含量變化分析
2.6.1 早衰基因ES33重測序 通過基因定位得到的精細區間(17.9~18.8 Mb)位于3號染色體的著絲粒(17.7~20.2 Mb)上,著絲粒位于染色體的異染色質區域,該區域含有大量DNA重復序列,通常認為該區域是轉錄沉默區,限制了進一步的精細定位,因此借助全基因組重測序的方法將候選基因暫定為LOC_Os03g31550。
2.6.2 早衰基因ES33突變位點分析 基因測序結果發現,用日本晴和野生型浙粳99作為對照,突變體es33中基因LOC_Os03g31550編碼區第11個外顯子出現4個堿基AACA缺失,造成移碼突變。突變體es33的氨基酸序列與野生型浙粳99的氨基酸序列比對顯示堿基缺失造成的移碼突變導致翻譯提前終止(圖8)。

注:突變體es33和野生型浙粳99的堿基序列比對圖(上)和氨基酸序列對比圖(下)。Note: Comparison of base sequence (top) and amino acid sequence (bottom) of mutant es33 and wild type Zhejing 99.圖8 早衰基因ES33突變位點分析Fig.8 Mutation locus analysis of early senescence gene ES33
2.6.3 早衰突變體es33和野生型浙粳99尿酸含量變化分析 由National Center for Biotechnology Information(NCBI)數據庫得知,基因ES33(LOC_Os03g31550)編碼黃嘌呤脫氫酶(xanthine dehydrogenase, XDH),該酶在植物細胞中參與重要的酶促反應,催化黃嘌呤和次黃嘌呤生成尿酸。本研究測得突變體es33分蘗盛期葉片中尿酸含量極顯著低于野生型浙粳99(圖9),說明突變體中該酶促反應被阻滯,推測基因ES33突變導致蛋白XDH結構的改變,造成酶活性降低,酶促反應受阻。

圖9 早衰突變體es33和浙粳99分蘗盛期尿酸含量Fig.9 Uric acid content of early senescence mutant es33 and Zhejing 99 at tillering stage
2.7 早衰基因ES33的同源性分析
用NCBI篩選出與水稻同源性較高的22個物種的氨基酸序列,對水稻(Oryzasativa)和二穗短柄草(Brachypodiumdistachyon)、烏拉爾圖小麥(Triticumurartu)、山羊草(Aegilopstauschiisubsp)、狗尾草(Setariaviridis)、高粱(Sorghumbicolor)、玉米(Zeamays)、油菜(Brassicarapasubsp)、野大豆(Glycinesoja)、黍(Panicummiliaceum)、擬南芥(Arabidopsisthaliana)、豌豆(Pisumsativum)、葡萄(Vitisvinifera)、芭蕉(Musaacuminatasubsp)、油棕(Elaeisguineensis)、大葉藻(Zosteramarina)、茶(Camelliasinensis)、木豆(Cajanuscajan)、江南卷柏(Selaginellamoellendorffii)、原殼小球藻(Auxenochlorellaprotothecoides)、克里藻(Klebsormidiumnitens)和超微藻(Bathycoccusprasinos)中蛋白系統發育樹分析顯示(圖10),水稻中ES33基因與二穗短柄草(Brachypodiumdistachyon)、小麥(Triticumurartu)、山羊草(Aegilopstauschiisubsp)等禾本科親緣關系較近;用DNA MAN軟件對水稻與山羊草、二穗短柄草、黍、狗尾草、高粱、小麥和玉米等禾本科作物的氨基酸序列比對結果顯示,該基因在進化的過程中蛋白質的氨基酸序列在禾本科作物中高度保守(圖11)。

圖10 早衰基因ES33的系統發育樹Fig.10 Phylogenetic tree of the early senescence gene ES33

圖11 不同物種中蛋白ES33的氨基酸序列比對分析Fig.11 Comparative analysis of amino acid sequences of protein ES33 from different species
3 討論
ES33編碼黃嘌呤脫氫酶,該蛋白有一個β折疊和α-β-α核心結構域,在泛素中可以找到相似的結構[34]。在2Fe-2S鐵氧還蛋白家族[35]和2Fe-2S鐵氧還蛋白相關家族(包括醛還原酶和黃嘌呤脫氫酶)[36]中可以找到類似的結構。醛氧化酶和黃嘌呤脫氫酶都是含有鉬輔助因子的酶[37],其共有的錘狀結構域是一種進化保守的2Fe-2S鐵氧還蛋白結構域[38-39]。該區域為β折疊,是由4個β鏈和1個β螺旋側翼組成的β-薄片,由大約100個氨基酸和4個保守的半胱氨酸殘基組成,連接2Fe-2S基團。在植物中,活性中心是2Fe-2S團簇,其中2個鐵原子由2個無機硫原子和4個保守的半胱氨酸殘基提供的硫四面體配位[40]。醛氧化酶是一種同型二聚體,催化醛在氧和水的存在下轉化成羧酸和過氧化氫,需要FAD、鉬和2個2Fe-2S團簇作為輔助因子;黃嘌呤脫氫酶具有相同的輔助因子,該酶通過蛋白水解酶水解或巰基氧化,不可逆地從脫氫酶形式轉化為氧化酶形式,催化黃嘌呤氫化成為次黃嘌呤和尿酸鹽[41],這種活性通常存在于具有黃嘌呤氧化酶活性的雙功能酶中。研究表明,XDH參與尿素和尿酸的合成,在水稻的各組織中表達,XDH基因沉默造成嘌呤代謝物酰尿類物質缺陷,酰尿類物質是一種有效的活性氧清除劑[42-43],導致植株出現生長延遲等不利的影響[44];XDH活性升高可以催化產生有效的活性氧清除劑,減少自由基對組織和細胞的損傷[45],提高植物抗氧化能力,有效延緩水稻葉片衰老過程,提高產量[46]。因此,XDH可通過調控植株內酰脲的含量[47],影響植物細胞清除ROS的能力,從而影響衰老進程。
本研究中突變體es33分蘗期葉片尿酸含量顯著降低,推測由于基因ES33突變導致黃嘌呤脫氫酶的生物合成提前終止,造成XDH活性下調或者結構上的缺陷造成酶促反應受阻,尿酸的合成受阻,尿酸含量降低,加劇了活性氧自由基的積累,從而造成植株的衰老。
本研究發現,葉片早衰突變體es33苗期開始出現葉尖變黃早衰表型,衰老逐漸嚴重直到成熟期。ES33受一對隱性核基因控制,位于水稻3號染色體上,確定為LOC_Os03g31550,編碼XDH,是基因ESL1[25]的等位基因。前人研究表明,XDH具有延緩葉片衰老的功能[45],含有鉬輔助因子結合的結構域(455~561 AA),位于第4個外顯子,構成底物結合部位和氧化還原部位[48],還存在進化保守結構域(620~727 AA),位于第5和第6個外顯子中。基因ESL1的第4個外顯子中堿基T的缺失(第558個AA),移碼突變導致翻譯提前終止,早衰可能是由XDH鉬輔助因子結合域不完整和進化保守結構域缺失造成蛋白功能的損壞引起的。ES33第11個外顯子出現4個堿基的缺失,造成移碼突變(圖12)導致蛋白質翻譯提前終止。ES33的突變位點不在XDH的功能結構域和保守結構域,蛋白質結構相對比較完整,但是突變體es33出現早衰性狀的時間比突變體esl1早,推測基因ES33在調控水稻衰老過程中,除了蛋白質XDH鉬輔助因子結合結構域和進化保守結構域以外,還有其他因素起著關鍵性作用。
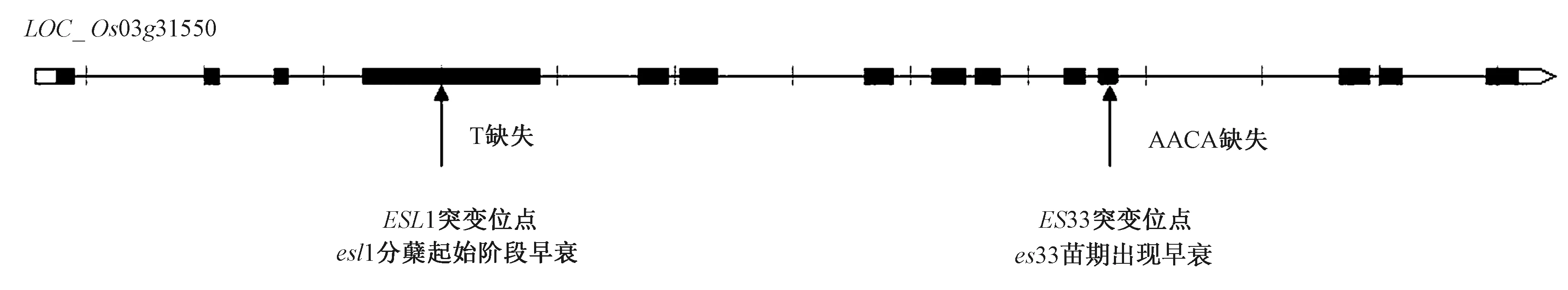
圖12 不同突變位點比較Fig.12 Comparison of different mutation sites
迄今為止,黃嘌呤脫氫酶基因對水稻衰老調控的作用機制很少被報道,本研究為進一步明確黃嘌呤脫氫酶基因影響水稻衰老機制奠定了基礎,同時為利用早衰分子機制培育出抗衰老新品種提供了依據。
4 結論
本研究發現,由于ES33基因發生堿基缺失突變,導致突變體es33苗期出現早衰表型,分蘗期葉綠體結構發生變化,光合作用減弱,植株衰老持續到成熟期,結實率和千粒重顯著下降,產量降低。

附表1 本研究所用引物序列Table S1 Primer sequences used for this study

