IGF1R敲除通過AMPK減輕Ang II誘導的小鼠心肌炎癥及細胞凋亡*
朱家峰, 李 倩, 方 柳, 姚 倩, 張侍玉, 張蘭娥△
(1濰坊醫學院護理學院,山東 濰坊 261053;2濰坊醫學院臨床醫學院,山東 濰坊 261053)
隨著社會經濟發展和人口老齡化的加劇,心血管危險因素對人類健康的影響愈加顯著,心血管疾病(cardiovascular diseases,CVD)是全球范圍內影響發病率和死亡率的主要原因[1],也是首位死亡原因[2]。在過去 20 年(1997~2018 年),全球 CVD 的死亡率幾乎沒有變化,尤其心力衰竭(心衰)更是如此,其 5 年死亡率仍然高達 45%~55%[3]。目前,我國CVD 患病率仍處于持續上升階段,現有患病人數大約3.3 億,是主要的死亡原因,其中農村為46.66%,城市為43.81%。因此,CVD 已成為一個日益嚴重的全球性公共衛生問題,防治工作刻不容緩[4]。
高血壓是CVD 的關鍵危險因素,而持續高血壓會導致心臟功能下降和嚴重的心臟損傷。血管緊張素II(angiotensin II,Ang II)是腎素-血管緊張素系統(renin-angiotensin system,RAS)的關鍵組成部分,介導高血壓心臟損傷[5]和炎癥細胞/巨噬細胞浸潤;并且,RAS 影響心肌細胞內過程,包括促炎細胞因子和活性氧的產生增加、纖維化、肥大、細胞凋亡、內質網應激等[6-7]。Yang 等[8]發現,減少心肌炎癥反應和凋亡會減輕Ang II 誘導的小鼠心臟損傷和重構的進展,改善心功能。AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)活化能夠調節心臟代謝和炎癥反應,從而保護小鼠心臟免受缺血性損傷[9]。因此,如何抑制Ang II 誘導的心肌炎癥反應及細胞凋亡是治療及預防心肌損傷和重構的重要方向。
胰島素生長因子1 受體(insulin growth factor 1 receptor,IGF1R)是一種酪氨酸激酶,在心臟中廣泛表達,具有調節心臟收縮功能和細胞增殖分化的重要生理作用[10]。有研究表明,IGF1R 在小鼠心臟中的過表達最終導致收縮性能的下降和間質纖維化的增加,并且IGF1R 在小鼠缺血性心臟病和心力衰竭中過表達[11-12]。然而,有研究在雌性小鼠中使用IGF1R 單克隆抗體有效改善了心臟功能[13]。因此本研究利用Ang II 誘導小鼠高血壓心臟損傷,旨在探討IGF1R缺失對Ang II 誘導的小鼠心肌炎癥反應和心肌細胞凋亡的影響及其作用機制。
材料和方法
1 動物
SPF 級、6~8 周齡雄性野生型(wild-type,WT)C57BL/6 小 鼠 和 雜 合 子Igf1r基 因 敲 除(Igf1r+/-)C57BL/6小鼠(體重22~24 g)各20只購自賽業(廣州)生物科技有限公司[許可證號SCKX(粵)2018-0032],飼養在濰坊醫學院動物實驗中心,進行溫度、濕度控制和12 h 的光-暗循環。動物實驗根據山東省人民政府出版的《實驗動物護理和使用指南》和《實驗動物護理和使用指南》進行。動物實驗經濰坊醫學院動物護理與使用委員會批準(No. 2020SDL163)。
2 主要試劑
Ang II購自上海索萊寶生物科技有限公司;腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)、IL-6、肌酸激酶同工酶MB(creatine kinase-MB,CK-MB)和心肌鈣蛋白T(cardiac troponin T,cTnT)的ELISA 檢測試劑盒購自上海西唐生物科技有限公司;TUNEL 細胞凋亡檢測試劑盒購自南京諾唯贊生物科技股份有限公司。TRIzol 試劑購自 Invitrogen;逆轉錄 Ace?qPCR RT 試劑盒和SYBR?Green 購自Toyobo;所用引物由上海生工生物工程有限公司根據設計合成,序列見表1。抗 IGF1R、caspase-3、caspase-8、AMPK 和 p-AMPK 單克隆抗體均購自Cell Signaling Technology;抗GAPDH單克隆抗體購北京中杉金橋生物技術有限公司;羊抗兔Ⅱ抗和羊抗鼠Ⅱ抗均購自Proteintech。
3 主要方法
3.1 小鼠模型及實驗分組 研究表明,Ang II 皮下注射2 周可以誘導小鼠心臟損傷和心肌重構[14],因此本研究對Ang II 組小鼠皮下注射Ang II(2 mg·kg-1·d-1)2 周以構建心肌損傷模型。將 WT 和Igf1r+/-小鼠各20 只按照隨機數字表法各分為2 組,共4 組,即 WT+saline 組、WT+Ang II 組、Igf1r+/-+saline 組和Igf1r+/-+Ang II 組,每組 10 只。saline 組小鼠皮下注射等體積的生理鹽水2周。
3.2 小鼠心功能測定 在4 組小鼠連續處理2 周后,禁食禁水8 h 測量體重(body weight,BW)并以3%異氟烷麻醉小鼠,快速進行眼球取血后用二氧化碳安樂處死小鼠,然后對心臟重量(heart weight,HW)和脛骨長度(tibial length,TL)進行測量。
3.3 免疫組織化學法檢測IGF1R 在心臟組織中的表達 收集WT 和Igf1r+/-小鼠心臟進行固定、包埋,利用免疫組織化學法分別檢測心臟組織樣本IGF1R的表達情況。IGF1R 定位于細胞質,以棕黃色顆粒為染色陽性。ImageJ 圖像分析軟件對染色結果進行分析和定量。
3.4 ELISA 檢測炎癥因子 將4 組小鼠血液4 ℃靜置 24 h 后,3 000×g離心 15 min 收集血清,按 ELISA試劑盒說明書檢測血清中 TNF-α、IL-1β 和 IL-6 水平,將10 μL樣品(用40 μL樣品稀釋劑按1∶5的比例稀釋)加入到ELISA 涂層板上的相應孔中,然后加入100 μL HRP 偶聯試劑。僅在空白孔中加入樣品稀釋劑。密封后,在37 ℃下孵育60 min。用洗滌液沖洗 5 次后,每孔依次加入 50 μL 顯色劑 A 和 50 μL 顯色劑B,37 ℃黑暗孵育15 min。最后,用 50 μL 終止液在室溫下終止反應5~10 min,用酶標儀測定450 nm 波長的吸光度,根據不同ELISA 試劑盒的方法計算出炎癥因子的濃度。
3.5 TUNEL 檢測心肌組織中細胞凋亡 取小鼠心臟標本,PBS 沖洗干凈后,4%多聚甲醛固定,用組織刀片沿水平45°進行橫切后,進行石蠟包埋和制作5 μm 厚石蠟切片。然后將各組心肌組織切片室溫下用二甲苯和梯度乙醇溶液(二甲苯10 min,二甲苯8 min,100%乙醇5 min,90%乙醇2 min,70%乙醇2 min,70%乙醇,蒸餾水2 min)脫蠟。樣品與20 mg/L蛋白酶K(無DNase)在37 °C 下孵育15 min。切片用PBS 洗滌 3 次后,用 TUNEL 反應溶液在 37 °C 下孵育1 h。切片用抗熒光衰退劑(含DAPI)密封,然后再用PBS 沖洗。在熒光顯微鏡下觀察和拍照,細胞凋亡率:凋亡細胞與總細胞的比值。
3.6 RT-qPCR 用TRIzol 試劑從小鼠左心室中獲得總RNA,用逆轉錄Ace?qPCR RT試劑盒將RNA轉化為cDNA。以引物為起始位點,在SYBR?Green 作用下,采用LightCycle 480 Instrument II PCR 檢測儀(Roche)進行PCR 擴增。反應條件為:95 ℃預變性30 s;95 ℃ 5 s,55 ℃ 10 s,72 ℃ 15 s,40 個循環;72 ℃延長 10 min。內參照為 β-actin,結果使用 2-ΔΔCt方法進行分析。
3.7 免疫印跡法 四組心臟組織加入RIPA 裂解緩沖液、蛋白酶和磷酸酶抑制劑。將加入裂解液的組織在冰上輕輕攪拌 40 min,4 ℃、12 000×g離心 15 min 后收集上清液。用BCA 檢測試劑盒(Thermo)測定蛋白樣品的濃度,并在95 ℃下與加載緩沖液孵育10 分鐘。對分子量大于10 kD 的蛋白質進行10%的Tris-Tricine-SDS-PAGE 電泳,并將蛋白質轉移到PVDF 膜中。在室溫下,用5%脫脂牛奶和Tris 緩沖鹽水/Tween-20(pH 7.4)封閉細胞膜1 h,加入Ⅰ抗4 ℃孵育過夜,TBST洗3次,每次10 min,使用相應Ⅱ抗常溫孵育1 h,使用化學發光辣根過氧化物酶底物可視化蛋白條帶,利用Alpha化學發光凝膠成像系統FluorChem FC3 獲取條帶,并ImageJ 圖像分析軟件測量蛋白條帶灰度值進行定量。
4 統計學處理
采用 SPSS 19.0 和 GraphPad Prism 9.0 進行統計分析和圖表繪制。數據均采用均數±標準差(means±SD)表示。兩組樣本之間采用獨立樣本t檢驗;多組之間差異使用雙因素方差分析,然后采用LSD 法檢驗進行多重比較。以P<0.05為差異有統計學意義。
結 果
1 Igf1r基因敲除小鼠的構建
為了研究IGF1R 信號是如何調節Ang II 誘導的心臟重構,使用CRISPR/Cas9 基因敲除技術構建Igf1r基因敲除小鼠,見圖1A。從小鼠尾巴中獲得的總RNA,通過PCR 方法鑒定出Igf1r+/-小鼠,見圖1B。通過免疫組織化學檢測法檢測IGF1R 在心臟中的表達,Igf1r+/-小鼠的IGF1R 陽性表達量顯著低于WT 小鼠(P<0.01),見圖1C。
2 IGF1R敲除緩解Ang II誘導的小鼠心肌損傷
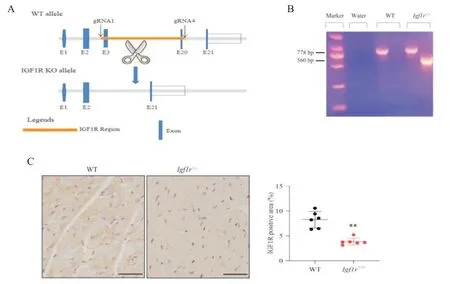
Figure 1. Establishment and analysis of insulin growth factor 1 receptor(IGF1R)gene knockout mice. A:protocols of Igf1r+/- mouse model generation. The CRISPR/Cas9 gene technology was used to selectively knock out mouse Igf1r gene. Through in vitro transcription,Cas9-mediated mRNA and generated gRNAs were injected into mouse zygotes to knock out exons 3 to 20 of the target gene Igf1r. B:identification of the genotype in Igf1r+/- mouse model by PCR. C:immunohistochemical staining of IGF1R in the heart of WT and Igf1r+/-mice(scale bar=50 μm). Mean±SD. n=6.**P<0.01 vs WT group.圖1 IGF1R敲除小鼠的構建和分析
在本研究中,Igf1r+/-和WT 小鼠皮下注射Ang II(2 mg·kg-1·d-1)2 周,實驗方案如圖 2A 所示。如表 2所示,各組小鼠BW 無顯著差異(P<0.05);與WT+saline 組相比,WT+Ang II 組小鼠 HW 顯著增加(P<0.01),與 WT+Ang II 組相比,Igf1r+/-+Ang II 組小鼠HW 顯著減少(P<0.01);心臟功能重要評價指標HW/BW 和HW/TL 也出現了相一致的結果。采用RT-qPCR 法檢測各組小鼠心臟組織腦鈉肽(brain natriuretic peptide,BNP)的 mRNA 表達水平,結果顯示,與WT+saline組相比,WT+Ang II組小鼠心臟BNP表達水平顯著升高(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II 組小鼠心臟BNP 表達水平顯著降低(P<0.01),見圖2B。采用ELISA 法檢測各組小鼠血清cTnT和CK-MB含量,結果顯示,與WT+saline 組相比,WT+Ang II 組小鼠血清 cTnT 和 CK-MB 含量顯著增加(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II組小鼠血清cTnT和CK-MB含量顯著減少(P<0.05),見圖2C、D。采用免疫印跡法檢測各組小鼠心臟IGF1R 蛋白表達水平,結果顯示,與WT+saline 組相比,WT+Ang II組小鼠心臟IGF1R蛋白表達水平顯著升高(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II組小鼠心臟IGF1R 蛋白表達水平顯著降低(P<0.01),見圖2E。
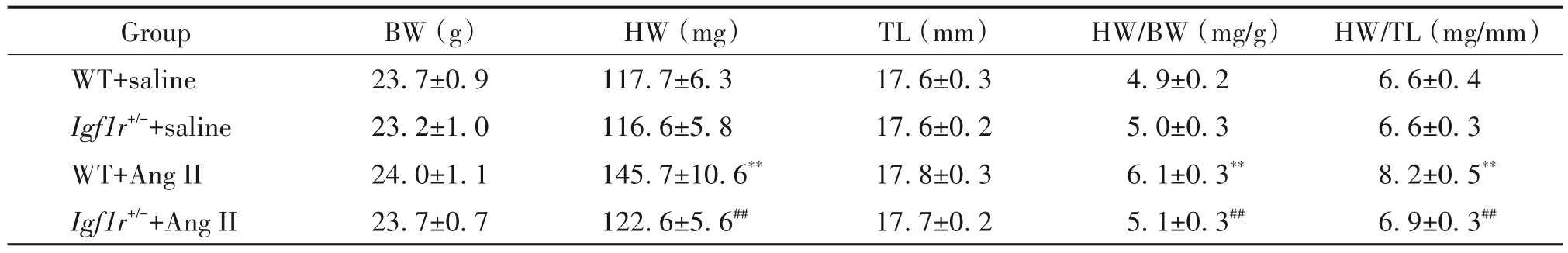
表2 各組小鼠心臟指數Table 2. Cardiac indexes of the mice in each group(Mean±SD. n=10)
3 IGF1R 敲除降低Ang II 誘導的小鼠心臟組織炎癥因子水平
通過RT-qPCR 法檢測各組小鼠心臟組織中炎癥因子 TNF-α、IL-1β 和 IL-6 的 mRNA 表達水平,結果顯示,與 WT+Ang II 組相比,WT+Ang II 組小鼠心臟組織中 TNF-α、IL-1β 和 IL-6 的 mRNA 表達水平均顯著升高(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II 組小鼠心臟組織中 TNF-α、IL-1β 和 IL-6 的 mRNA表達水平均顯著降低(P<0.01),見圖3A。再通過ELISA 法檢測各組小鼠血清中 TNF-α、IL-1β 和 IL-6蛋白水平,結果顯示,與WT+Ang II 組相比,WT+Ang II 組小鼠血清中 TNF-α、IL-1β 和 IL-6 水平均顯著升高(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II 組小鼠血清中 TNF-α、IL-1β 和 IL-6 水平均顯著降低(P<0.01),見圖3B。
4 IGF1R 敲除減少Ang II 誘導的小鼠心肌細胞凋亡
TUNEL 染色結果顯示,與WT+Ang II 組相比,WT+Ang II 組小鼠心肌細胞凋亡率顯著升高(P<0.01);與WT+Ang II組相比,Igf1r+/-+Ang II組小鼠心肌細胞凋亡率顯著降低(P<0.01),見圖4A。免疫印跡結果顯示,與 WT+Ang II 組相比,WT+Ang II 組小鼠心臟組織中caspase-3 和caspase-8 表達水平顯著升高(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II組小鼠心臟組織中caspase-3 和caspase-8 表達水平顯著降低,見圖4B。
5 IGF1R 敲除通過促進AMPK 磷酸化減輕Ang II誘導的心臟損傷
免疫印跡結果顯示,與WT+Ang II 組相比,WT+Ang II 組小鼠心臟組織中AMPK 磷酸化水平顯著降低(P<0.01);與WT+Ang II 組相比,Igf1r+/-+Ang II 組小鼠心臟組織中AMPK 磷酸化水平顯著升高(P<0.05),見圖5。
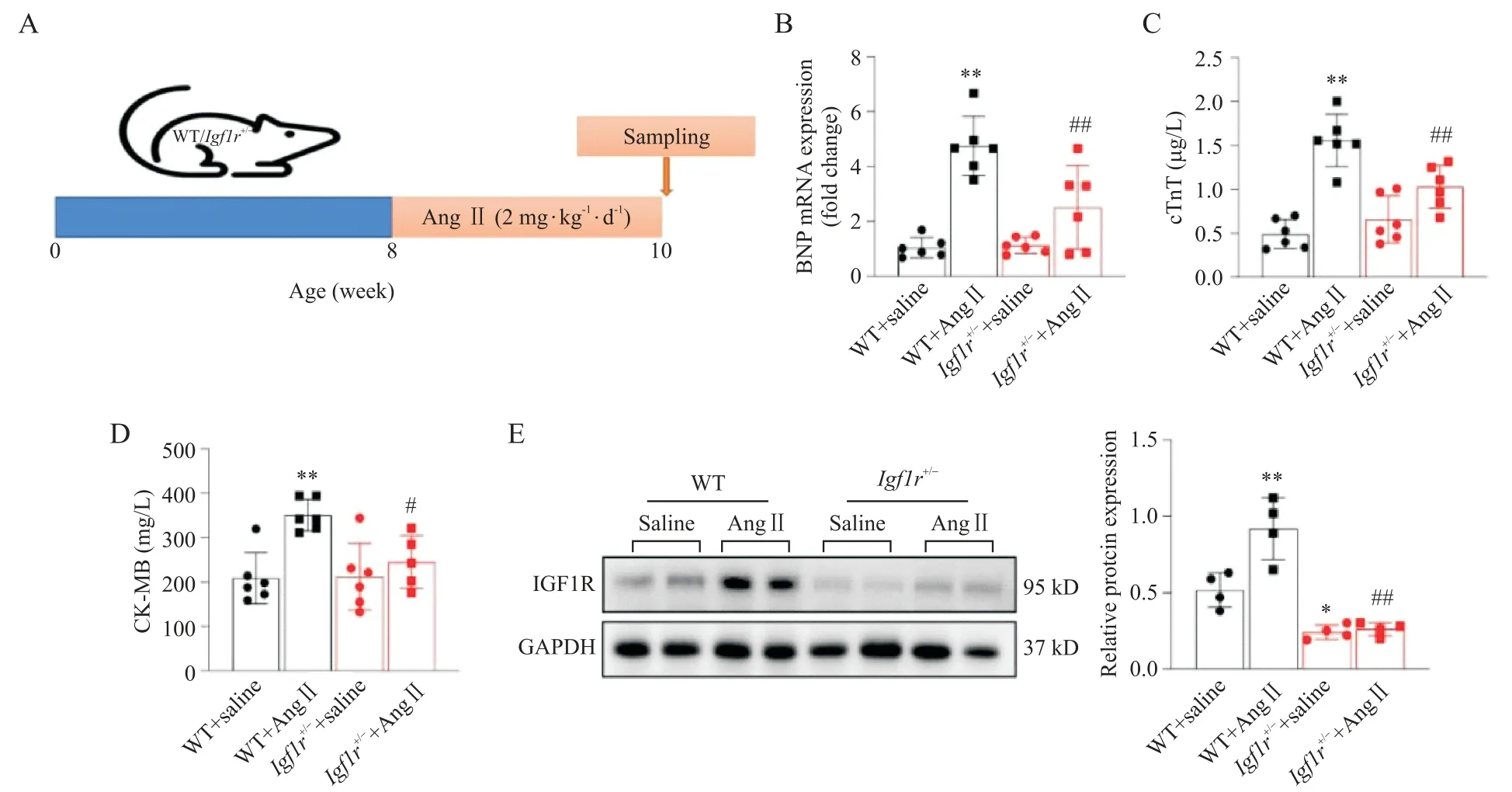
Figure 2. The expression of insulin growth factor 1 receptor(IGF1R)was up-regulated in the peocess of angiotensin II(Ang II)-induced cardiac injury. A:the myocardial injury model was established by subcutaneous injection of Ang II(2 mg·kg-1·d-1)for 2 weeks,while the mice in control group were subcutaneously injected with the same volume of normal saline for 2 weeks;B:the mRNA expression level of brain natriuretic peptide(BNP)in mouse cardiac tissues was detected by RT-qPCR(n=6 to 8);C and D:the serum levels of cardiac troponin T(cTnT)and creatine kinase-MB(CK-MB)in mice were measured by ELISA(n=6);E:the protein expression of IGF1R in mouse cardiac tissues was detected by Western blotting(n=4). Mean±SD.*P<0.05,**P<0.01 vs WT+saline group;#P<0.05,##P<0.01 vs WT+Ang II group.圖2 IGF1R在Ang II誘導的心臟損傷過程中表達上調
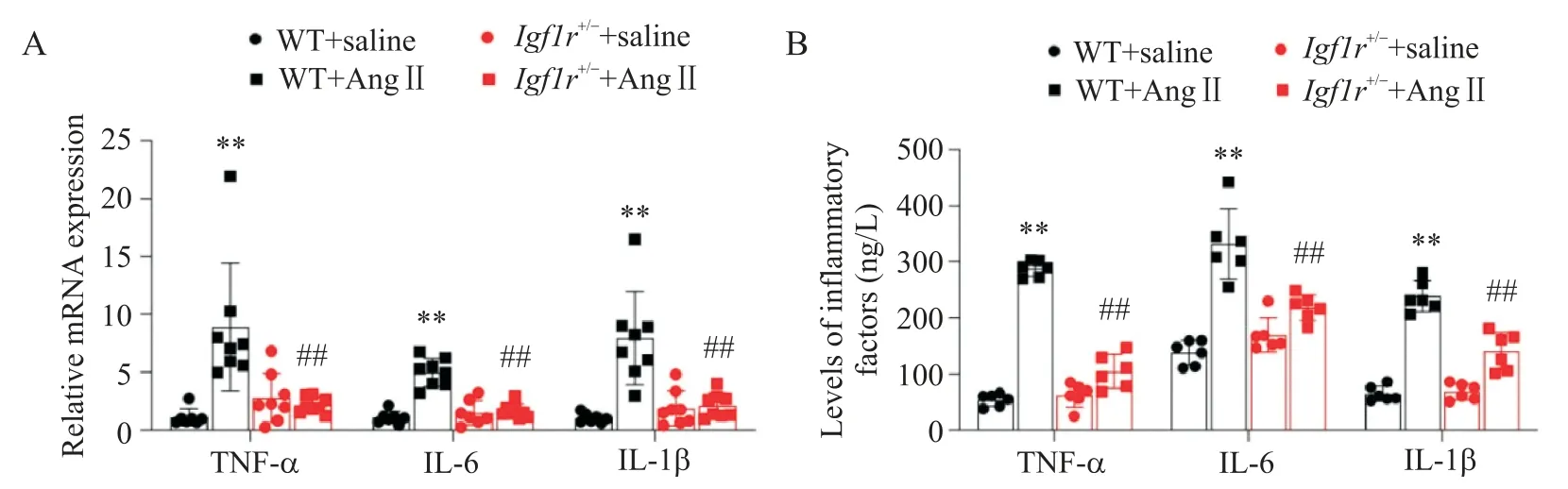
Figure 3. Insulin growth factor 1 receptor(IGF1R)knockout attenuated angiotensin II(Ang II)-induced cardiac inflammation. A:the mRNA expression levels of tumor necrosis factor-α(TNF-α),interleukin-1β(IL-1β)and IL-6 in mouse cardiac tissues were detected by RT-qPCR(n=6 to 8);B:the serum levels of TNF-α,IL-1β and IL-6 in mice were detected by ELISA(n=6). Mean±SD.**P<0.01 vs WT+saline group;##P<0.01 vs WT+Ang II group.圖3 IGF1R敲除可減輕Ang II引起的心臟炎癥
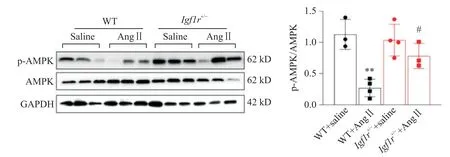
Figure 5. Insulin growth factor 1 receptor(IGF1R)knockout attenuated angiotensin II(Ang II)-induced cardiac injury by promoting AMP-activated protein kinase(AMPK)phosphorylation. The protein levels of phosphorylated AMPK(p-AMPK)and AMPK were detected by Western blotting. Mean±SD. n=3 to 4.**P<0.01 vs WT+saline group;#P<0.05 vs WT+Ang II group.圖5 IGF1R敲除通過促進AMPK磷酸化減輕Ang II誘導的心臟損傷
討 論
心臟損傷引發重構的發病機制復雜,主要包括心肌細胞肥大、纖維化、炎癥反應和氧化應激等。在心血管疾病(如心肌缺血損傷、冠心病、心力衰竭和動脈粥樣硬化等)發生過程中常常伴隨著炎癥反應。心肌細胞受到氧化應激刺激后,會產生炎癥因子,過量的炎癥因子會使細胞出現生長異常、自噬和凋亡的失調,導致細胞異常凋亡[15-16],從而引起心臟損傷,甚至出現心力衰竭。因此,如何減少氧化應激、心肌炎癥反應和細胞凋亡對緩解心肌損傷至關重要。最近,有關IGF1R 信號通路參與心血管疾病(包括心臟纖維化[17]、缺氧損傷[18]、心肌重構和糖尿病心肌病[19])逐漸成為研究熱點。IGF1R 信號在心血管系統中具有控制細胞生存、分化、細胞凋亡和炎癥作用[20]。但是IGF1R 在不同類型的心臟疾病中可能發揮不同作用。Huynh 等[21]的研究表明,小鼠 IGF1R過表達能夠通過激活AKT通路減少心肌梗死和凋亡來抑制糖尿病心肌病的發生。而Takeda等[22]在高血壓心肌肥厚小鼠模型中卻檢測到IGF1R 高表達并且能夠促進成纖維細胞增殖,增加心臟纖維化。為了進一步了解IGF1R 信號通路與心血管疾病的關系,因此本研究探討了IGF1R 與心肌損傷之間的關系并明確了其作用機制。本研究觀察到IGF1R 在Ang II誘導的小鼠心臟損傷過程中表達顯著上調,這與既往研究在缺血性心臟病和心力衰竭時IGF1R 表達顯著升高[12]的結果一致。心臟損傷時伴有心肌細胞的代償性肥大和心室的擴大,所以Ang II 刺激WT 小鼠后導致 HW、HW/BW 和 HW/TL 顯著升高,而Igf1r+/-小鼠給予Ang II 刺激后并沒有引起上述觀察指標的變化。心肌細胞損傷后,細胞膜被破壞,細胞產生的心肌損傷特異性標志物CK-MB 和cTnT 會在血液循環中升高[23];并且心臟功能的重要指標BNP 的表達也會增加。我們繼續觀察到,Ang II 刺激的WT 小鼠心臟組織中BNP及血清中CK-MB和cTnT顯著升高,而Igf1r+/-小鼠中Ang II誘導的心臟損傷明顯減輕,表明敲除IGF1R能夠緩解Ang II 誘導的小鼠心功能損傷。
炎癥反應是導致心臟損傷和重構的一個關鍵生物學過程,并且IGF1R 在炎癥過程的啟動中起著重要作用。既往研究顯示,Ang II能誘導巨噬細胞和小鼠心肌組織炎癥小體的激活以及炎癥因子(如TNF-α、IL-1β 和IL-6)釋放[24],這些炎癥因子的表達量越高,說明組織炎性損傷的情況越嚴重,從而促進心功能損傷。本研究顯示,Ang II 刺激WT 小鼠后導致炎癥因子TNF-α、IL-1β 和IL-6均顯著升高,而Ang II刺激的Igf1r+/-小鼠心肌組織炎癥因子水平顯著下降,表明IGF1R缺失抑制了心肌炎癥。
在Ang II 誘導的心肌損傷中,心臟炎癥反應可激活凋亡信號通路,主要通過內在途徑(線粒體)和外在途徑(受體介導)來促進心肌細胞凋亡。caspase蛋白家族廣泛參與細胞凋亡,其中caspase-3 和caspase-8是凋亡的關鍵執行蛋白:caspase-8是由腫瘤壞死因子受體家族所誘導的,受到Fas外在途徑凋亡通路影響[25];caspase-3 可以通過內在途徑(線粒體)誘導細胞凋亡[25-26]。所以 caspase-3 和 caspase-8 表達越高說明細胞凋亡越多。本研究檢測到Ang II 刺激WT 小鼠導致caspase-3 和caspase-8 表達顯著增加,表明出現了Ang II誘導了嚴重的細胞凋亡,但是Ang II刺激的Igf1r+/-小鼠心肌細胞凋亡率顯著下降,表明IGF1R敲除能夠緩解Ang II 誘導的心肌組織凋亡。此外,本研究通過TUNEL 染色檢測細胞凋亡情況也得到了一致的結果。
AMPK 廣泛存在于心肌細胞中,是能量代謝調節的關鍵分子,在生理和病理情況下都發揮著重要的功能。當心肌發生損傷時,心肌細胞中ATP 的濃度降低,激活AMPK。AMPK 激活可以減少促炎細胞因子TNF-α 的表達,發揮抗炎、抗氧化的作用,并可以抑制蛋白合成,減輕內質網應激而抑制心肌細胞凋亡,從而對心臟起到一定的保護作用[27]。有研究表明,抑制IGF1R 表達可減輕程序性細胞死亡和炎癥,從而緩解心肌重構[28]。但是,關于抑制IGF1R 表達是否通過激活AMPK 途徑減輕心肌損傷,目前尚未見到報道。為進一步闡明IGF1R缺失是如何抑制心臟炎癥反應和細胞凋亡而發揮保護心臟作用的,我們利用免疫印跡法檢測了各組小鼠心肌組織中AMPK 磷酸化水平的變化。結果顯示,Ang II 刺激WT 小鼠可導致其心肌組織中p-AMPK/AMPK 比值顯著降低,而Ang II 刺激的Igf1r+/-小鼠心肌組織中p-AMPK/AMPK 顯著升高,表明IGF1R敲除可能通過促進AMPK 磷酸化來抑制心肌損傷中的炎癥反應和細胞凋亡,進而對心肌組織起到保護作用。
綜上所述,本研究顯示IGF1R敲除可減輕Ang II誘導的小鼠心肌損傷,并通過抑制心肌炎癥反應和心肌細胞凋亡來發揮作用,其作用機制可能與促進小鼠心肌組織中AMPK 磷酸化有關。但關于IGF1R在Ang II 誘導的心肌損傷中發揮作用的具體分子機制仍需要研究。

