大鼠心肌缺血再灌注損傷模型改良置管法*
李 睿, 王祎昕, 紀樹亮, 劉坤東, 孫治中, 馮藝昕,章潔淳, 鄺棗園, 卿立金, 吳 偉△
(1廣州中醫(yī)藥大學第一臨床醫(yī)學院,廣州 440100;2廣州中醫(yī)藥大學基礎醫(yī)學院,廣州 440100;3廣州中醫(yī)藥大學第一附屬醫(yī)院,廣州 440100)
急性心肌梗死因其高致死率和致殘率的特點而成為心血管疾病的頭號殺手。隨著各地區(qū)各級醫(yī)院再血管化措施的不斷普及(包括溶栓、冠脈介入術及冠脈旁路移植術等),急性心肌梗死患者住院死亡率由最初約30%,下降至如今4.3%[1]。雖然再灌注手段對于該病療效顯著,但隨著心肌梗死患者的增加和心臟介入治療的普及,急診介入圍術期無復流現(xiàn)象、微循環(huán)障礙及心肌缺血再灌注損傷(myocardial ischemia/reperfusion injury,MIRI)等問題日益突出,如何進一步增加冠脈介入的獲益成為當下研究熱點。MIRI可引發(fā)心肌缺血期間并不存在的損傷或使已有損傷加重,是減少急性心肌梗死再灌注的治療獲益的重要因素,然而其復雜的病理生理機制和潛在的治療靶點仍有待闡明和開發(fā)。目前,MIRI 研究最常用的模型動物為大鼠,然而,現(xiàn)有大鼠造模方法常存在氣管插管困難、氣管切開損傷大、左前降支結(jié)扎力度難以把握或線結(jié)易松動等問題,難以達到穩(wěn)定的造模效果。本實驗在現(xiàn)有大鼠MIRI 造模方法基礎上進行改良,以期為MIRI 研究提供較穩(wěn)定可靠的模型制備方法。
材料和方法
1 實驗動物
45 只 SPF 級雄性 SD 大鼠,6~8 周齡,體重 220~250 g,由南方醫(yī)科大學動物實驗中心提供[SCXK(粵)2021-0041]。飼養(yǎng)在廣州中醫(yī)藥大學第一附屬醫(yī)院SPF級屏障環(huán)境動物房[SYXK(粵)2018-0092],大鼠自由進食,環(huán)境晝夜均衡,溫度23~26 ℃,濕度(50±5)%,實驗動物的使用遵循3R 原則。所有實驗操作均獲得廣州中醫(yī)藥大學第一附屬醫(yī)院實驗動物倫理委員會的審批(審批號:TCMF1-2021044)。
2 主要儀器和試劑
戊巴比妥鈉鹽(型號57330)、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC;貨號T8877)購自Sigma;伊文思藍(Evans blue,EB;貨號E6135)購自上海麥克林生化科技有限公司;多聚甲醛固定液(型號G1101-500ML)、HE 染液套裝(型號G1003)和TUNEL 試劑盒(型號G1501)均購于賽維爾生物有限公司;乳酸脫氫酶(lactate dehydrogenase,LDH)測定試劑盒(型號S03034)購于深圳雷杜生命科技有限公司;肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CK-MB)測定試劑盒(型號C060)購于長春匯力生物技術有限公司;大鼠心肌鈣蛋白I(cardiac troponin I,cTnI)酶免分析試劑盒(貨號MM-0377R1)購自江蘇酶免實業(yè)有限公司;鼠恒溫實驗臺(型號JR-30)和信號采集與處理系統(tǒng)(型號BL-420I)均購于成都泰盟科技有限公司;大鼠手術撐開輔助牽引器(型號10 mm 彎邊)購于創(chuàng)博環(huán)球生物科技有限公司;麻醉咽喉鏡(型號MAC0)購于江蘇永樂醫(yī)療科技有限公司;臺式高速冷凍離心機(型號D3024R)購于大龍儀器有限公司;U 型槽升降滑輪(型號2.5寸)購于安捷順鼎有限公司;全自動生化分析儀(型號Chemray 240)購于深圳雷杜生命科技有限公司;數(shù)字病理切片掃描儀(型號Pannoramic MIDI Ⅱ)購于濟南丹吉爾電子有限公司。
3 主要方法
3.1 實驗分組 45只SD 大鼠按隨機數(shù)字表法分為3 組:假手術(sham)組、墊線(即傳統(tǒng)模型,traditional model,TM)組和改良置管(即優(yōu)化模型,optimized model,OM)組,每組15 只(每組用于心肌梗死面積測定 3 只,心肌組織 HE 染色及血清 LDH、CK-MB 和cTnI 含量測定 6 只,心肌組織 TUNEL 染色 6 只)。大鼠均可自由進食,適應性飼養(yǎng)1 周后進行造模,術前12 h內(nèi)禁食不禁水。
3.2 MIRI模型建立方法
3.2.1 墊線結(jié)扎法[2](TM 組) (1)氣管插管:采用2%戊巴比妥鈉對大鼠進行腹腔注射麻醉(1.5 mL/kg)后將其胸前區(qū)備皮置于恒溫臺,四肢連接心電電極。待心電信號穩(wěn)定后,將恒溫臺立起,使用新生兒咽喉鏡壓舌抬腭,聯(lián)合頸外光源照射可見咽喉聲門帶隨呼吸開合,待吸氣相聲門開啟時迅速將16G 的氣管導管插入,成功后連接呼吸機輔助通氣。呼吸機參數(shù)設置:潮氣量10.0 mL、呼吸頻率80 min-1,吸呼比 1∶1。(2)開胸:胸骨中點位置旁開0.5 cm 處提起皮膚,橫行剪開1 cm,鈍性分離皮下肌肉,使用眼科直鑷于第3 肋間隙胸骨旁開0.5 cm 位置小心戳破肋間肌及胸膜,直上剪斷第3 肋骨并使用止血鉗擴開2~4 肋間隙切口,使用小動物擴胸器撐開胸廓,暴露心臟。(3)冠脈左前降支結(jié)扎:用少量濕潤棉絮別開肺部,小心扯開心包膜,在肺動脈圓錐與左心耳交界處直下2~4 mm 處,在向左側(cè)旁開2 mm 的位置使用穿有5-0 縫合線的4×6 mm 圓針進針,走向垂直于肺動脈圓錐與左心耳交界延長線并于肺動脈圓錐下出針,寬度2~3 mm,深度約為2 mm,穿線后提起心肌隱約可見白色細條狀冠狀動脈左前降支,結(jié)扎時于針線上方墊一直徑為1.0 mm 適當長度的棉線并打活結(jié),見結(jié)扎以下部位心肌發(fā)白且心電圖逐漸顯示ST段上抬或出現(xiàn)心律失常則提示定位準確。(4)再灌注:結(jié)扎完成后濕潤紗布蓋好胸部創(chuàng)口,缺血30 min后松開活結(jié),術后無需抽吸所謂胸腔積氣即可逐層關胸,拔出氣管插管,將大鼠繼續(xù)置于恒溫臺上恢復蘇醒。(5)模型標準:以左室前壁心肌發(fā)白、心電圖ST段抬高0.1 mV 以上為缺血標志;再灌注時左室前壁缺血心肌部分恢復紅潤,心電圖ST 段下降50%以上,即再灌注損傷造模成功。
3.2.2 改良置管法[3](OM 組) OM 組在 3.2.1 第(3)步穿過冠脈左前降支后取出針頭,將線兩端穿過一聚乙烯管(如采血針管),長度約0.5 cm,繼而借助12×5 mm 圓針于進針口處旁開約0.5 cm 處垂直往上依次穿過肋間肌、胸大肌直至皮膚,棄針頭,上端縫線打死結(jié),借助拉鉤、滑輪及數(shù)個充滿水的2 mL 離心管拉直縫線(其中滑輪距大鼠心臟垂直距離約15 cm,拉鉤線長約8~10 cm 且與大鼠心臟平面約成60°角),可見心電圖ST 段立即抬高至R 波的1/2 以上,穩(wěn)定后創(chuàng)口覆蓋濕潤鹽水紗塊。其余步驟同3.2.1。見圖1。
3.2.3 假手術法(sham 組) 假手術除在3.2.1 中第(3)步是只穿線不結(jié)扎,其余步驟與3.2.1 相同,因其執(zhí)行假手術,故心電圖ST段應無明顯變化。
上述各組大鼠于再灌注90 min 末,經(jīng)相應處理后采用腹主動脈失血休克法處死并取材檢測。
3.3 監(jiān)測造模過程心電圖變化 通過觀察并記錄Ⅱ?qū)?lián)心電圖,監(jiān)測大鼠插管前后、結(jié)扎前后及再灌注時的心電圖表現(xiàn),觀察并記錄大鼠心電圖有無心律失常現(xiàn)象。
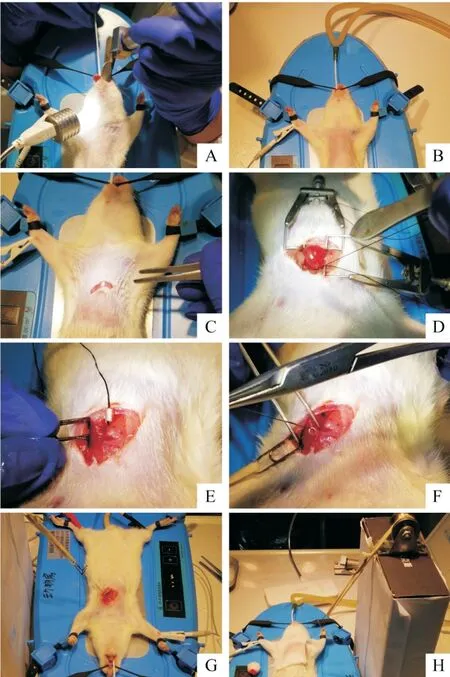
Figure 1. The optimized method for MIRI modeling in rats. A and B:endotracheal intubation with neonatal laryngoscope;C:cut the skin horizontally;D:after passing through the left anterior descending artery and tying a slip knot,the left myocardium can be seen white;E and F:the ligature is passed through a 0.5 cm long polyethylene tube;G and H:hook the ligature through the skin with the help of hooks and pulleys.圖1 大鼠MIRI模型改良置管法
3.4 大鼠心臟缺血/梗死面積觀察 再灌注90 min末麻醉大鼠,再次結(jié)扎冠脈左前降支后腹腔靜脈注射2 mL 2%EB,待周身藍染后迅速摘取心臟,清潔灌洗并冷凍后,使用心臟切片槽將結(jié)扎以下部位切割呈5片,每片厚度2 mm。將切片放置1%TTC溶液中37 ℃避光孵育約15~20 min后多聚甲醛固定過夜;數(shù)碼相機拍照后使用ImageJ 軟件分析。白色為梗死區(qū)域(infarction area,IA),非藍色區(qū)域為缺血區(qū)(area at risk,AAR)。梗死面積(%)=IA/AAR;缺血面積(%)=AAR/左心室區(qū)(left ventricule,LV)。
3.5 心肌酶學指標檢測 再灌注末大鼠經(jīng)腹主動脈取血,靜止并分離血清后,采用全自動生化儀檢測血清LDH 和CK-MB 活性,并按照說明書采用酶聯(lián)免疫吸附試驗檢測血清cTnI含量。
3.6 心臟組織損傷病理染色及觀察 造模完成后取材并將組織于4%多聚甲醛固定24 h。依次入梯度乙醇、醇苯混合液、二甲苯,觀察至充分透明。烤片整修,組織膜放在45 ℃的水中展開,用多聚賴氨酸載玻片撈片,二甲苯脫蠟、梯度乙醇水化,放入蘇木素染色,水洗,放入伊紅染色30 s,依次梯度乙醇脫水、二甲苯脫蠟至透明,后用中性樹膠封片,顯微鏡下觀察并拍片。
3.7 心臟組織細胞凋亡染色 預冷0.9%氯化鈉液清洗缺血區(qū)心肌組織,置于4%多聚甲醛固定8 h 后脫水包埋切片。按TUNEL 試劑盒方法進行操作,最后采用DAPI 染料染核。熒光顯微鏡拍照并使用ImageJ軟件計算心肌組織細胞凋亡率。
4 統(tǒng)計學方法
所有數(shù)據(jù)均采用SPSS 24.0 進行統(tǒng)計學處理。計量資料符合正態(tài)分布的以均數(shù)±標準差(mean±SD)進行統(tǒng)計描述;對于多組資料符合正態(tài)分布的數(shù)據(jù)采用單因素方差分析,多重兩兩比較采用LSD 法(方差齊)或鄧尼特T3 法(方差不齊)檢驗。以P<0.05 為差異有統(tǒng)計學顯著性。采用GraphPad Prism 8.0軟件進行圖表制作。
結(jié) 果
1 改良置管法造模過程心電圖表現(xiàn)
OM 組大鼠心電圖ST 段可在數(shù)分鐘內(nèi)迅速顯著抬高,并持續(xù)至缺血30 min,偶發(fā)嚴重室性心動過速或心室顫動,造模存活12只,造模成功12只,存活率80%,模型成功率為80%。TM 組大鼠心臟結(jié)扎10 min 后,心電圖ST 段開始逐漸抬高,并在缺血30 min內(nèi)持續(xù)抬高,較少出現(xiàn)室性心律失常,造模存活14只,造模成功9 只,存活率93%,造模成功率為60%。在各造模時點,OM 組心電圖ST 段抬高幅度均較TM組更顯著,且迅速達到峰值,見圖2。
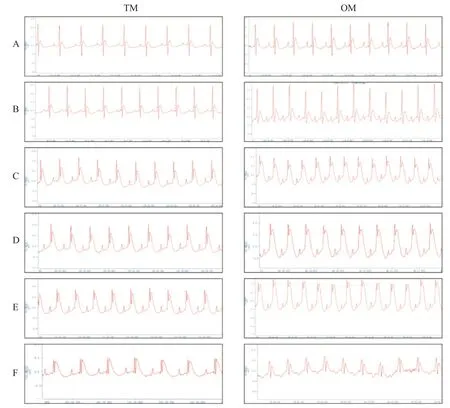
Figure 2. Comparison of electrocardiograms of different modeling methods. A:after anesthesia;B:after endotracheal intubation;C:10 min after ligation;D:20 min after ligation;E:30 min after ligation;F:reperfusion for 90 min.圖2 不同造模方法的心電圖比較
2 改良置管法對大鼠心肌梗死面積的影響
各組非藍區(qū)域比例無顯著差異,表明結(jié)扎定位穩(wěn)定且一致性良好;TM 組和OM 組大鼠心梗面積比例均顯著高于sham 組(P<0.01),且OM 組心梗面積比例顯著高于TM組(P<0.01),見圖3、4。

Figure 3. The optimized method(OM)increased myocardial infarction area in rats. The representative images of Evans blue/TTC staining in myocardial tissues(scale bar=2 mm).圖3 大鼠心臟伊文思藍/TTC染色
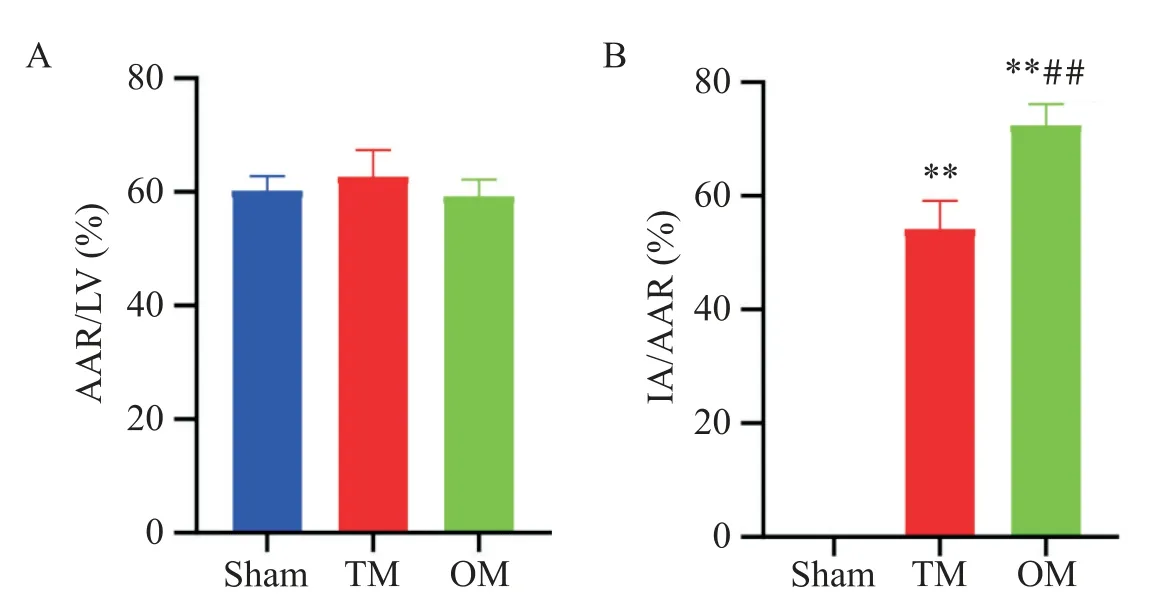
Figure 4. Comparison of cardiac ischemia/infarct size of rats in each group. A:the ratio of area at risk(AAR)/left ventricule(LV);B:the ratio of infarction area(IA)/AAR. Mean±SD. n=3.**P<0.01 vs sham group;##P<0.01 vs TM group.圖4 各組大鼠心臟缺血/梗死面積比較
3 改良置管法對大鼠血清LDH、CK-MB和cTnI的影響
TM 組和OM 組血清心肌酶學指標水平(LDH、CK-MB、cTnI)均較假手術組升高(P<0.01),且OM組上述心肌酶學指標水平均顯著高于TM組(P<0.05),見圖5。
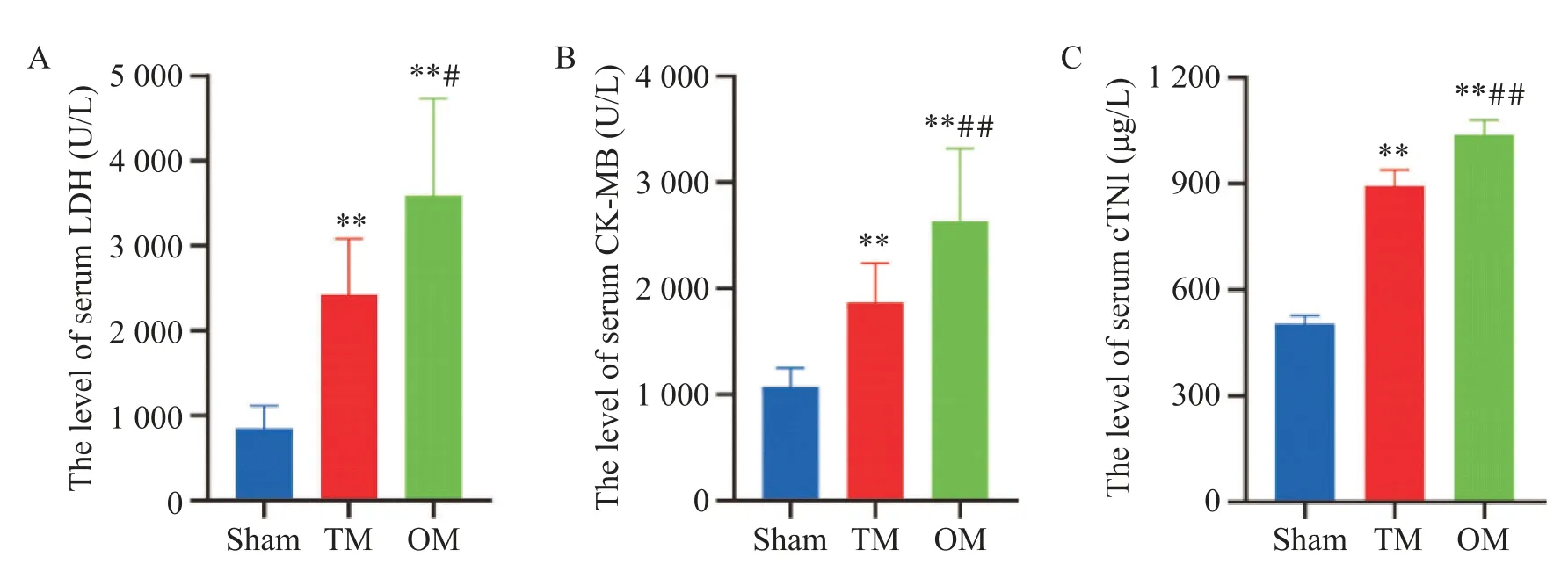
Figure 5. The optimized method(OM)increased the levels of myocardial injury markers in rats. A:the level of serum lactate dehydrogenase(LDH);B:the level of serum creatine kinase isoenzyme MB(CK-MB);C:the level of serum cardiac troponin I(cTnI). Mean±SD. n=6.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs TM group.圖5 各組大鼠血清心肌酶水平比較
4 改良置管法對大鼠心臟組織損傷的影響
HE染色結(jié)果顯示,sham 組顯示心肌細胞纖維排列整齊、肌節(jié)清晰緊密,大小一致,形狀規(guī)則;TM 組可見部分心肌細胞紊亂、心肌纖維斷裂,間質(zhì)水腫和白細胞浸潤;OM組上述病理損傷較TM組嚴重,大部分心肌細胞腫脹變形,肌絲斷裂,組織間隙水腫和白細胞浸潤較明顯,見圖6。
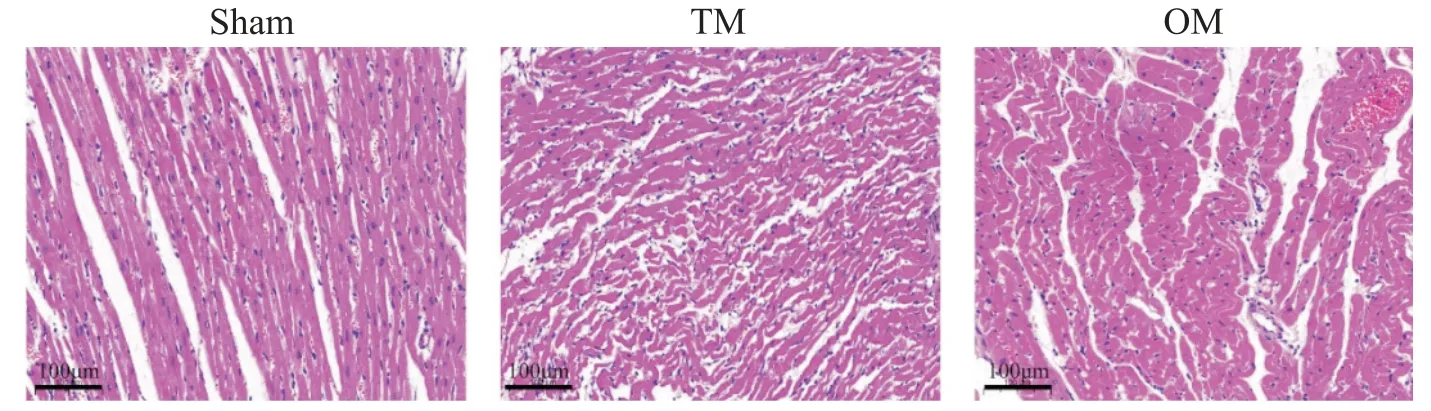
Figure 6. The optimized method(OM)increased the extent of myocardial tissue injury. The representative images of HE staining in cardiac tissues(scale bar=100 μm).圖6 大鼠心肌組織HE染色
5 改良置管法對大鼠心臟組織細胞凋亡的影響
TM 組和OM 組心肌組織細胞凋亡率均顯著高于sham 組(P<0.01),且 OM 組 平 均 細 胞 凋 亡 率(35.86%)顯著高 于 TM 組(26.48%;P<0.01),見圖7。
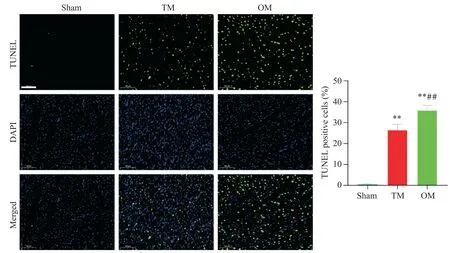
Figure 7. The optimized method(OM)aggravated the apoptosis of myocardial tissue in rats. The representative images of TUNEL staining in heart tissues(scale bar=100 μm;blue showed the nuclei of total cells)and the calculation of apoptotic rate.Mean±SD. n=6.**P<0.01 vs sham group;##P<0.01 vs TM group.圖7 大鼠心肌組織TUNEL染色
討 論
MIRI疾病動物模型在MIRI研究中至關重要,雖然使用大型哺乳動物如小型豬、比格犬等進行MIRI模型制作似乎更類似人類發(fā)病及其病理生理過程,但大鼠、小鼠等嚙齒類動物不僅與人類基因高度同源,且價格相對低廉、易獲得,故成為MIRI 造模的首選動物類別。目前,大鼠MIRI 造模方法可分為體內(nèi)模型和離體心臟模型(Langendorff 體外循環(huán)模型),由于體內(nèi)模型受到整體內(nèi)分泌、神經(jīng)、免疫等系統(tǒng)調(diào)節(jié)的影響而更貼近實際損傷情況,故多被采用。常規(guī)大鼠MIRI 造模過程包括:氣管切開插管接小動物呼吸機輔助通氣,切開皮膚,剪斷3、4 肋骨開胸,定位結(jié)扎部位,使用相應針線鉤起左前降支結(jié)扎,一段時間后松開結(jié)線以實現(xiàn)再灌注[2]。在此過程中主要難點有:機械通氣、開胸創(chuàng)口、結(jié)扎定位和結(jié)扎線松緊程度。
1 機械通氣
常規(guī)采用氣管切開插管進行輔助通氣,這種做法創(chuàng)傷大,造模后易因氣管縫合困難而發(fā)生呼吸困難或嚴重感染。目前有方法選擇氣管內(nèi)插管,雖然其創(chuàng)傷較小,但順利進行氣管插管仍有一定困難,盲插易導致大鼠氣管損傷、反復缺氧甚至氣胸窒息[4]。甚至有方法不需要進行機械通氣,采用外擠心臟方式結(jié)扎,利用極短的開胸及關胸的時間差進行冠脈結(jié)扎,這對操作者的熟練程度要求相當高,技術操作難度大[5]。本實驗借助新生兒咽喉鏡,在咽喉鏡直視下聯(lián)合頸外光源照透,見聲門開啟即迅速將氣管導管插入,此法方便、快捷、無創(chuàng)傷且一次成功,極大地減少了因氣管插管所造成的干擾[6-8]。
2 開胸創(chuàng)口
開胸操作的質(zhì)量可對研究結(jié)果造成直接影響[9]。傳統(tǒng)方法多采用縱向切開方式,剪斷胸大肌、肋間肌并至少2 根肋骨以較大創(chuàng)口暴露心臟并極易損傷動脈。本研究采用1.0 cm橫向切口并鈍性分離肌肉、肋間肌,只需剪斷第3 肋骨并借助小動物開胸器即可完整暴露心臟,縮小了手術創(chuàng)口,最大程度避免肋間動脈損傷而造成出血并增加了關胸時組織縫合的緊密度。
3 冠脈左前降支定位
MIRI 模型組的心臟需要有顯著的梗死區(qū)域,同時也不能導致缺血區(qū)內(nèi)心肌完全死亡。因為如果模型組心肌梗死面積比例非常小或非常大,那么任何干預措施的挽救范圍和實現(xiàn)心臟保護的可能性都微不足道[10]。在一定缺血再灌注時間內(nèi)誘導相對足夠心肌梗死區(qū)域的結(jié)扎策略對于心臟保護藥物的研究較為關鍵。有文獻報道冠狀動脈常伴行靜脈,沿靜脈下往寬處結(jié)扎即可,但因冠狀動脈走形變異性較大,此法常難以定位準確。雖然大鼠冠狀動脈常隱藏于心肌淺肌層下難以識別,但往往從肺動脈圓錐和左心耳之間發(fā)出,故結(jié)扎部位常選擇在左心耳和肺動脈圓錐間往下2~4 mm處[11-12]。本研究進針后輕提起心肌可見白色細條線狀血管,若扎下第一個十字結(jié)可見其下供血的心肌發(fā)白,心電圖ST 段抬高,則表明冠脈左前降支結(jié)扎定位準確。
4 結(jié)扎方式
常規(guī)MIRI 造模常因結(jié)扎打死結(jié)而再灌注時使用手術尖刀挑線難免傷及心肌組織造成大出血,或因拉扯結(jié)線切斷冠狀動脈而造成永久梗死無法再通。而墊管或墊線結(jié)扎法則是為避免再灌注時因解開結(jié)線損傷心肌而設,有報道顯示其成模率80%~90%左右[11,13-15]。但實際操作過程中需要長期積累手感,常因結(jié)扎松緊程度難以精確把握,或活結(jié)沒扎緊,或扎有軟管、魚絲線、棉線等線結(jié)易隨心臟搏動而出現(xiàn)松動等情況,導致造模效果不確切,梗死區(qū)域難以統(tǒng)一或達到研究要求。
本方法參考 Kim 等[3]關于小鼠 MIRI 的造模方法并進行調(diào)整,采用穿管法將線兩端穿過一長約0.5 cm 的聚乙烯管并將線兩端經(jīng)過胸壁肌肉穿出皮外,采用滑輪、拉鉤吊起使軟管上端頂住胸壁而下端壓向心臟造成冠脈血流中斷,因為有持續(xù)的外部拉力,在心臟缺血過程中不易因線結(jié)松動而造成結(jié)扎效果不確切。本方法相較于熟練的墊線結(jié)扎法,心電圖ST段短時間內(nèi)即可抬高至峰值并保持不回落且心梗面積范圍更大,可見其缺血效果確切;在心肌損傷效果上,本方法心肌酶學指標水平較TM 組更高,且心肌組織損傷更明顯,心肌細胞凋亡率達到35.86%,顯著高于TM 組的26.48%,表明采用本方法進行大鼠MIRI 造模可獲得更充分可靠的缺血再灌注損傷效果。
然而,本方法仍有其難點或不足之處:(1)聚乙烯管的穿出胸壁的位置需要調(diào)整好以確保牽拉時軟管下端能垂直壓向心臟,從而直接壓迫冠脈造成缺血;(2)牽拉的強度不能太大,一般為5 個裝滿水的2 mL 離心管的重力,強度太大易誘發(fā)室性心律失常;(3)若觀察牽拉后未出現(xiàn)ST 段抬高,若冠脈左前降支定位無誤,則可調(diào)整軟管下端位置使其垂直壓向心肌,否則應重新定位;(4)MIRI 時由心臟交感神經(jīng)激活觸發(fā)的室性心律失常與心肌梗死程度有關[16-17],本方法的致死性室性心律失常的發(fā)生率稍高,考慮可能與其相對嚴重的心肌梗死和組織損傷有關。如借助其他儀器如光纖氧測量系統(tǒng)檢測局部心肌氧含量變化,則有助于模型缺血程度的監(jiān)測和定量化[18]。
總之,采用改良置管法進行MIRI 造模采提高了技術操作的簡易性,減少了心臟外組織損傷及相關干擾因素,提高了模型的穩(wěn)定性和可靠性,值得在MIRI模型中應用推廣。

