多酚與蛋白相互作用對蛋白特性影響研究進展
徐夢婷 郝艷賓 齊建勛 丁保淼 陳永浩
蛋白質是人體所需的六大營養素之一,主要存在于畜禽肉、奶類、蛋類、谷物、豆類等食物中。在以蛋白質為主要組分的食品體系中,蛋白質可與碳水化合物、脂肪、無機鹽等相互作用,共同決定食品體系的營養特性和感官特性。具有抗氧化活性的酚類物質同樣可與蛋白組分形成復合物,使蛋白在結構、功能和營養特性等方面發生變化。
多酚作為植物源食品原料的重要組成成分,廣泛存在于核桃、花生、杏仁、栗仁、谷物、豆類中。在很多植源性食品加工中,多酚組分往往需要脫除以減少給產品帶來色澤、風味等方面的不利影響。但多酚組分的脫除不僅增加了加工成本,還減少了多酚的營養價值。因此,如何使多酚與蛋白在食品體系中共存是植源性食品加工領域的研究熱點。此外,多酚對蛋白特性的影響也受到不少研究者關注。目前,有關多酚與蛋白相互作用的研究主要集中在多酚生物可及性[1]、運載體系功能活性[2]等方面,研究擬在聚焦食品原料體系中多酚與蛋白質之間的相互作用對蛋白質特性的影響,著重闡述多酚與蛋白質相互作用對蛋白結構、加工特性等方面的研究進展,以期為相關食品的研究和開發提供理論依據。
1 多酚與蛋白質相互作用
多酚與蛋白質的相互作用取決于蛋白質和多酚的結構與類型,同時也受溫度和pH的影響[3],多酚和蛋白質的結合機制涉及共價作用、非共價作用、共價—非共價的相互作用。目前用于鑒定蛋白質和多酚相互作用的方法包括熒光猝滅、圓二色譜、傅里葉變換紅外光譜、掃描電子顯微鏡、反相高效液相色譜、電噴霧電離質譜、X射線衍射分析等[4]。
1.1 非共價作用
非共價相互作用一般是可逆的,并且比共價對應物弱。通常,氫鍵和疏水相互作用是多酚和蛋白質發生非共價結合時的主要作用力[5-6],離子鍵在蛋白質和多酚相互作用中起次要作用,如圖1所示。例如,Xu等[8]研究表明茶黃素通過疏水相互作用與β-乳球蛋白的Met-107、Asn-90、Asn-88、Leu-87、Ala-86、Lys-69、Lys-60、Val-41和Leu-39殘基相互作用。Jiang等[9]觀察到新橙皮苷二氫查耳酮和α-乳清蛋白的相互作用主要是依靠疏水相互作用。此外,多酚中的羥基有助于多酚與氨基酸殘基的潛在氫結合。例如,表兒茶素(epicatechin,EC)B環上的羥基可通過氫鍵與唾液中富含脯氨酸的蛋白質中的羰基或酰胺基團結合[10]。兒茶素也可以通過氫鍵與大豆7S蛋白的Trp328、Gln365、Asn369和Asp334結合[11]。此外,離子鍵也會參與多酚和蛋白質之間的相互作用。Carnovale等[12]發現,鈣的存在會影響αS1-酪蛋白和EGCG之間的相互作用,隨著鈣離子的加入,去質子化的EGCG可通過離子鍵與αS1-酪蛋白上的羧基或磷酸基團形成橋接,導致粒徑的大幅增加。
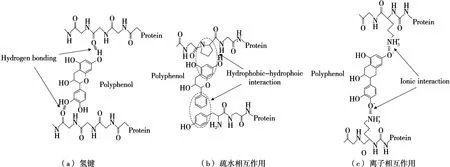
圖1 蛋白質和多酚的非共價結合[7]Figure 1 Noncovalent conjugation of proteins and polyphenols
此外,研究[13]表明,熱力學參數可用于確定多酚和蛋白質之間的結合類型。焓和熵大于零(ΔH>0,ΔS>0)的變化被用來表示疏水相互作用,焓和熵小于零(ΔH<0,ΔS<0)的變化被用來表示范德華力和氫鍵,而焓小于零、熵大于零(ΔH<0,ΔS>0)的變化被用來表示靜電相互作用。例如,膠原蛋白和沒食子酸自由能變化(ΔG)全部小于0,表明鍵合過程是自發的。此外,溫度也會影響多酚和蛋白質之間非共價相互作用的類型。據報道[14],在EGCG與β-乳球蛋白的復合物中,范德華力和氫鍵作用在60 ℃以上出現,而靜電相互作用在85 ℃以上出現。
1.2 共價作用
共價鍵是多酚和蛋白質之間不可逆結合的結果。多酚與蛋白質之間出現共價鍵主要是因為醌或半醌自由基的形成。多酚在堿性條件下容易被氧化成半醌自由基,隨后半醌自由基重新排列成醌。同時由于醌類物質具有親電性,它們可以與蛋白質分子上的親核基團反應,從而形成共價鍵。豬血漿蛋白水解物與氧化酚類化合物之間,通過C—S或C—N共價鍵與多肽的巰基或氨基側鏈形成二聚體或共價偶聯物,誘導了蛋白質的微聚集[15]。因此,巰基和氨基的減少被認為是蛋白質共價修飾的標志。例如,Liu等[16]研究結果表明蛋白質中巰基和游離氨基含量降低且偶聯物分子量增加,這證實了乳清蛋白分離物與多酚之間形成了共價鍵。Yang等[17]研究發現南瓜籽分離蛋白和焦沒食子酸之間的共價相互作用依賴于蛋白質的游離氨基,由于氧的存在,焦沒食子酸相鄰的兩個酚羥基被氧化形成鄰醌,然后鄰醌被蛋白質側鏈上的氨基還原,導致蛋白質和焦沒食子酸之間形成C—N共價鍵。此外,在高溫條件下多酚和蛋白質也可能發生共價結合[18]。據報道[19],大蒜素與乳清蛋白b-乳球蛋白在高溫處理條件下發生了共價結合,導致蛋白質二級結構發生變化,以及氨基酸暴露程度增加。
多酚的羥基和芳香環的數量決定了其與蛋白質共價相互作用的程度。據報道[20],與苯甲酸衍生物相比,肉桂酸衍生物與蛋白質會形成更多的共價鍵。此外,多酚的濃度也會影響與蛋白質共價相互作用的穩定性。例如,低濃度的氧化EGCG由于交聯與大豆分離蛋白形成穩定的網絡結構,而高濃度的氧化EGCG會使蛋白質反應位點飽和從而阻礙交聯[21]。
2 多酚與蛋白質相互作用對蛋白結構的影響
多酚和蛋白質的相互作用會改變天然蛋白質的二級、三級、晶體和微觀結構。例如,綠原酸和乳清蛋白分離物非共價結合導致無序結構形成,具體表現為α-螺旋和β-折疊含量減少,β-轉角和無規卷曲含量增加[22]。其中氫鍵是維持α-螺旋結構的主體力量,因此α-螺旋構象的變化與蛋白質疏水區域內氫鍵與多酚結合有關,而β-折疊含量的減少則與蛋白質疏水性區域展開后蛋白質位點暴露增加有關,特征結構的變化使得蛋白質變得高度無序。但多酚和蛋白質絡合也可以誘導蛋白質形成有序結構,例如,樟樹籽仁蛋白和酚類化合物通過共價結合導致β-折疊增加(從19.81%增加到21.39%)和無規卷曲減少(從26.07%減少到24.87%)[23]。
有研究[24]表明,與天然蛋白質相比,多酚的濃度、類型、結構和反應pH值會導致多酚—蛋白復合物的二級結構發生變化。例如,單寧酸、沒食子酸和EGCG這些多酚主要通過氫鍵與肌原纖維蛋白(myofibrillar protein,MP)相互作用,使MP的二級結構展開并降低了MP的表面疏水性,而槲皮素和槲皮苷主要通過靜電相互作用與MP發生相互作用,從而保留了α螺旋結構,提高了蛋白表面疏水性[25]。pH值對多酚和蛋白質之間相互作用影響主要體現在結合位點上,當pH<7.0時,蛋白質發生解離,導致蛋白質與多酚相互作用的結合位點暴露,因而蛋白質具有更強的親和力。例如,牛血清白蛋白在pH 4.9 下與單寧酸結合的親和力高于pH 7.8時的[26]。
熒光光譜法可以廣泛用于監測與多酚相互作用后,天然蛋白質三級結構的變化,具體變化表現為蛋白質的最大發射波長發生紅移,例如,乳清蛋白分離物的最大熒光發射波長為335.8 nm,與酚類化合物結合后最大發射波長發生了紅移,并且與對照組相比,酚類化合物和乳清蛋白分離物的絡合物的熒光強度明顯降低。這些現象表明,多酚和蛋白相互作用誘導了乳清蛋白分離物三級結構的變化[27]。此外,最大發射波長的紅移還可能與芳香族氨基酸殘基周圍局部環境極性的變化有關。例如,扁豆蛋白與槲皮素、鞣花酸和蘆丁的相互作用未出現紅移,主要是由于扁豆蛋白的芳香族氨基酸殘基極性環境無太大變化[28]。
與天然蛋白質相比,多酚和蛋白復合物具有更高的結晶度、更大的晶體尺寸以及具有更大的片狀結構和更光滑的表面。這也進一步證明多酚和蛋白的相互作用會使有序蛋白質結構發生扭曲。例如,單寧酸和沒食子酸二者均通過疏水相互作用改變了酪蛋白的微觀結構,分別使酪蛋白形成了致密和松散的結構。綜上,多酚和蛋白相互作用會對蛋白結構產生至關重要的影響,從而引起蛋白特性的改變。
3 多酚與蛋白質相互作用對蛋白特性的影響
表1例舉了一些多酚和蛋白質相互作用的例子及二者相互作用對蛋白特性的影響。
3.1 對溶解性的影響
由表1可知,蛋白質與多酚相互作用可以增加或減少蛋白質的溶解性。例如,綠原酸通過非共價相互作用與酪蛋白和乳清分離蛋白相互作用形成復合物,導致酪蛋白和乳清分離蛋白的溶解度顯著提高[29];MP與槲皮素的偶聯暴露了蛋白質內部的疏水氨基酸以及增加了α螺旋含量,在MP中產生更多的疏水位點,導致MP溶解度降低[25]。類似研究[30]還有MP在茶多酚存在下溶解度顯著降低,主要是由于茶多酚會導致MP聚集,使最初可溶性MP形成更大的不溶性MP聚集體。因此,單個肌原纖維蛋白分子和多酚之間的相互作用會導致蛋白質的溶解性降低。

表1 蛋白質—多酚相互作用對結構變化和蛋白特性的影響Table 1 Effects of protein-polyphenol interactions on structural changes and protein characteristics
3.2 對凝膠性的影響
由表1可知,多酚和蛋白質的相互作用會引起凝膠性能發生變化。例如,交聯明膠—多酚顯著增強了凝膠強度,并且使表面更緊湊[38];酶促反應制備的墨魚皮明膠和沒食子酸的偶聯物提高了墨魚皮明膠的凝膠強度[31]。此外,據報道[39]茶多酚也能促進β-乳球蛋白的變形和聚集性,使β-乳球蛋白凝膠的相對黏彈性降低,并通過較低的膠凝溫度和較短的膠凝時間證明了凝膠化的增強。綜上,不同類型的蛋白質和多酚相互作用可改善凝膠性能。
然而,Tang等[32]發現,通過自由基移植法制備的迷迭香酸—蛋白質復合物對MP凝膠化產生不利影響。迷迭香酸—半胱氨酸相互作用阻斷了MP上硫醇基團形成二硫鍵交聯,并通過破壞蛋白質凝膠化削弱凝膠強度。Jia等[40]研究發現,添加兒茶素后,MP的凝膠強度與對照組相比明顯降低,且添加的兒茶素濃度越高,MP凝膠強度下降越顯著。
3.3 對熱穩定性的影響
由表1可知,多酚和蛋白質的相互作用會引起產物的熱穩定性發生變化。例如,糖化MP-EGCG偶聯物的肌球蛋白和肌動蛋白表現出高的熱變形溫度,分別為67.52,72.94 ℃,明顯高于對照MP的值,表明EGCG可以提高糖化MP的熱穩定性[41];亞麻籽分離蛋白與酚類化合物的共價結合顯著提高了亞麻籽分離蛋白的變性溫度,表明復合物熱穩定性增加[33]。因此,多酚和蛋白質的相互作用對熱穩定性有積極影響。多酚與蛋白質相互作用也會導致焓變化。例如,阿魏酸(ferulic acid,FA)與牛血清蛋白(bovine serum albumin,BSA)相互作用后熔點溫度升高,表明BSA與FA絡合時牛血清蛋白的熱穩定性增加[34]。另外,乳鐵蛋白與多酚(綠原酸和EGCG)的結合也可以抑制乳鐵蛋白在中性pH下的熱聚集[35]。因此,動物蛋白和多酚相互作用是增強經過熱處理的蛋白質穩定性的潛在技術。
3.4 對乳化性的影響
控制乳化性能的關鍵因素是蛋白質的表面疏水性,較高的表面疏水性可以增強乳化性和穩定性。多酚和蛋白質的偶聯可以增加蛋白質的表面疏水性,從而增強天然蛋白質的乳化性。例如,Abd El-Maksoud等[36]將咖啡酸與β-乳球蛋白在堿性條件下共價偶聯,所得的復合物顯示出比天然β-乳球蛋白更好的乳化性能;Chen等[15]研究表明當氧化綠原酸和氧化單寧酸加入豬血漿蛋白水解物中時,水解物的乳化活性指數和乳液穩定性指數顯著增加,可能原因是豬血漿蛋白水解物與氧化綠原酸的復合物可以迅速吸附在界面上,并在油滴周圍形成更厚的界面膜,從而增強乳化性能。然而,多酚和蛋白質相互作用也會對乳液乳化性產生負面影響,但對乳液穩定性產生積極影響。例如,Chen等[42]觀察到卵清蛋白和單寧酸的相互作用對蛋白質的疏水基團產生了掩蔽作用,從而降低了卵清蛋白在其等電點附近的界面活性,并通過延緩乳液在卵清蛋白等電點的乳化作用,提高了乳液的穩定性。
3.5 對致敏性的影響
多酚和蛋白質的相互作用可降低蛋白致敏性。食品過敏反應通常由免疫球蛋白E(Immunoglobulin E,IgE)介導引起[43],而蛋白質—多酚復合物可通過改變蛋白質結構,允許消化酶破壞IgE結合表位,使抗原表位在消化過程中不被含有過敏原特異性IgE的肥大細胞和嗜堿性粒細胞識別[44]。例如,Wu等[37]研究發現β-乳球蛋白與EGCG和綠原酸結合后β-乳球蛋白的致敏能力降低;Plundrich等[45]用蔓越莓或藍莓多酚修飾花生蛋白,發現IgE與花生蛋白的結合降低了38%。因此,讓多酚與食物中蛋白質相互作用可能是生產低過敏性食物的新思路。
3.6 對抗氧化活性的影響
諸多研究表明,多酚和蛋白質相互作用形成的復合物比天然蛋白質表現出更好的抗氧化活性。例如,Fan等[46]采用自由基誘導的嫁接法制備了BSA和咖啡酸(CA)復合物,BSA-CA復合物的DPPH自由基清除活性顯著高于BSA,表明BSA-CA復合物抗氧化活性顯著提高;Jing等[47]研究發現通過使用堿性/自由基方法與茶多酚共價結合,蛋清蛋白的抗氧化活性顯著提高;乳清蛋白分離物(whey protein isolate,WPI)和4種多酚(EGCG、QC、AG和NC)的偶聯物與未修飾的WPI相比,WPI-EGCG、WPI-QC、WPI-AG和WPI-NG的DPPH自由基清除活性分別顯著提高了42.26%,34.20%,26.56%,34.41%,即所有偶聯物都表現出更高的抗氧化活性[16]。多酚和蛋白質復合物的溶解度變化會影響蛋白抗氧化活性。例如,Pham等[48]報道亞麻籽蛋白分離物(FPI)與酚類化合物(亞麻籽多酚和羥基酪醇)絡合顯著改變了FPI的溶解度,并且與FPI穩定乳液相比,酚醛配合物乳液具有更高的抗氧化穩定性。因此,蛋白質的抗氧化活性可以通過與多酚形成復合物來增強,從而改善食品的氧化穩定性。
4 結語
多酚與蛋白之間的相互作用可以是非共價的,比如疏水相互作用或氫鍵等;也可以是在多酚轉變成醌或半醌自由基后與蛋白質進行的共價結合。二者之間的相互作用受蛋白質和酚類化合物類型、溫度和pH的共同影響,最終引起蛋白質特性的改變。未來在多酚與蛋白相互作用的機理研究方面,進一步明確不同種類的多酚及混合多酚與特定蛋白組分之間的相互作用機制是該領域的重要研究方向,在應用層面,通過多酚與蛋白相互作用研究,調控食品加工和貯運過程中蛋白的特性,為開發多酚與蛋白等多組分共存的食品奠定基礎,更好地發揮多酚和蛋白兩種組分的有益作用,同時減少在原料處理階段多酚與蛋白的分離,簡化操作單元設置,降低生產成本,這也將是未來發展方向之一。

