固相阻斷ELISA法檢測口蹄疫病毒O型抗體的不確定度評定
王佳璟,何學東,楊 芳
(浙江康嘉基因技術有限公司,浙江 杭州 310021)
口蹄疫病毒(FMDV)屬于小RNA病毒科口瘡病毒屬。目前有7個血清型,各型之間幾乎沒有交叉免疫保護力,因此,每次爆發后只能屠宰和集體焚毀染病牲畜以絕后患。由于口蹄疫傳播迅速、難于防治、補救措施少,被稱為畜牧業的“頭號殺手”,為我國強制免疫的動物疫病[1-2]。實際生產中,常使用ELISA檢測方法進行口蹄疫的免疫情況監督和診斷[3-4]。
測量不確定度[5-6]簡稱不確定度,是各種不確定度的一個總稱或通稱,包括:標準不確定度[7]、合成不確定度[8]、擴展不確定度[9]、相對不確定度[10]、A類不確定度[11]、B類不確定度[12]等。不確定度是指測量結果的可疑程度,是測量結果可疑程度的一種定量表述,可定量說明實驗室的測量能力水平。只有在得到不確定度的值后,才能明確被測量真值所處范圍及這個范圍的大小。為向養殖戶提供更好的免疫參考意見和更精準的診斷結果,實驗室需要進行不確定度評定[13-14]。
本文擬以探討血清實驗室固相阻斷ELISA法檢測口蹄疫病毒O型抗體[15-16]的不確定度評定為例,介紹ELISA試驗測量不確定度的兩種方法:“影響因素分析法”[17]和“對照樣品法”[18]。
1 材料與方法
儀器:Eppendorf 10-100 μL單、8道可調移液器;Eppendorf 30-300 μL 8道可調移液器;上海博訊BPS-100生化培養箱;TECAN Infinite F50酶標儀。
試劑:口蹄疫病毒(FMDV)O型抗體ELISA檢測試劑盒(固相阻斷ELISA法,北京金諾百泰生物技術有限公司,批號:20211203)。
操作步驟:試驗前將試劑盒所有組分恢復至室溫,10x濃縮洗滌液進行10倍稀釋,用樣品稀釋液5倍稀釋待檢樣品,對照樣品同樣方法稀釋。
(1)取出抗原包被板,在記錄表上記錄樣品的位置。
(2)在包被孔內分別加入100 μL已稀釋好的陰性對照和陽性對照,重復兩孔。在相應孔中加入100 μL已稀釋好的樣品,注意每個樣輕彈微量反應板或用振蕩器振蕩,將反應板中的溶液混勻。
(3)蓋上封膜板,室溫25 ℃下孵育1 h。
(4)棄去孔內液體,每孔加入300 μL洗滌液,洗滌3次,每次洗滌后,甩掉孔內的液體,在吸水材料上輕扣板。在最后一次甩干后,徹底拍去剩余的液體。在加入下一個試劑前,避免孔壁過干。
(5)每孔加入100 μL FMDV O型酶標抗體,蓋上封模板,室溫25℃下孵育1 h。
(6)重復1.3.6洗板步驟。
(7)每孔加入100 μL TMB顯色液。
(8)室溫25 ℃孵育15 min。
(9)每孔加入50 μL終止液,終止反應。
(10)利用酶標儀測量450 nm處被檢樣品OD值并記錄。
結果計算與判定:陰性對照OD450平均值>0.7;陽性對照S/N平均值<0.3;如果檢測結果不在界定范圍需要重新進行檢測。
(1)樣品S/N=樣品的OD值/陰性對照的OD平均值。
(2)S/N值>0.5,樣品為陰性;S/N值≤0.5,樣品為陽性。
2 影響因素分析法
2.1原理 通過對口蹄疫病毒O型抗體固相阻斷ELISA檢測的過程分析,找出檢測過程中的不確定度的來源并進行系統分析,對各不確定度分量進行評定,給出該測量方法的合成不確定度及擴展不確定度。
2.2不確定度來源分析 不確定度評定包括加樣時所用移液器的標準不確定度;環境溫度引入的不確定度;酶標儀的不確定度;檢測過程中因實際操作引入的不確定度(未知的隨機因素)。
2.2.1A類不確定因素 由于本實驗室使用ELISA檢測口蹄疫病毒O型抗體,使用的是同一試劑盒同一樣本,稀釋倍數為5倍稀釋,環境溫度保存在25 ℃,由同一檢測員進行檢測,使用的移液器、酶標儀均為同一套,因此本實驗室使用ELISA檢測口蹄疫病毒O型抗體,除未知的隨機因素,無其他A類不確定因素。由隨機誤差引起的,通過重復檢測樣品,其檢測數據呈正態分布,可以采用統計方法分析,以此計算樣本的均值、標準差和相對標準偏差。通過重復測定樣品獲得的相對標準偏差即樣品的標準不確定度。本方法不確定度的分量來源包括樣品標準偏差引起的A類標準不確定度,對同一份樣品平行檢測10次,檢測結果見表1。
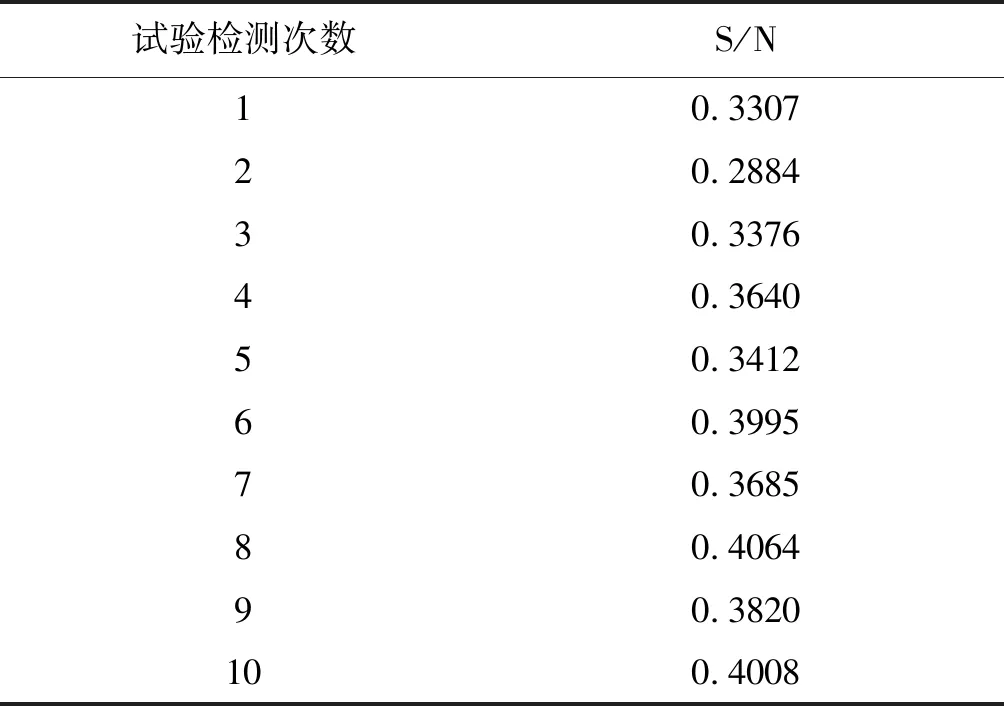
表1 血清中口蹄疫抗體(O型)的測定結果
檢測結果的平均值:
標準偏差:
標準不確定度:
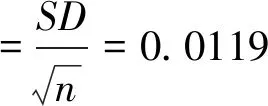
2.2.2移液器引入的不確定度(B類)
2.2.2.1 移液器加樣的相對標準不確定度 試驗中涉及到的移液器包括10-100 μL單道以及8道、30-300 μL 8道移液器等進行試劑和樣品的添加,移液器在30 μL (稀釋)、120 μL(稀釋)、100 μL(加樣)、100 μL(酶標二抗)、100 μL(底物)檢定點或最近量程的容量U為2%、0.3%、0.3%、0.3%和0.3%,標準不確定度按照JJF 1059.1-2012測量不確定度評定,根據4.3.3.1表示公式為:
a:被測量可能值區間的半寬度,如根據廣州廣電計量檢測股份有限公司的校準證書計算獲得U,則a=加樣量×U;
k:根據正態分布情況下,p為95%獲得的k稱置信因子,可根據移液器校準證書k=2。
移液器各加樣的標準不確定度為:
U(30稀釋)=30 μL×2%/2=0.3000 μL
U(120稀釋)=120 μL×0.3%/2=0.1800 μL
U(100加樣)=100 μL×0.3%/2=0.1500 μL
U(100酶標二抗)=100 μL×0.3/2=0.1500 μL
U(100底物)=100 μL×0.3/2=0.1500 μL
移液器加樣的相對標準不確定度為:
U(移液器)=[U2(30稀釋)/302+U2(120稀釋)/1202+U2(100加樣)/1002+U2(100酶標二抗)/1002+U2(100底物)/1002]1/2=0.0104 μL
2.2.2.2 溫度效應產生的不確定度 水的膨脹系數為2.1×10-4/℃,實驗室溫度在(25±3)℃,按照分布計算加樣的標準不確定度為:
U(T30)=30 μL×3×2.1×10-4=0.0189 μL
U(T120)=120 μL×3×2.1×10-4=0.0756 μL
U(T100)=100 μL×3×2.1×10-4=0.0630 μL
U(T酶標二抗)=100 μL×3×2.1×10-4=0.0630 μL
U(T底物)=100 μL×3×2.1×10-4=0.0630 μL
則溫度對稀釋、加樣、酶標二抗、底物的相對標準不確定度為:
u(T)=[U2(T30)/302+U2(T120)/1202+U2(T100)/1002+U2(T酶標二抗)/1002+U2(T底物)/1002]1/2=0.0014
2.2.2.3 移液器產生的合成相對標準不確定度u(P)=[u2(C)+u2(T)]1/2=0.0054
2.2.3溫育時間的不確定度(B類) 試驗中,孵育時間分別為1 h(±2 min)、1 h(±2 min)、15 min(±1 min),根據均勻統計分布計算,其標準差分別為2 min/31/2=1.1547 min,2 min/31/2=1.1547 min,1 min/31/2=0.5774 min。
u(T1)=[1.15472/602+1.15472/602+
0.57742/152]1/2=0.0471
溫育溫度的不確定度(B類) 試驗共需孵育3次,孵育溫度均為25 ℃±3 ℃,根據均勻統計分布計算,其標準差分別為3/31/2=1.7321,溫育溫度的相對標準不確定度為:
u(T2)=[3×1.73212/252]1/2=0.1200
2.2.4酶標儀的不確定度(B類) 酶標儀不確定度由廣州廣電計量檢測股份有限公司的校準證書獲得,酶標儀的設定波長為450 nm時的吸光度擴展不確定度(U,k=2)為0.012,標準不確定度為:
2.2.5相對標準不確定度的合成 按照下列公式計算:
u(B類)=
取置信水平P=95%,K=2,則最佳估計值的擴展不確定度為:
根據上述測得的不確定度,在實際檢測過程中,在95%的置信區間,阻斷率(95%置信)=實際測得S/N±U。解釋:在95%的置信度下,檢測結果的真實S/N值在實際測得S/N±0.2593這個區間。所測得的不確定度在閾值水平上的應用為S/N=0.5±(0.5×0.2593)= 0.5±0.1297。解釋:在95%的置信度下,如果檢測結果S/N值<0.3703時,可明確判定為陽性,同樣,如果檢測結果S/N值≥0.6279時,可明確判定為陰性。
3 對照樣品法
原理:選擇一個弱陽性對照血清作為質控樣品,進行有限次的ELISA重復試驗,計算出檢測結果的平均值、標準偏差(SD)、相對標準偏差(RSD)。假設數據以正態分布,在閾值附近以95%置信水平計算。擴展不確定度即為:2乘以RSD。即利用質控樣品對口蹄疫抗體(O型)ELISA檢測方法的全過程和性能進行監控,直接評估該試驗過程的合成不確定度。
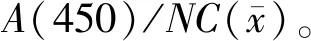
用固相阻斷ELISA法對血清中的抗體水平測定進行10次平行試驗,結果見表1。根據前面計算可知,檢測結果的平均值為0.3619,標準偏差為0.0376,那么相對標準偏差就為:
假設數據以正態分布,在閾值附近以95%置信水平計算,ELISA試驗中的k=2。擴展不確定度U=RSD×2,即U=2×0.1040=0.2080。
結果:根據上述測得的不確定度,在實際檢測過程中,在95%的置信區間,阻斷率(95%置信)=實際測得S/N±U。解釋:在95%的置信度下,檢測結果的真實S/N值在實際測得S/N±0.2080這個區間。所測得的不確定度在閾值水平上的應用為S/N=0.5±(0.5×0.2080)=0.5±0.1040。解釋:在95%的置信度下,如果檢測結果S/N值<0.3960時,可明確判定為陽性,如果檢測結果S/N值≥0.6040時,可明確判定為陰性。
4 討論
使用“影響因素分析法”和“對照樣品法”兩種方法,分別對血清實驗室固相阻斷ELISA法檢測口蹄疫病毒O型抗體進行不確定度評定,兩種方法得出的結論略有差異。
“影響因素分析法”對整個試驗的影響因素進行獨立的分析,得出數據接近理論值,有助于實驗室分析檢測活動中的注意事項,提高試驗的確定度,適用于對新方法的不確定度評定。對各影響因素的相對不確定度進行比對可得:溫度對移液器移液影響可忽略,故移液器引入的不確定度主要在移液器本身,實驗室需加強對移液器的校準和期間核查;溫育溫度、溫育時間對ELISA試驗影響較大,控制溫育時間引入的不確定度需使用計時器,并即時進行操作,控制溫育溫度引入的不確定度應使用生化培養箱溫育,并即時校準生化培養箱;控制酶標儀引入的不確定度,需即時校準酶標儀。
“對照樣品法”利用質控樣品對口蹄疫病毒O型抗體固相阻斷ELISA檢測方法的全過程和性能進行監控,直接評估該試驗過程的合成不確定度,減少大量計算過程,快速得出結論,貼合實驗室實際情況。“影響因素分析法”和“對照樣品法”計算的不確定度數值差異應來自于實驗室對溫育溫度、溫育時間的嚴格把控。

