丁酸通過誘導自噬抑制宮頸癌細胞增殖的研究
郭君萍 張珂 季夏薇 玉環 吳芳全 施迪邦 張嘉珉 王方巖
宮頸癌是全球女性的第四大常見惡性腫瘤,也是癌癥相關死亡的第四大原因,嚴重威脅女性的健康[1]。在中國,宮頸癌患者早期診斷率低,臨床上現行的手術、放療、化療等治療手段效果也不理想。目前,宮頸癌的發生、發展機制仍未完全闡明,深入探索其內在機制可能提供新的診療思路。近年來越來越多研究發現自噬在宮頸癌發生、發展中的重要作用[2-3]。自噬是指細胞通過溶酶體的作用對自身多余的蛋白質和受損的細胞器進行清除,維持細胞內穩態[4]。然而,過度的自噬會導致細胞自噬性死亡[5]。誘導過度自噬已成為部分宮頸癌治療藥物的作用靶點,例如二甲雙胍聯合奈非那韋的抗腫瘤作用與誘導宮頸癌細胞中的自噬體形成有關[6],一些合成的抗腫瘤肽如UM-6通過誘導細胞自噬在體外抑制宮頸癌細胞[7]。丁酸是腸道微生物發酵膳食纖維產生的具有生物活性的短鏈脂肪酸,不僅能提供腸上皮細胞70%的能量,還能抑制宮頸癌、肝癌、結直腸癌、肺癌等多種腫瘤的發生、發展[8-11]。有研究表明,丁酸可通過誘導活性氧(reactive oxygen species,ROS)的積累,抑制Akt/mTOR途徑,從而促進肝癌細胞自噬蛋白表達和自噬體形成[12]。有關宮頸癌的一些研究發現,丁酸能夠顯著抑制腫瘤細胞的增殖,但是否通過自噬以及其確切的機制還有待闡明。基于此,本研究利用離體培養的宮頸癌Hela細胞系,通過檢測自噬相關蛋白,探討丁酸抑制宮頸癌的具體作用機制,現報道如下。
1 材料和方法
1.1 材料
1.1.1 主要試劑 丁酸鈉(純度>98%)購自中國Aladdin公司,溶于DMEM培養基(中國Gibco公司)中配制成100 mmol/L原液,并用0.22 μm過濾膜過濾,保存在-20℃環境中。3-甲基腺嘌呤(3-Methyladenine,3-MA)購自美國MCE公司。MTT細胞增殖及細胞毒性檢測試劑盒(型號:C0009S)購自中國Beyotime公司。細胞計數試劑盒(cell counting Kit-8,CCK-8)購自日本同仁化學研究所。微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,LC3)抗體購買于美國CST公司,p62抗體購買于中國Affinity公司,甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)抗體、山羊二抗購自中國HUABIO公司,所有抗體均以1∶1 000比例稀釋,保存在4℃環境中。
1.1.2 細胞 人類宮頸癌Hela細胞購于美國ATCC公司,以含10%FBS的DMEM培養液培養,置于含5%CO2、37℃培養箱(德國Eppendorf AG公司,型號:6731KN019434)中培養。根據細胞生長情況換液,細胞生長密度為70%~80%時進行傳代。
1.2 方法
1.2.1 MTT檢測細胞增殖能力 將處于生長對數期的Hela細胞按2 000個/孔加入96孔板,培養24 h使細胞貼壁,加入5 mmol/L的丁酸鈉培養12、24、48 h(丁酸處理組),對照組不作處理。MTT粉末溶于稀釋液中配成5 mg/ml的工作液,-20℃避光保存。每孔加入10 μl的MTT工作液,在培養箱中孵育4 h,再加入100 μl的Formazan溶解液,混合均勻,37℃孵育3 h至紫色結晶全部溶解,使用多功能酶標儀(美國ThermoScientific公司,型號:VarioskanLUX)在570 nm測定吸光度。
1.2.2 透射電子顯微鏡觀察細胞超微結構 將培養48 h的丁酸處理組細胞與對照組細胞分別收集到1.5 ml EP管中,2.5%戊二醛固定24 h以上,再使用四氧化鋨固定細胞30 min,梯度乙醇溶液脫水,包埋,半薄切片,超薄切片。最后,在透射電子顯微鏡(日本HITACHI公司,型號:H7500)下觀察自噬囊泡、自噬溶酶體的形成,并進行拍照。
1.2.3 mGFP-RFP-LC3雙熒光實驗檢測細胞自噬流將Hela細胞接種在12孔板的細胞爬片上,24 h完全貼壁后,每孔加入脂質體Lip2000(美國Invitrogen公司)轉染mGFP-RFP-LC3質粒(中國麟美生物公司科技有限公司)1 μg,培養8 h后,5 mmol/L丁酸鈉分別處理12、24、48 h,對照組不作處理。棄培養液,PBS清洗,加入4%多聚甲醛溶液室溫固定15 min,重復PBS清洗過程,0.1%Triton X-100處理5 min后再次PBS清洗,1%FBS室溫固定30 min,含DAPI抗熒光淬滅封片液封片后在熒光顯微鏡(日本尼康公司,型號:CI-L)下觀察細胞自噬流。
1.2.4 Western blot法檢測細胞自噬相關蛋白LC3、p62表達 將Hela細胞接種到6孔板,5 mmol/L丁酸鈉處理48 h后收集(丁酸處理組),對照組不作處理,加入RAPI裂解液和蛋白酶抑制劑提取蛋白。使用二甲胺基丙酸蛋白質測定試劑盒檢測蛋白質濃度,12%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離細胞蛋白質,并轉移到聚偏二氟乙烯膜(BIO-RAD)中,5%脫脂奶粉室溫封閉1.5 h,含吐溫的Tris緩沖鹽溶液(Tris buffered saline with Tween,TBST)清洗3次,敷一抗4℃搖床過夜。第2天回收一抗,TBST清洗3次,室溫孵育二抗2 h。使用化學發光成像系統(美國GE公司)掃描,Image J軟件通過密度測定法對蛋白質條帶進行定量分析。
1.2.5 CCK-8法檢測自噬抑制劑3-MA對細胞的半抑制濃度(IC50) 將處于生長對數期的Hela細胞按3 000個/孔接種到96孔板中,完全貼壁后加入含有不同濃度3-MA的培養基在細胞培養箱里培養48 h,棄去培養基,每孔加入100 μl含10%CCK-8的混合液,37℃培養箱孵育2 h,用多功能酶標儀在450 nm波長處檢測吸光度,計算細胞活力,細胞活力=(A實驗組-A空白)/(A對照組-A空白)。
1.2.6 實時熒光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)法檢測細胞LC3、p62 mRNA表達 用5 mmol/L丁酸鈉處理Hela細胞12、24、48 h后收集細胞(丁酸處理組),對照組不作處理。Trizol試劑提取總RNA,使用基因擴增核糖核酸聚合酶鏈反應試劑盒進行逆轉錄,加入特異性引物(生工生物工程股份有限公司)、SYBR聚合酶(翌圣生物科技股份有限公司),在高通量熒光定量PCR儀(新加坡ABI公司)上進行RT-qPCR。數據采用2-ΔΔCt方法進行分析。引物序列見表1。

表1 引物序列
1.2.7 流式細胞術檢測細胞線粒體ROS水平 使用線粒體超氧化物熒光探針檢測細胞線粒體中的ROS相對表達水平。將細胞培養在6孔板中,分為對照組、丁酸組(加入5 mmol/L丁酸鈉處理48 h)、3-MA+丁酸組(3-MA加5 mmol/L丁酸鈉作用48 h)。加入PBS配制的5 μmol/L ROS工作液,于37℃避光孵育10 min,收集細胞線粒體ROS水平檢測細胞線粒體ROS水平。
1.3 統計學處理 采用SPSS 21.0統計軟件。計量資料多組比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,兩組比較采用兩獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 丁酸處理組與對照組細胞增殖能力比較 細胞培養12、24 h時,兩組細胞增殖能力比較差異均無統計學意義(均P>0.05);培養48 h后,與對照組相比,丁酸處理組細胞增殖能力明顯減弱(P<0.05),即丁酸抑制Hela細胞增殖,在48 h時最顯著,見圖1。
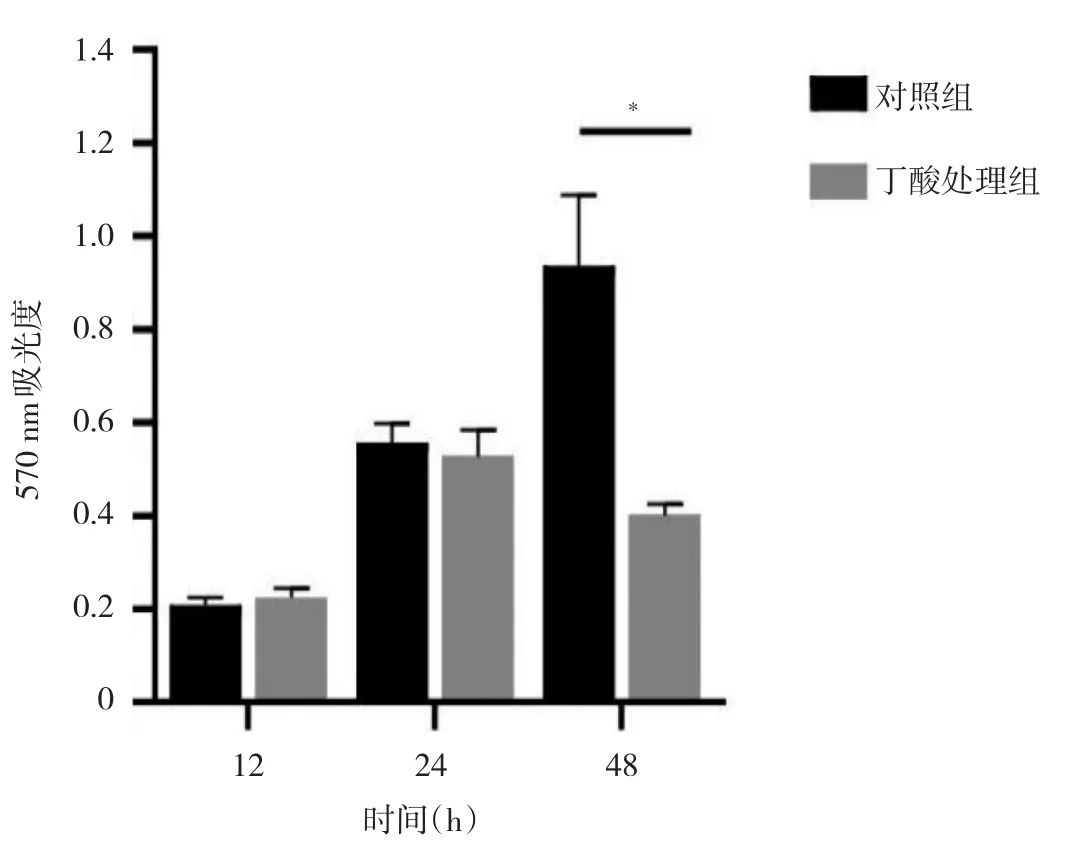
圖1 丁酸處理組與對照組細胞增殖能力比較
2.2 丁酸處理組與對照組細胞超微結構觀察所見對照組細胞中可觀察到正常的細胞核和核膜,線粒體、內質網等細胞器結構清晰,無水腫、空泡樣改變,見圖2a、b。丁酸處理組細胞中可觀察到大量雙層膜結構的自噬體,囊泡內包含受損的線粒體等細胞器,呈典型的自噬改變,見圖2c、d。即丁酸可促進宮頸癌細胞自噬。

圖2 丁酸處理組與對照組細胞超微結構觀察所見(a、b:對照組;c、d:丁酸處理組;a、c:×15 000;b、d:×30 000)
2.3 丁酸處理組與對照組細胞自噬流觀察 LC3被紅色熒光和綠色熒光標記,當自噬小體與溶酶體結合成自噬溶酶體時,綠色熒光在酸性環境下發生淬滅,只能檢測到紅色熒光。隨著丁酸處理時間增加,綠色熒光逐漸減弱,紅色熒光逐漸增強,即丁酸促進自噬體向自噬溶酶體的轉化增多,自噬流水平升高,見圖3(插頁)。

圖3 丁酸處理組與對照組細胞自噬流觀察所見
2.4 丁酸處理組與對照組細胞LC3、p62蛋白和mRNA表達水平比較 不管是蛋白水平還是mRNA水平,與對照組相比,丁酸處理組隨著丁酸處理時間增加,LC3-Ⅰ向LC3-Ⅱ的轉化增多,p62的表達則隨著處理時間增加而減少,見圖4。即丁酸誘導Hela細胞自噬。

圖4 丁酸處理組與對照組細胞LC3、p62蛋白和mRNA表達水平比較(a:LC3、p62蛋白表達水平比較電泳圖;b:LC3 mRNA表達水平比較;c:p62 mRNA表達水平比較)
2.5 3-MA對細胞的IC50檢測及對細胞自噬的影響隨著3-MA濃度增加,3-MA對細胞的抑制作用也增強。本研究選擇5 mmol/L作為3-MA的工作濃度,它抑制作用較強,毒性較小。Western blot結果表明,丁酸誘導的LC3-Ⅱ活化可被3-MA抑制,即丁酸對宮頸癌細胞自噬起促進作用,見圖5。
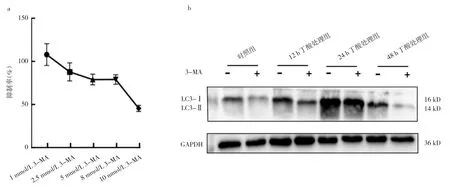
圖5 3-MA對細胞的IC50檢測及對細胞自噬的影響(a:不同濃度3-MA作用于細胞的IC50檢測;b:LC3蛋白表達電泳圖)
2.6 對照組、丁酸組、3-MA+丁酸組細胞線粒體ROS水平比較 流式細胞術顯示,與對照組相比,丁酸組ROS水平升高(P<0.05),3-MA+丁酸組ROS水平低于丁酸組但高于對照組(均P<0.05),見圖6。即丁酸誘導自噬可能通過線粒體途徑,而ROS在其中發揮重要作用。
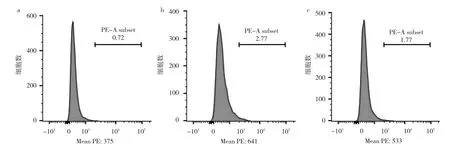
圖6 對照組、丁酸組、3-MA+丁酸組細胞線粒體ROS水平比較流式細胞圖(a:對照組;b:丁酸處理組;c:3-MA+丁酸組)
3 討論
丁酸是生物活性最活躍的短鏈脂肪酸,可以通過多種機制發揮抗炎和抗腫瘤作用。作為組蛋白乙酰化抑制劑,丁酸增加組蛋白乙酰化水平,調控增殖、凋亡、代謝等基因表達,發揮抗腫瘤作用[13-14]。此外,丁酸還能結合GPR41、43、109a抑制腫瘤的發生、發展[15-16]。本研究結果顯示,丁酸顯著抑制宮頸癌細胞的增殖,且這種抑制作用與細胞自噬有關。
細胞自噬可以通過消除受損的細胞器,回收代謝產物調節內平衡,促進癌細胞存活。研究表明,抑制自噬可以緩解卵巢癌[17-18]、結直腸癌[19]、肺癌[20]等的化療藥物耐藥性。在胰腺癌細胞中,SMAD4基因敲除引發的放射治療抵抗力與ROS積累、輻射誘導的自噬水平升高有關[21]。自噬也被證明在頭頸部鱗狀細胞癌中保護腫瘤細胞免受放射治療引起的細胞損傷[22]。此外,自噬阻斷劑氯喹被報道可增強IL-2免疫治療的抗腫瘤作用[23-24]。然而過度的自噬會誘發細胞程序性死亡,自噬性死亡已成為抑制癌癥的重要手段[25]。在乳腺癌細胞中,氟苯達唑通過誘導細胞自噬性死亡抑制細胞增殖和遷移[26]。自噬介導的細胞死亡也被發現與前列腺凋亡反應4蛋白抑制惡性膠質瘤細胞有關[27]。丁酸作為不同腫瘤治療的潛力藥物,其抗腫瘤作用也被報道與細胞自噬有關。小劑量的丁酸和槲皮素聯合應用可通過抑制保護性自噬增加膠質母細胞瘤的凋亡[28]。大劑量的丁酸則通過促進自噬性死亡抑制腎細胞瘤增殖[29]。
本研究結果表明,丁酸能顯著抑制宮頸癌細胞的增殖,進一步通過透射電子顯微鏡觀察到丁酸處理后的宮頸癌細胞中出現大量吞噬了破損的線粒體等細胞器的自噬體,呈典型的自噬變化。因此,筆者推測細胞自噬是丁酸抑制宮頸癌細胞增殖的關鍵機制。自噬作為真核細胞內保守的一種進化形式,首先是在內質網或者其他細胞膜上形成吞噬泡以響應應激信號通路,接著抗胸腺細胞球蛋白5(antithymocyte globulin,ATG5)和ATG12耦聯形成復合體,LC3被半胱氨酸蛋白酶ATG4切割生成LC3-Ⅰ,后者被ATG7激活后,在ATG3的作用下與磷脂酰乙醇胺結合轉化為LC3-Ⅱ,促進自噬體膜擴增[30]。不斷增長的吞噬膜通過膜上的LC3-Ⅱ與細胞器、蛋白質上的分子相互作用促進其選擇性攝取與降解,而p62是其中重要的銜接蛋白[31]。最后自噬泡與溶酶體結合并被溶酶體酶降解。在本研究中,mRFP-GFP-LC3雙熒光實驗顯示綠色熒光減弱,紅色熒光增強,提示自噬流增加,RT-qPCR和蛋白印記分析結果均表明LC3-Ⅰ轉化為LC3-Ⅱ增多,p62表達減少,以上結果均提示丁酸激活自噬。使用自噬抑制劑3-MA可以抑制丁酸誘導的LC3-Ⅱ活化,進一步證明丁酸確實促進了宮頸癌細胞自噬。
自噬過程常常伴隨ROS水平的升高,進一步研究發現ROS作為信號分子,能觸發細胞自噬過程的發生。甘草酸被報道通過ROS-線粒體途徑誘導乳腺癌細胞自噬與死亡,在抑制癌細胞生長中起重要作用[32]。異黃酮產生ROS破壞線粒體,導致自噬并誘導凋亡,顯著抑制腫瘤細胞[33]。在骨肉瘤細胞中,芬太尼誘導ROS生成,磷酸化c-Jun N端激酶(c-Jun N-terminal kinase,JNK),從而觸發自噬性死亡發揮抗腫瘤作用[34]。本研究也觀察到自噬體吞噬了受損的線粒體。因此,本研究檢測了宮頸癌細胞中線粒體的ROS水平,發現丁酸促進ROS在線粒體內的積累,并且這種ROS的表達增多能夠被3-MA抑制,提示丁酸可能通過線粒體途徑誘導宮頸癌細胞自噬。
綜上所述,丁酸通過誘導自噬抑制宮頸癌細胞增殖,而線粒體ROS可能是其重要的觸發機制。

