復合誘變選育耐高溫產乙醇酵母菌的研究
劉延波,宋艷潔,李海登,沈祥坤,張立新,孫西玉,韓素娜,潘春梅*
(1.河南牧業經濟學院 食品與生物工程學院(酒業學院),河南 鄭州 450046;2.河南仰韶酒業有限公司 博士后科研工作站,河南 三門峽 472400;3.河南大學 生命科學學院,河南 開封 475004;4.河南牧業經濟學院 河南省白酒風格工程技術研究中心,河南 鄭州 450046;5.河南牧業經濟學院鄭州市白酒釀造微生物技術重點實驗室,河南 鄭州 450046;6.河南工業大學 生物工程學院,河南 鄭州 450001;7.河南省食品工業科學研究所有限公司,河南 鄭州 450003)
酵母菌是雙性厭氧性微生物[1],在白酒生產過程中,酵母菌以谷物等作為營養基[2],生長到一定時期,會通過異化作用使發酵液中的糖類轉化為乙醇和其他代謝產物[3],因此酵母菌對白酒的發酵起著至關重要的作用[4]。傳統的酵母最適的發酵溫度為28~33 ℃,一般不超過36 ℃[5],由于呼吸作用會產出大量熱量,特別是炎熱的夏季,熱量積聚在發酵液中難以散去,常使得存在于酵母細胞內的理化成分,如脂肪酸,麥角固醇等遭到破壞,影響細胞生命活動的正常進行[6],造成酵母早衰,白酒企業每年出現“夏季掉排”現象。導致只能選擇壓排度夏,給生產造成極大的不便并大大降低了設備和廠房等的利用率,增加了釀酒成本[7]。
ABDEL B M等[8]研究指出,一個產能為3×107L的乙醇發酵企業,若將發酵溫度提升5 ℃,僅冷卻成本即可節約3萬美元;關于在乙醇工業中選育耐高溫酵母有較多研究[9-12]。DHALIWAL S S等[13]篩選到一株在40 ℃條件下耐高溫的東方伊薩酵母,乙醇產量達到71.9 g/L;徐大鵬等[14]篩選到1株在41 ℃可以良好生長的耐高溫酵母菌,乙醇產量為44.0 g/L。同樣篩選獲取在高溫條件下具有良好的乙醇發酵性能的酵母菌株,對白酒生產具有重要意義。
紫外(ultra violet,UV)線作為物理誘變因子常應用于工業微生物,使脫氧核糖核酸(deoxyribonucleic acid,DNA)分子形成嘧啶二聚體,阻礙堿基的配對,影響正常的復制和轉錄,從而引起菌株的突變或死亡[15-16],此外還具有便捷、經濟等優點,是微生物菌株誘變選育的首選誘變因子[17]。硫酸二乙酯(diethyl sulfate,DES)是一種烷化劑,可使活躍的烷基轉移到電子密度較高的分子中,置換氫原子從而導致堿基改變,能夠在較短的時間內提高突變率并獲得較優異的突變類型[18]。復合誘變是將兩種或兩種以上誘變劑先后使用,具有協同效應,相比于單一因子誘變有較大優勢[19-20]。趙宇等[21]通過常壓室溫等離子體誘變和基因重組重排方式篩選出能在37 ℃較好生長的突變株,其乙醇發酵性能為16.2%(V/V);RAJNI K等[22]通過甲烷磺酸乙酯、亞硝基胍、近紫外輻射和遠紫外輻射對葡聚糖雜交種進行連續誘變,突變株可在40 ℃條件下良好生長,乙醇產量為0.379 g/L,有效的提高了酵母的抗逆性。以上研究均表明,通過復合誘變可使出發菌種的優異性狀得到較大提升。
本研究在前期篩選菌株的基礎上,通過選擇紫外-硫酸二乙酯復合誘變法,并在深入研究菌株的最適誘變條件后,在單因素試驗基礎上,結合Box-Behnken中心組合試驗優化菌株的發酵條件,以期更有效改善出發菌株的耐受溫度及乙醇產率,為開發利用白酒酵母資源提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
酵母菌(Saccharomyces)JZ:篩選于河南某白酒企業[23],河南牧業經濟學院河南省白酒風格技術研究中心保藏。
1.1.2 試劑
葡萄糖、瓊脂:北京索萊寶科技有限公司;蛋白胨:廈門生物科技有限責任公司;酵母浸粉:深圳樂芙生物科技有限公司;硫酸二乙酯(DES):濟南世紀通達化工有限公司;硫代硫酸鈉:無錫市正昌源化工有限公司;氯化鈉:天津市祥瑞鑫化工有限公司;Ezup柱式試劑盒:深圳子科生物科技有限公司;雙蒸水:上海生工生物工程股份有限公司。試驗所用試劑均為分析純及生化試劑。
1.1.3 培養基
菌種的增菌培育采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液體培養基:1%酵母浸粉,2%蛋白胨,2%葡萄糖。121 ℃滅菌15 min。
菌種的活化、分離純培養和菌種保存采用酵母浸出粉胨葡萄糖瓊脂培養基:1%酵母浸粉,2%蛋白胨,2%葡萄糖,2%瓊脂粉。121 ℃滅菌15 min。
2,3,5-氯化三苯四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)培養基:乳酸5 g/L,瓊脂15 g/L,pH6.0。121 ℃滅菌15 min后,待其冷卻至50 ℃后加入TTC 0.1 g/L(現配現用)。
乳酸培養基:乳酸40 g/L,硫酸銨5 g/L,磷酸二氫鉀1 g/L,氯化鈉0.1 g/L,硫酸鎂0.5 g/L,氯化鈣0.1 g/L,酵母膏0.2 g/L,瓊脂15 g/L,pH6.0。121 ℃滅菌15 min。
目標菌種發酵培養采用高粱發酵培養基∶高粱水=1∶4,90 ℃糊化90 min,先降溫冷卻至60 ℃,然后加入5%糖化酶糖化2~3 h,將糖度調至12°Bx。121 ℃滅菌15 min。
1.2 儀器與設備
DRP-9052恒溫振蕩培養箱:上海譜振生物科技有限公司;SW-CJ-2FD雙人單面凈化工作臺:上海篤特科學儀器有限公司;LDZX-50FBS高壓蒸汽滅菌鍋:紹興上虞艾科儀器設備公司;TGL-16LM高速冷凍離心機:北京華儀通泰環保科技有限公司;PICO-21式離心機:湖南恒諾儀器設備有限公司;DYCP-31DN瓊脂糖凝膠電泳儀:北京市六一儀器廠;JY04S-3C凝膠成像系統:濟南童鑫生物科技有限公司;V-T3紫外分光光度計:上海美譜達儀器有限公司;CX31生物顯微鏡:上海博湖生物科技有限公司;ABI VeritiPro聚合酶鏈式反應(polymerase chain reaction,PCR)儀:北京宏達恒業科技有限公司。
1.3 實驗方法
1.3.1 酵母菌的分子生物學鑒定
采用Ezup柱式酵母基因組試劑盒提取分離,以基因組DNA為模板,采用通用引物(NL-1:5'-GCATATCAATAAGCGGAGGAAAAG-3')和(NL-4:5'-GGTCCGTGTTTCAAGACGG-3')進行擴增,PCR擴增體系(50 μL):SanTaqPCR Mix預混液25μL,引物各2μL,DNA模板2μL,雙蒸水(ddH2O)19 μL。PCR擴增條件:94 ℃、5 min,94 ℃、40 s,55 ℃、40 s,72 ℃、90 s,35個循環;最后72 ℃延伸10 min[24]。取3 μL PCR產物經1%瓊脂糖凝膠電泳檢測分離,出現清晰條帶,將PCR產物送生工生物工程(上海)有限公司進行測序,將獲得的基因序列在美國國家生物技術信息中心(national center of biotechnology information,NCBI)上通過基本局部比對搜索工具(basic local alignment search tool,BLAST)程序進行同源性比較與分析,并利用MEGAX 10.0.2軟件中的鄰接(neighbor joining,NJ)法構建系統發育樹[25]。
1.3.2 酵母JZ生長曲線的測定
吸取2%活化后的甘油凍懸液接種至YEPD液體培養基,置于搖床培養箱每2 h取一次樣,測其波長600 nm處的吸光度值(D600nm值),以空白培養基為對照組,繪制菌株JZ生長曲線。
1.3.3 菌懸液的制備
用接種環在斜面上挑取一環菌體,放入裝有無菌生理鹽水的試管中,10 000 r/min離心振蕩棄去上清液,加入無菌生理鹽水再次振蕩,使下層菌體懸浮形成均一的懸濁液[26]。
1.3.4 誘變方法
紫外誘變:將菌懸液放置已滅菌的,裝有玻璃珠的三角瓶中,振蕩5 min,以打散菌體。用無菌生理鹽水稀釋至1×108CFU/mL,備用[13]。紫外燈預熱30 min 后,取10 mL制備的菌懸液加到直徑9 cm平皿中,放入無菌磁力攪拌子,然后置于磁力攪拌器上、30 W的紫外線燈30 cm處,避免接觸白熾光,依次照射0、20 s、40 s、60 s、80 s、100 s和120 s[27]。
硫酸二乙酯(DES)誘變:取培養至對數生長期的菌懸液10 mL于三角瓶中,加入含量分別為0、5.0%、7.5%、10.0%、12.5%、15.0%的硫酸二乙酯各10 mL,于28 ℃、200 r/min條件下振蕩處理30 min后,立即加入1 mL 25%的硫代硫酸鈉溶液終止反應。
將出發菌株酵母菌懸液經紫外照射后立即加入硫酸二乙酯進行復合誘變處理,取未照射的制備菌液和照射菌液各1 mL進行稀釋分離,計數活菌細胞數[28]。致死率計算公式如下:

1.3.5 耐高溫酵母菌的篩選及形態學鑒定
挑取長勢良好的誘變菌種進行劃線接種,分別在33 ℃、35 ℃、37 ℃、40 ℃、42 ℃、45 ℃、47 ℃、50 ℃的條件下靜置培養24 h,通過OD600nm值反映生長情況,并通過美藍染色記錄其基本形態特征。
1.3.6 遺傳穩定性試驗
將突變株的種子液按2.0%的接種量接種至發酵培養基,靜置于40 ℃條件下進行厭氧發酵6 d后,按照國標GB 5009.225—2016《食品安全國家標準酒中乙醇濃度的測定》蒸出餾出液,用酒精度計測餾出液的乙醇產量,進行連續5次傳代培養,以確定突變株的遺傳穩定性。
1.3.7 發酵條件優化
(1)單因素試驗
發酵溫度:按5%接種量接種于發酵培養基,分別在發酵溫度為28 ℃、31 ℃、35 ℃、37 ℃、40 ℃、43 ℃條件下靜置培養6 d,通過監測CO2質量損失反映發酵情況。
初始pH值:按5%的接種量分別接種于初始pH值為2.0、3.0、4.0、5.0、6.0、7.0的發酵培養基中,靜置培養6 d,通過監測CO2質量損失反映發酵情況。
初始糖度:按5%的接種量分別接種于初始糖度為8.0°Bx、10.0°Bx、12.0°Bx、14.0°Bx、16.0°Bx、18.0°Bx的發酵培養基中,靜置培養6 d,通過監測CO2質量損失反映發酵情況。
接種量:分別吸取6.0%、8.0%、10.0%、12.0%、14.0%、16.0%的菌液接種于發酵培養基中,靜置培養6 d,通過監測CO2質量損失反映發酵情況[29]。
(2)響應面試驗
在單因素試驗基礎上,選取對CO2質量損失影響較大的發酵溫度(A)、初始pH值(B)、初始糖度(C)三個因素作為自變量,以發酵結束后的CO2質量損失(Y)為響應值,采用Design Expert 8.0.6軟件設計3因素3水平Box-Behnken試驗,優化發酵條件并進行驗證,Box-Behnken 試驗設計因素與水平見表1。

表1 發酵條件優化Box-Behnken試驗設計因素與水平Table 1 Factors and levels of Box-Behnken experiments design for fermentation conditions optimization
1.3.8 CO2質量損失測定
挑取菌液接入錐形瓶中,并在發酵栓中注入約5 mL硫酸,封口,置感量為0.01 g的分析天平上稱取,記下質量m1。置于所需溫度的培養箱進行培養,發酵時間結束之后,取出發酵栓,輕輕搖動,使CO2逸出,稱量后記下質量m2,計算兩者之間的質量差。
2 結果與分析
2.1 酵母菌JZ的鑒定
采用NL-1基因和NL-4基因特異性引物對菌種JZ的基因組DNA進行PCR擴增,擴增產物電泳圖見圖1。由圖1可知,引物濃度適中,擴散效率較好;菌株JZ擴增產物帶大小介于750 bp和500 bp,產物長度約為600 bp。
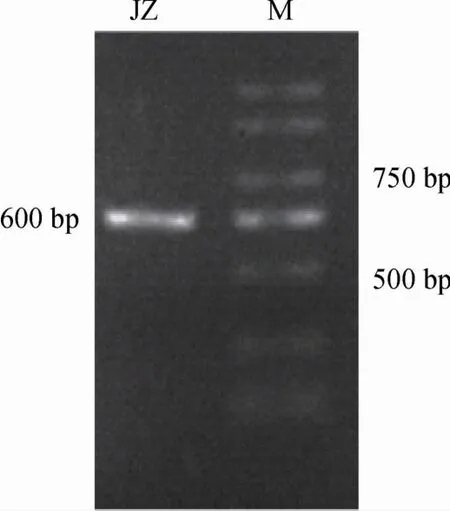
圖1 酵母JZ 28S rDNA PCR擴增產物瓊脂糖凝膠電泳圖Fig.1 Agarose gel electrophoretogram of 28S rDNA PCR amplification product of yeast JZ
將獲得的基因序列在NCBI上通過BLAST程序進行同源性比較與分析,并利用MEGAX 10.0.2軟件中的鄰接(NJ)法構建系統進化樹,結果見圖2。由圖2可知,酵母JZ位于獨立進化分支內,其遺傳進化關系與庫德里阿茲威畢赤酵母(Pichia kudriavzevii)的相似性為98%,因此,菌株JZ被鑒定為庫德里阿茲威畢赤酵母(Pichia kudriavzevii)。
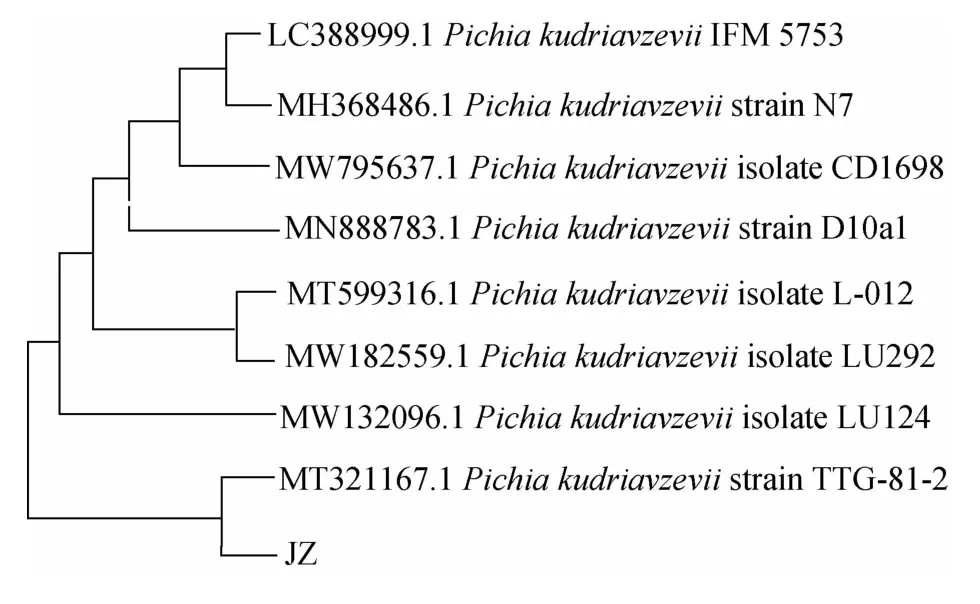
圖2 基于28S rDNA基因序列菌株JZ的系統發育樹Fig.2 Phylogenetic tree of strain JZ based on 28S rDNA gene sequence
2.2 菌株JZ生長曲線的測定
由圖3可知,0~4 h為延遲期,細胞經過初步適應后,代謝活動逐漸旺盛,但生長仍較緩慢,細胞數基本不增加;從第6小時開始細胞的生長進入對數生長期,對理化因素較為敏感,該時期的細胞生長平衡,細胞形態、大小、生理特征比較一致,生長最為旺盛,菌體活力最好,初級代謝產物大量產生;在22~30 h之間,該時期的生長菌群總數處于平穩階段,且細胞繁殖速度漸趨下降。為達到較高的菌體密度以及較好的繁殖速度,故本試驗以對數生長后期16 h作為誘變時間。
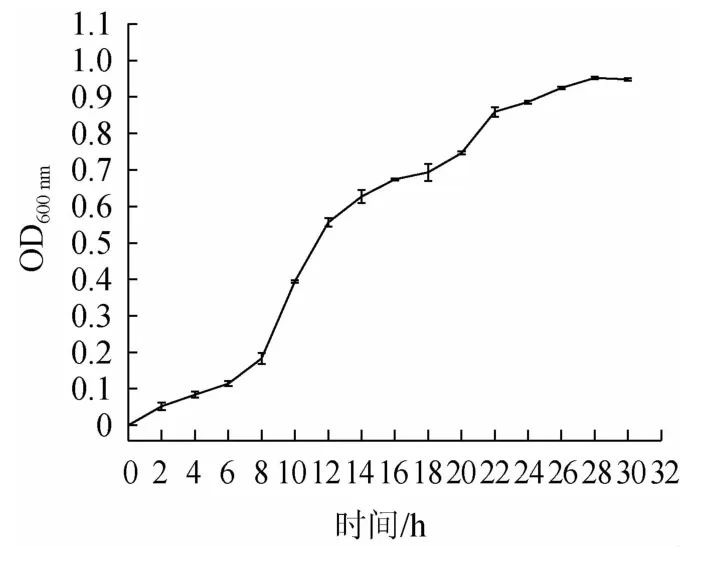
圖3 菌株JZ的生長曲線Fig.3 Growth curve of strain JZ
2.3 菌株JZ的誘變
2.3.1 紫外誘變
由圖4可知,菌種的致死率與紫外照射時間呈正相關。在20 s以內時,致死率較低,說明對菌種生長無較大影響。當持續照射20 s后,菌種致死率快速上升,并在80 s時,菌種致死率快速增加到82.46%,符合最佳誘變的致死率范圍80%~90%。因此,選擇菌種的最佳誘變時間為80 s。
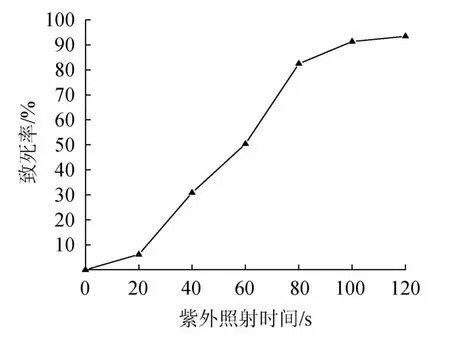
圖4 紫外照射時間對菌體致死率的影響Fig.4 Effect of UV irradiation time on the lethality of bacteria
2.3.2 硫酸二乙酯誘變
由圖5可知,硫酸二乙酯的添加量與菌種致死率呈正相關。當誘變劑添加量為5.0%時,致死率達到81.75%,隨著誘變劑濃度的提高,曲線趨于平緩。因此,選擇誘變劑硫酸二乙酯添加量為5.0%。

圖5 硫酸二乙酯添加量對菌體致死率的影響Fig.5 Effect of diethyl sulfate addition on the lethality of bacteria
2.3.3 誘變菌株JZ-2的形態學鑒定
通過平板分離培養基分離純化,從誘變菌株中篩選出10株酵母菌;用TTC培養基和乳酸培養基進行初篩,篩選出3株能耐45 ℃以上的酵母菌,編號為JZ-1~JZ-3。其中JZ-2菌株在TTC培養基下顏色最深,JZ-1和JZ-3次之。通過YPD固體培養基劃線分離,以及47 ℃高溫培養,最終篩選出一株菌落形態較好的耐高溫酵母菌,編號為JZ-2,菌株JZ-2菌落及細胞形態觀察結果見圖6。由圖6a可知,在28 ℃培養條件下,菌株JZ-2菌落形態為圓形,較大較厚,呈乳白色,表層濕潤,粘稠,表面平坦,不反光。由圖6b可知,在47 ℃培養條件下,菌落形態為圓形,乳白色,菌落較小,直徑范圍約0.5~1.0 mm。28 ℃是常溫下培菌的溫度且比較適合菌株的生長,47 ℃是酵母菌的最高耐受溫度,兩者的菌落和鏡檢圖可做對比,由圖6c可知,在28 ℃下鏡檢,發現細胞多為橢圓狀且細胞形態較大。由圖6d可知,47 ℃條件下,細胞多數呈圓柱形、檸檬形。

圖6 菌株JZ-2的菌落(a,b)及細胞(c,d)形態Fig.6 Colony (a,b) and cell (c,d) morphologies of strain JZ-2
2.3.4 誘變菌株JZ-2產乙醇測定
在40 ℃下用糖度為12°Bx的發酵培養基培養菌種JZ-2,靜置培養6 d,測得CO2質量損失為5.81 g,產乙醇為4.8%vol。
2.4 誘變菌株JZ-2遺傳穩定性測定
在對突變菌種JZ-2經過5次傳代,在47 ℃條件下仍能穩定生長,且產乙醇能力趨于穩定,為4.6%vol,表明誘變菌株JZ-2具有較好的遺傳穩定性。
2.5 誘變菌株JZ-2的溫度耐受性
在不同溫度下對突變株JZ-2分別培養24 h,OD600nm值測定結果見圖7。由圖7可知,當培養溫度為33~37 ℃時,菌種的OD600nm值呈上升態勢;溫度在37~50 ℃時,OD600nm值不斷減少;當達到50 ℃時,OD600nm值達到最小值,生長趨近停止;在47 ℃時,菌株緩慢生長,生長受到抑制;表明該酵母菌的最適生長溫度為37 ℃,最高溫度耐受性為47 ℃。
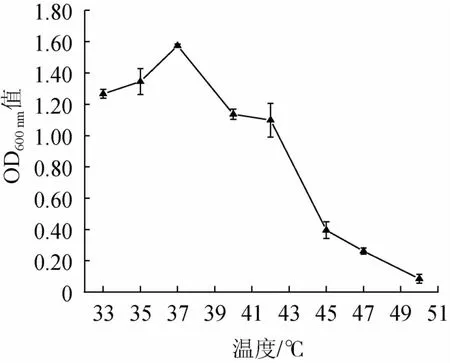
圖7 溫度對菌株JZ-2生長的影響Fig.7 Effect of temperature on strain JZ-2 growth
2.6 誘變菌株JZ-2發酵條件優化
2.6.1 單因素試驗結果
由圖8a可知,在28~40 ℃條件下,CO2質量損失呈上升態勢,在40~43 ℃下,CO2質量損失不斷減少,表明發酵溫度為40 ℃時,突變株JZ-2的發酵性能最好。過高或過低pH環境中生長的酵母細胞,其細胞膜的帶電荷狀態以及酶促反應均會受到影響。由圖8b可知,CO2質量損失在發酵pH為4.0時達到最高為5.66 g,說明該pH狀態下,既保證了細胞膜的穩定電荷,又使得酶促反應正常進行。由圖8c可知,當發酵培養基的糖度在8~16°Bx范圍內,CO2質量損失不斷增加,16~18°Bx之間CO2質量損失減少,表明菌株JZ-2的最適發酵糖度為16°Bx。由圖8d可知,當接種量為12%時,CO2質量損失達到最高為6.43 g,表明菌種JZ-2的最適接種量為12%。
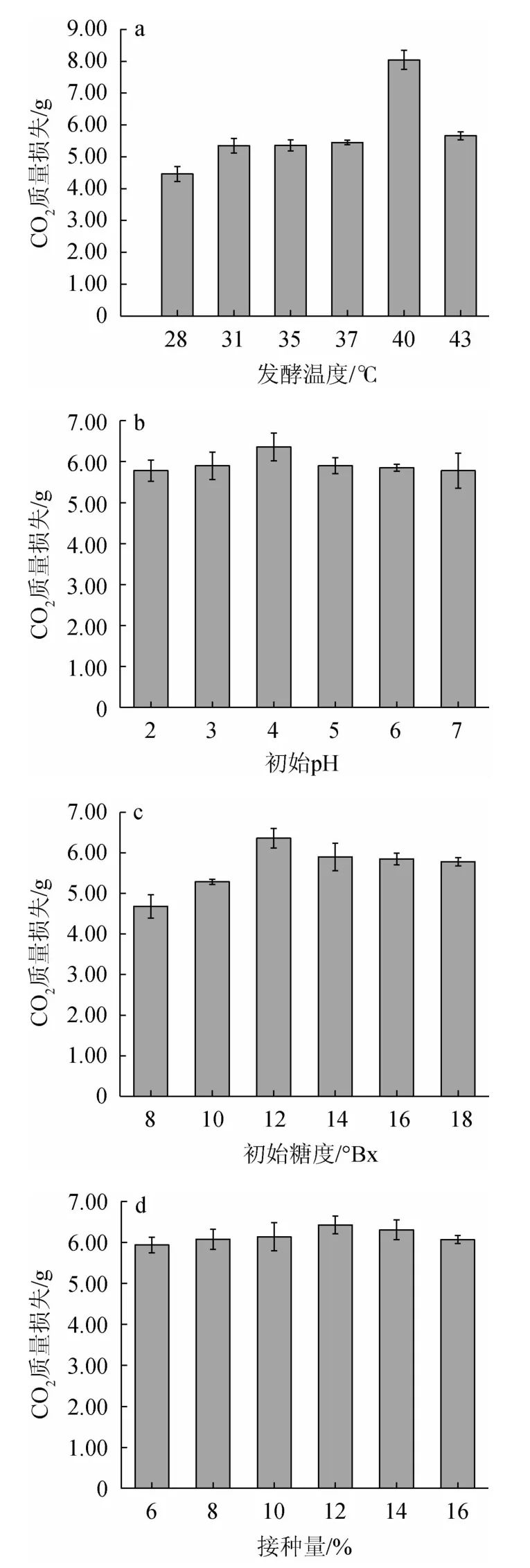
圖8 不同發酵溫度(a)、初始pH(b)、初始糖度(c)和接種量(d)對CO2質量損失的影響Fig.8 Effects of different fermentation temperature (a),initial pH (b),initial sugar contents (c) and inoculum (d) on CO2 mass loss
2.6.2 響應面試驗結果與分析
在單因素試驗基礎上,根據Box-Behnken試驗設計原理,設計了17個試驗的響應面分析試驗,Box-Behnken試驗設計與結果見表2,方差分析結果見表3。采用Design Expert 8.0.6軟件對表4數據進行多元二次回歸擬合,得到CO2質量損失(Y)對發酵溫度(A)、初始pH值(B)、初始糖度(C)的多元回歸方程為:Y=7.51-0.24A+0.096B+0.42C+0.21AB+0.16BC-1.48A2-0.35B2-0.33C2。

表2 發酵條件優化Box-Behnken試驗設計及結果Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization

表3 回歸模型方差分析Table 3 Variance analysis of regression model
由表3可知,該模型的F=90.31,P<0.000 1,表明該模型極顯著;失擬項F值=4.83,P>0.05,表明失擬項不顯著,模型的決定系數R2=0.998 1,調整決定系數R2Adj=0.995 7,說明該模型合理可行。由P值可知,一次項A、C、二次項A2、B2、C2對Y值影響極顯著(P<0.01),交互項AB、BC對Y值影響顯著(P<0.05),其余項則不顯著。由F值可知,各因素對CO2質量損失的影響顯著性大小順序依次為初始糖度(C)>發酵溫度(A)>初始pH值(B)。
2.6.3 各因素交互作用響應曲面分析
三個顯著因素的響應面曲線都呈現拋物線形態,且開口向下,表明存在有峰值。響應面坡度越陡,各種因素間的交互作用就越顯著。各因素交互作用響應面及等高線見圖9。由圖9可知,A和B、B和C交互作用顯著(P<0.05),A和C交互作用不顯著(P>0.05)。
2.6.4 驗證試驗
由Design Expert8.0.6軟件優化發酵培養條件,結果表明:當優化條件分別為發酵溫度39.82 ℃,初始pH值4.28,初始糖度15.43°Bx時,CO2的質量損失預測值為7.685 g。根據實際操作可行性,將發酵條件修正為發酵溫度40 ℃,初始pH值4,初始糖度16°Bx。在此最佳條件下進行3次平行驗證試驗,可得CO2質量損失實際值為(7.63±0.17)g,與預測值基本吻合,說明所建模型擬合效果真實良好。并通過利用蒸餾-酒精計法測得優化后的菌種JZ-2的產乙醇能力為5.6%vol。
3 結論
本研究對實驗室保藏菌種JZ進行UV-DES復合誘變,獲得了溫度耐受性以及乙醇產量顯著提高且遺傳性能穩定的突變株JZ-2,并利用單因素試驗及響應面分析法對其發酵培養條件進行優化。經篩選得到的突變菌株JZ-2,在40 ℃下發酵6 d,產乙醇可達4.8%vol。在單因素試驗的基礎上,響應面優化結果顯示,突變菌種JZ-2的最佳發酵條件為培養溫度40 ℃、初始pH4、糖度為16°Bx、接種量12%,在此條件下,突變菌株JZ-2的產乙醇能力最高可達5.6%vol。發酵酒分仍偏低,可能原因為首先該菌株是畢赤酵母,產乙醇能力在一定程度上沒有釀酒酵母的產酒率高;其次溫度的影響,40 ℃的條件下雖不能完全抑酵母的生長,但對其存在一定的抑制。但相比于初始菌株產乙醇能力提高了17%,顯示其在高溫下發酵生產乙醇的潛力巨大,為開發利用白酒釀造微生物資源和解決企業“夏季掉排”現象提供理論依據和應用參考。

