巨噬細胞極化在痛風性關節炎中的研究進展
郝佳瑤 黃逸晨 張 娟 馬寧寧 沈海麗
痛風性關節炎(gouty arthritis,GA)屬于風濕性疾病中晶體關節炎的一種,是由關節和關節周圍組織中沉積的尿酸單鈉鹽(monosodium urate,MSU)晶體引起的急性或慢性炎性反應。 在痛風性關節炎發病機制中,作為固有免疫的巨噬細胞(macrophages,M?)發揮著重要角色[1]。 在受到不同微環境刺激后,M?極化為M1 型和M2 型,并分泌多種細胞因子。 M1 型極化發生在炎癥的初始階段,而M2 型極化在炎癥緩解過程中占主導地位。 M? 極化狀態之間的轉換會導致慢性炎癥、代謝紊亂,甚至發生自身免疫疾病[2]。 痛風性關節炎的發病及緩解機制目前仍在探究中,而M? 極化可能發揮著重要作用,現對近年來痛風性關節炎中巨噬細胞極化類型、巨噬細胞極化方式、主要的信號通路以及治療靶點等相關研究進行歸納總結,以期為后續深入研究痛風性關節炎的發病機制及治療靶點提供新的思路。
一、巨噬細胞極化類型
M? 極化是指受到細胞因子和微環境的影響后進一步分化為M1 型和M2 型,如圖1 所示。 M1 型即經典型活化M?,其表型包括趨化因子2、CD86、缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)等,由腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、干擾素γ(interferon-γ,IFN-γ)、脂多糖(lipopolysaccharide,LPS)誘導形成,產生TNF-α、白細胞介素-1(interleukin-1,IL-1)、活性氧(reactive oxygen species, ROS)、金屬蛋白酶等細胞因子,發揮促炎和吞噬作用[2]。 M2 型即選擇型活化M?,又可分為M2a、M2b、M2c、M2d4 個亞型,主要表達CD36、CD206 和CD163,由白細胞介素-10(interleukin-10,IL-10)、白細胞介素-4(interleukin-4,IL-4)誘導形成,分泌IL-10、轉化生長因子-β(transforming growth factor-β,TGF-β)、血管內皮生長因子等,在炎癥和組織修復途徑中起作用,M2 型相比于M1 型,結構和功能更加多樣化,M2a 型主要發揮促進細胞增殖和遷移、清除凋亡細胞的作用[3]。M2b 型具有使細胞成熟,維持穩態,合成細胞外基質的功能[4]。 M2c 型能消除炎癥,合成細胞外基質,組織修復,產生生長因子[5]。 M2d 型可以促進血管再生和傷口愈合[6]。
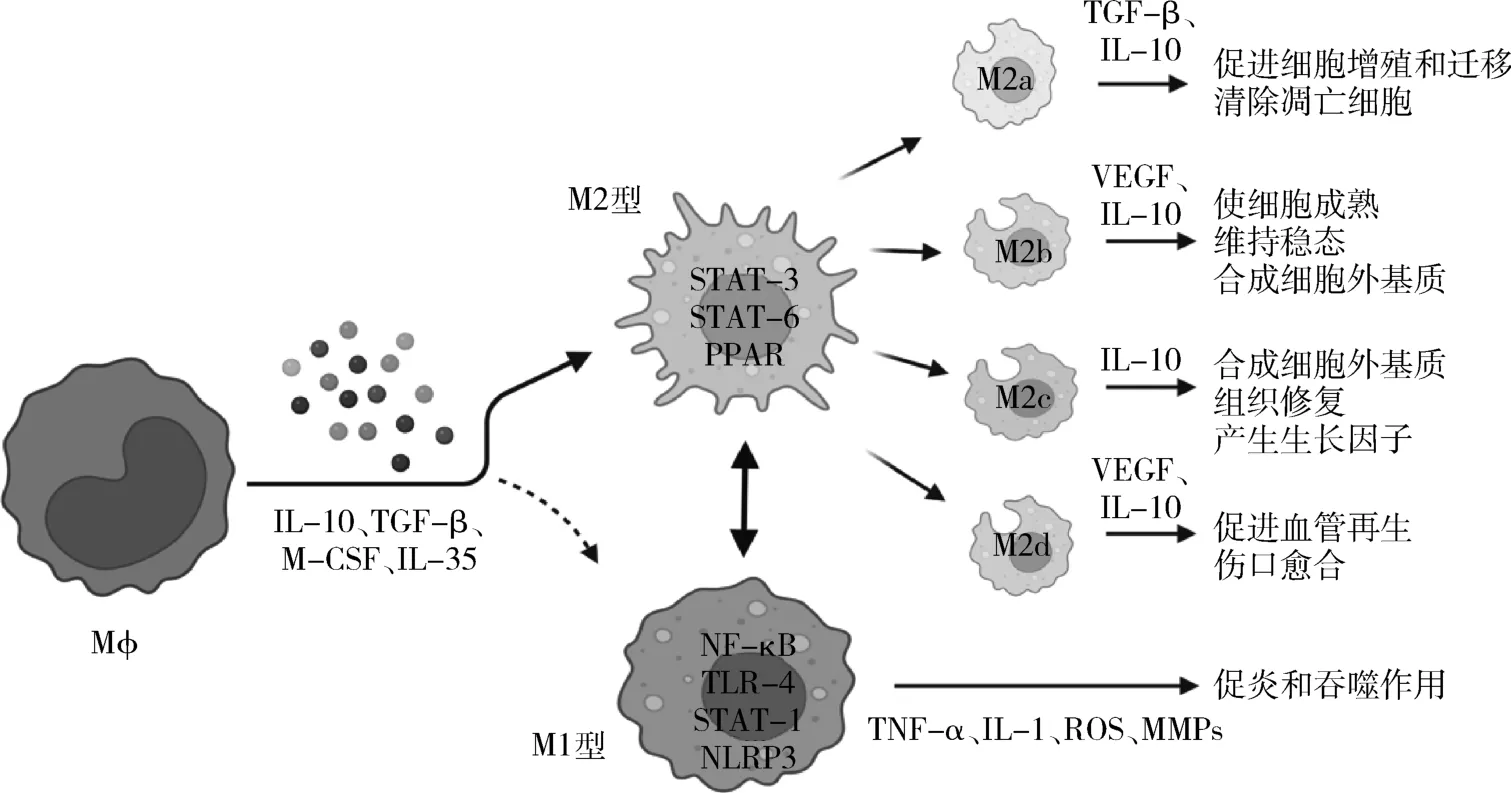
圖1 不同巨噬細胞極化類型及作用
二、痛風性關節炎中巨噬細胞極化方式
1.缺氧誘導極化:缺氧是M? 募集和極化的關鍵驅動因素。 缺氧組織會分泌高濃度的趨化因子、HIF-1 和內皮素-2,吸引M? 到缺氧區域[7]。 急性缺氧環境有利于M2 型極化,慢性缺氧環境誘發M1型極化。 炎癥初期(1 ~4 周)可引起急性缺氧,從第4 周開始誘發M2 型極化。 M2 型發揮抗炎和組織修復作用來減輕炎癥(4 ~8 周),如果炎癥得不到緩解,則長時間缺氧(>8 周)更有利于M1 型極化和生存,導致慢性炎癥性疾病[8]。 在痛風性關節炎患者中已經觀察到,炎癥嚴重程度和缺氧呈正相關,炎癥水平越高,HIF-1α 水平越高[9]。
2.骨髓來源巨噬細胞更具可塑性:M? 的某些極化狀態與巨噬細胞發育起源相關,M? 不僅包括骨髓來源的循環單核細胞,還包括胚胎等其他來源。 骨髓來源的M? 比胚胎M? 更容易受到局部組織信號的影響和隨后的極化,這種極化也稱之為固有巨噬細胞極化[10]。
在痛風性關節炎中,雖然MSU 晶體均能在骨髓和原位M? 誘導炎性反應,但是急性期炎癥的啟動更傾向于MSU 晶體誘導骨髓來源M? 發生氧化應激,促進單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、巨噬細胞炎性蛋白-2(macrophage inflammatory protein-2,MIP-2)、趨化因子上調,促使單核細胞進入滑膜環境,參與痛風性關節炎急性發作[11]。
3.LPS 和IL-4 誘導不同表型極化:CD4+輔助性T 細胞(helper T cell,TH)分泌和釋放的不同的細胞介質同樣介導M? 的極化,這稱為外源性極化。Th1 細胞壁釋放LPS,驅動M? 向M1 型極化,而Th2細胞分泌IL-4,驅動M2 型極化。 IL-4 通過Stat6依賴的途徑耗盡作為誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)/一氧化氮合酶(nitric oxide synthase2,NOS2)底物的精氨酸來抑制炎性介質NO 的產生,抑制NO 的產生會導致M1 型的喪失[12]。痛風性關節炎急性期,LPS 介導的M1 型極化中,TOLL 樣受體4 通過激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白質絲氨酸蘇氨酸激酶(protein serine threonine kinase,Akt)通路和哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路觸發M1 型極化[13]。 在痛風性關節炎緩解期,IL-4 誘導M? 釋放抗炎性細胞因子TGF-β,抑制NF-κB 通路并誘導M? 向M2 型極化[14]。
三、痛風性關節炎不同疾病期與巨噬細胞極化
痛風性關節炎中,MSU 晶體沉積在關節和關節周圍組織,導致急性關節炎癥。 常駐M? 或單核細胞通過TLR2、TLR4 識別和吞噬沉積的MSU 晶體。 在痛風性關節炎急性炎癥期,MSU 晶體刺激后,M? 傾向于表達M1 促炎表型CD86[15]。 MSU 晶體顯著誘導IL-1β 和一氧化氮合酶(nitric oxide synthase,NOS)表達,IL-1β 刺激中性粒細胞活化,釋放出大量的中性粒細胞胞外誘捕網(neutrophil extracellular traps,NETs)、活性氧,趨化因子等,血液中的中性粒細胞被炎性因子、趨化因子等誘導至關節間隙,引發劇烈炎性反應[16]。
在痛風性關節炎自行緩解期, M? 受MSU 晶體刺激后產生TGF-β,抑制NF-κB、NLRP3 炎性小體通路,減少促炎性細胞因子IL-1β 分泌,增加抗炎性細胞因子IL-10 的表達,進一步誘導精氨酸-1 的表達,促使M? 向M2 型中M2c 為主導極化[17]。MSU 還可以刺激中性粒細胞聚集,產生NETs 誘捕MSU 晶體,并通過自噬途徑分解MSU 晶體而緩解炎癥[18]。 上述研究表明,痛風性關節炎急性期,MSU 晶體誘導M? 向M1 型極化,釋放促炎介質,而當急性炎癥進展到一定程度,MSU 晶體會進一步誘導M? 向M2型極化,限制炎癥的發展并誘導炎癥的消退,這可能是痛風性關節炎具有“自限性”的原因之一[19]。
四、痛風性關節炎中巨噬細胞極化相關信號通路
1.NF-κB 信號通路:NF-κB 是典型的促炎信號通路,在炎癥狀態下,IL-1β、TNF-α、IL-6 和iNOS 等促炎介質主要受轉錄因子NF-κB 的調節[20]。核轉錄因子κB 抑制蛋白α(inhibitor of NF-κB, I-κBα)的磷酸化、泛素化和降解是NF-κB 活化的必要前提。 MSU 晶體被認為是促進I-κBα 磷酸化和NF-κB 激活的最有效的促炎刺激因子之一,可促進GA 患者和M? 產生大量促炎性細胞因子[21]。 NF-κB 通路同樣是M? 極化反應的調節因子,許多M1 基因的啟動子區域都含有NF-κB 結合位點,包括IL-6、iNOS 和MCP-1,此外,p50/NF-κB 同源二聚體被發現能夠協調M2 型極化并抑制M1 細胞因子的表達,痛風性關節炎大鼠模型的滑膜組織中發現了高水平的腫瘤壞死因子-α、IL-1β、IL-6 和NF-κB 的激活,I-κBα 水平顯著降低,這些結果提示MSU 晶體刺激誘導M? 向M1 型極化,隨后促進促炎介質的產生[17,22]。
2.JAK/STAT 信號通路:Janus 激酶(Janus kinase, JAK)/酪氨酸激酶受體和信號轉導和轉錄激活因子(signal transducer and activator of transcription,STAT)信號通路不僅與M? 的炎癥相關,也參與M?極化過程。 IFN-γ 介導的JAK/STAT 信號通路促進M1 型表達NOS2,增加IL-1、IL-12 等促炎性細胞因子的釋放[23]。 在痛風性關節炎中,MSU 晶體可誘導小鼠滑膜組織中IL-6 分泌增加,促使p-JAK2 和p-STAT3 的表達水平明顯升高,可引起M? 向M1型極化,并且早期可誘導部分M? 向M2 型極化,提示JAK2-STAT3 信號參與了MSU 晶體誘導的早期炎癥過程中M? 向M1 型和M2 型的極化過程[17]。STAT6 是M? 極化到M2 型的最重要的轉錄因子之一,磷酸化的STAT6 進入細胞核,介導了M? 的脂質代謝,促進M2 相關基因的轉錄,誘導M? 向M2 型極化[13]。
3.NLRP3 炎癥體信號通路:炎性小體是一種大的胞質多蛋白復合體,控制促炎性細胞因子的成熟和分泌,包括IL-1β、IL-18 和細胞凋亡。 NLRP3(NOD-like receptor family pyrin domain-containing protein 3)炎癥體是一個多蛋白復合體,包括NLRP3、凋亡相關斑點樣蛋白(apoptosis-related speckle-like protein,ASC;包含CARD caspase 激活和招募結構域) 和半胱氨酰天冬氨酸特異性蛋白酶-1(caspase-1)[24]。 NLRP3 識別MSU 晶體信號后發生活化,暴露出核苷酸結合寡聚化結構域(NACHT),進一步募集ASC 和caspase-1 形成炎性小體,切割前體IL-1β,使其成熟后分泌至胞外引發炎癥級聯反應[25]。 在MSU 晶體誘導的GA 大鼠模型及滑膜細胞中均發現NLRP3 表達上調并且MSU 晶體誘導的GA大鼠模型中NLRP3 炎性小體的高表達促進了M? 向M1 型極化[26,27]。
五、巨噬細胞極化與痛風性關節炎治療
NF-κB 信號通路是促進M? 向M1 型極化的主要通路之一,抑制其活化可以阻礙M? 向M1 型極化,以緩解GA 的炎癥。 四妙丸是中醫臨床上經驗性用于治療GA 的經典中藥方劑且具有體內外抗炎活性,即可通過失活NF-κB 信號通路抑制M? 向M1型極化來抑制GA 的炎癥發展,又可以通過誘導M2型極化來促進炎癥的消退[17]。 在痛風性關節炎急性期,劇烈的疼痛可以觸發神經免疫系統,MSU 晶體可以上調背根神經節中分泌卷曲相關蛋白2(secreted frizzled-related protein 2,sFRP2)分泌,并通過調節NF-κB 信號通路抑制MSU 晶體誘導的炎性細胞浸潤和M1 型極化,提示sFRP2 可以作為減輕疼痛和降低不良反應的區域治療方法的新靶點[22]。
沉默信息調節蛋白1(silencing information regulator protein 1,SIRT1)是依賴于煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的第三類組蛋白去乙酰化酶(histone deacetylase,DAC),具有抗炎作用。 白藜蘆醇作為Sirt1 的激活劑,可以抑制TNF-α 誘導的成纖維細胞炎癥,在痛風性關節炎患者中, Sirt1 通過激活PI3K/Akt/STAT6 通路減輕尿酸鹽誘導的炎性反應,激活STAT6 在理論上可能促進M2 型極化,從而發揮抗急性痛風性關節炎的作用[13, 28]。
秋水仙堿作為治療痛風的經典藥物,其主要作用是秋水仙素與α 和β-微管蛋白(tubulin,TUB)結合,形成微管-秋水仙素復合體,防止微管的形成,進而阻礙細胞因子和趨化物質的產生,調節內皮細胞的黏附蛋白表達,抑制IL-1 誘導的L-選擇素的表達,調節細胞因子的成熟和釋放,并減少中性粒細胞對細胞因子的趨化,秋水仙堿可以阻斷MSU 晶體激活NLRP3 炎癥體的過程,從而阻止前IL-1β 的加工和IL-1β 的釋放,達到抑制M? 向M1 型極化的過程[29]。 阿那白滯素(anakinra)、利納西普(rilonacept)、康奈單抗(canakinumab)作為IL-1R 拮抗劑,可有效抑制NLRP3 炎性小體通路,抑制M? 向M1 型極化,且對秋水仙堿等傳統藥物不耐受的患者推薦應用[30]。
六、展 望
在痛風性關節炎中,NF-κB、JAK/STAT、NLRP3炎性小體等多種信號通路參與M? 的極化,不同的藥物可以通過影響M? 極化通路而發揮抗炎作用。 盡管M? 極化在痛風性關節炎中已經被證實,但是M?極化過程中,炎癥的M1 型和抗炎的M2 型位于極化軸的兩端,并且兩者之間存在許多具有混合促炎和抗炎特性的M?/M1/M2 型。 當受到環境、代謝、細胞因子分泌等影響都可能會導致M? 從M1 型轉變到M2型,反之亦然,或者變成兩種細胞的混合體,這也突出了M? 極化的可塑性和復雜性,在痛風性關節炎中仍需開展進一步研究。

