酮體對小鼠膿毒癥急性腎損傷的保護作用及其機制的研究
張家麗 佐拉木·買買提 于 虎
急性腎損傷(acute kidney injury,AKI)是由多種因素引起的以腎功能快速下降為特征的臨床綜合征[1,2]。 AKI 是敗血癥和內毒素血癥的常見并發癥,超過50%的敗血癥患者發展為AKI[3]。 與其他原因引起的AKI 比較,膿毒癥誘發AKI 的病理生理機制十分復雜,死亡風險更高,住院時間更長,預后更差,目前仍缺乏有效的防治方法[3,4]。 越來越多的證據表明,膿毒癥過程中活性氧(reactive oxygen species,ROS)爆發誘發的氧化應激增強會導致腎小球或腎小管上皮細胞細胞功能紊亂、脫落或凋亡,甚至大面積的死亡[5,6]。 許多臨床研究也支持氧化應激損傷在膿毒癥誘導的腎功能進展性衰竭中起了關鍵作用[7,8]。 因此降低膿毒癥腎臟的氧化應激可能是膿毒癥相關AKI 治療的重要靶點。
酮體是人體生命活動重要的替代能源,近年來被發現可以作為信號轉導介質、蛋白質翻譯后修飾的驅動因子發揮廣泛的生物學效應[9]。 酮體包括β-羥基丁酸、乙酰乙酸和丙酮,其中β-羥基丁酸占循環酮體水平的80%,也被證實是主要發揮功能的成分[9]。 有研究證實,增加終末期心力衰竭患者酮體利用可以明顯改善心功能[10]。 也有研究發現,對老年小鼠進行生酮喂養可以減輕神經細胞的氧化損傷,最終表現出記憶和認識能力的提升[11]。 臨床研究也證實,給運動員賽前服用含酮飲料可以顯著增強運動表現[12]。 但鮮有研究觀察酮體對膿毒癥AKI 的作用。 本研究使用連續3 天酮脂灌胃增加體內酮體濃度,通過腹腔注射脂多糖(lipopolysaccharide,LPS)誘導小鼠膿毒癥腎損傷,觀察酮體對于LPS 誘導的AKI是否具有保護作用并研究其可能的機制。
材料與方法
1.主要試劑與儀器:LPS 購自美國Sigma-Aldrich 公司;BCA 蛋白濃度測定試劑盒購自上海碧云天生物技術有限公司;酶標儀購自美國BioTek 公司;倒置顯微鏡購自日本奧林巴斯公司;血酮試紙及血酮儀購自美國羅氏公司;尿腎損傷分子-1(urinary kidney injury molecule-1,KIM-1)ELISA 檢測試劑盒(MKM100)購自美國R&D System 公司;FOXO3A抗體(66428-1)、SOD2 抗體(20809-1)購自中國Proteintech 公司;酮脂購自美國MCE 公司,溶于水制備成100mg/ml 溶液4℃保存;超氧化物歧化酶(superoxide dismutase, SOD)、 過氧化氫酶(catalase,CAT)、還原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、尿微量白蛋白(urine microalbumin,UALb)檢測試劑盒均購自南京建成生物有限公司。
2.動物分組和模型建立:本研究符合《美國NIH實驗室動物使用指南》 的規定,18 只SPF 級雄性C57BL/6J 小鼠,體質量為18.0 ~22.0g(約7 ~8 周齡),購自北京維通利華動物實驗公司。 將小鼠保持在無病原體的條件下,進行22℃、12h/12h 光/暗循環,自由獲取食物和水,適應性喂養1 周后將小鼠隨機分為對照組、模型組和實驗組,每組6 只。 具體處理如下,實驗組:對小鼠連續3 天,每天晨9:00 時灌胃酮脂(1mg/g);模型組:連續3 天灌胃等量0.9%氯化鈉溶液。 實驗組和模型組第3 天灌胃結束后30min 腹腔注射LPS(10mg/kg)以誘導膿毒癥AKI。對照組:連續3 天灌胃等量0.9% 氯化鈉溶液,第3天腹腔注射等量0.9% 氯化鈉溶液。 LPS 處理后24h,取小鼠膀胱尿、血和兩側腎組織,血液樣本4000r/min 離心10min 取上清,-80℃留存備用。 左腎組織用4%多聚甲醛固定,右腎組織-80℃留存備用。
3.腎功能指標(SCr、BUN、UAIB/Cr 和KIM-1)檢測:參照試劑盒說明測定各組小鼠血中SCr 和BUN水平,同樣參照說明檢測尿液樣本中KIM-1 和UALb/Cr 水平。
4.腎臟組織病理學檢測:取各組小鼠左腎,多聚甲醛固定和石蠟包埋后切3μm 厚的切片,HE 染色觀察腎組織形態學變化,倒置顯微鏡下采用細胞水腫、細胞凋亡、細胞壞死、炎性細胞浸潤和出血對與腎組織相對應的5 個區域的損傷程度進行盲法評分。AKI 評分標準分5 個等級:0 分,正常腎組織;1 分,腎小管受損范圍<25%;2 分,腎小管受損范圍≥25%且<50%;3 分,腎小管受損范圍≥50% 且<75%;4分,腎小管受損范圍≥75%。
5.氧化應激水平檢測:各組小鼠分別取20mg 腎臟,按照試劑盒說明分別進行MDA 含量,SOD、GSH和CAT 活性測定。 BCA 法定量校正蛋白后得到MDA 含量(nmol/mg)、SOD 活性(U/g)、GSH 活性(U/g)和CAT 活性(U/g)。
6.從腎組織中提取總蛋白,用BCA 蛋白濃度試劑盒進行蛋白定量后將蛋白變性,將含有30μg 蛋白質的樣品經SDS-PAGE 分離后轉移到PVDF 膜上。室溫下用5%脫脂牛奶封閉1h 后,分別用FoxO3a 一抗(1∶1000)和SOD2(1∶10000)一抗在4℃下孵育過夜,次日,TBST 洗膜3 次,加入熒光兔二抗(1∶10000)溶液室溫搖床孵育1h,TBST 洗膜3 次后進行顯影。用Image J 測得FoxO3a 和SOD2 灰度值與內參蛋白GAPDH 灰度值之比作為相對表達值。
7.統計學方法:應用GraphPad Prism 8.0 統計學軟件對數據進行統計分析。 計量資料以均數± 標準差(±s)表示,使用非配對雙尾Student t檢驗對兩組之間計量資料進行分析,使用重復測量單因素方差分析結合Sidak檢驗對成組數據進行分析,以P<0.05為差異有統計學意義。
結 果
1.酮體對LPS 誘導的膿毒癥小鼠腎功能和組織結構的影響:與對照組比較,模型組小鼠BUN、SCr、UALB/Cr 和KIM-1 水平均顯著升高(P<0.001,圖1 中B ~E)。 實驗組血β-羥基丁酸濃度明顯高于對照組和模型組(P<0.001,圖1A)。 與模型組比較,實驗組BUN 和SCr 水平及UALB/Cr 和KIM-1 水平均有所降低(P<0.001,圖1 中B ~E)。 同樣,各組小鼠腎臟組織學改變與腎功能結果一致,模型組小鼠腎組織損傷明顯,表現為明顯的腎小球壞死、空泡樣變性,腎間質水腫及炎性細胞浸潤(圖1F),腎損傷評分高于對照組(P<0.001,圖1G)。與模型組比較,實驗組小鼠腎損傷程度有所改善(圖1F),腎損傷評分降低(P<0.001,圖1G)。
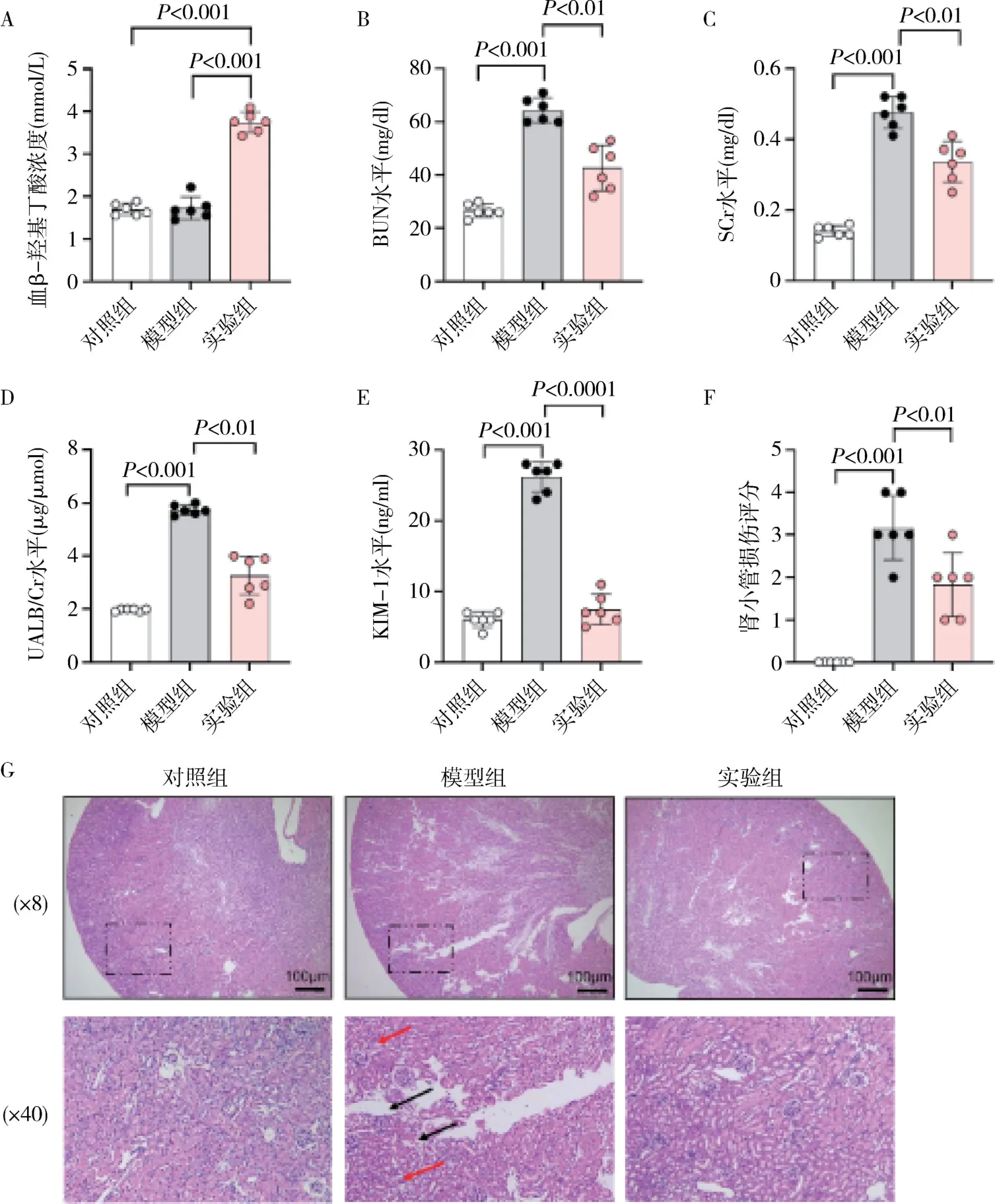
圖1 各組小鼠腎功能指標和腎組織病理結構
2.酮體對LPS 誘導的小鼠急性腎損傷氧化應激的影響:與對照組比較,模型組小鼠腎組織MDA 含量顯著上升(P<0.001,圖2A),其余抗氧化酶,包括SOD、GSH 和CAT 活性均明顯下降(P<0.001,圖2中B ~D)。 與模型組比較,實驗組小鼠腎組織MDA含量較低(P<0.001,圖2A),SOD、GHS 和CAT 活性均有一定恢復(P<0.001,圖2 中B ~D)。
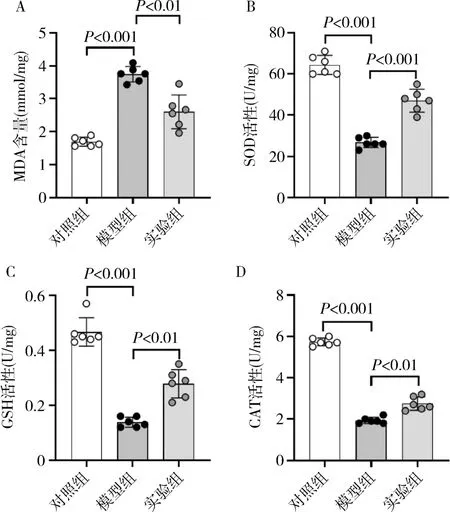
圖2 各組小鼠腎組織氧化應激指標
3.酮體對LPS 誘導的小鼠急性腎損傷FoxO3a 和SOD2 蛋白表達的影響:與對照組比較,模型組小鼠腎組織中FoxO3a 和SOD2 蛋白水平均明顯下降(P<0.001)。 與模型組比較,實驗組小鼠腎組織FoxO3a和SOD2 蛋白表達有所上升(P<0.001),詳見圖3。
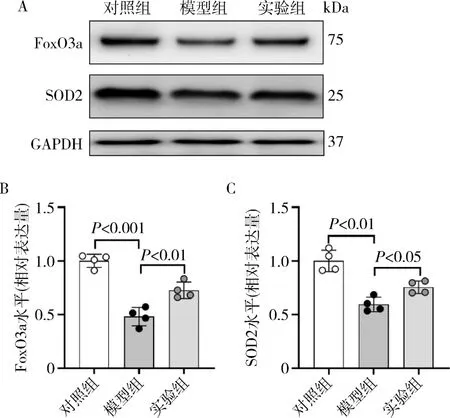
圖3 蛋白免疫印跡檢測各組小鼠腎組織中FoxO3a 和SOD2 的表達
討 論
AKI 是一種以血肌酐水平快速升高和腎臟排泄功能突然喪失為特征的復雜臨床綜合征,已被視為與高發生率和高病死率相關的重大公共衛生問題[13]。全球范圍內,住院或重癥監護病房患者的AKI 患病率相當驚人[4,13]。 盡管腎臟替代療法已取得相當的進步,但大多數患者仍然面臨嚴重腎功能損害[2,4]。值得注意的是,敗血癥被看做是危重患者AKI 的重要觸發器。 大量研究表明,膿毒癥誘導的AKI 腎功能變化更明顯,腎臟組織學變化更劇烈,總體病死率更高[2,14]。 因此,迫切需要制定有效的治療策略來緩解這一嚴重臨床癥狀并改善預后。
本研究通過腹腔注射LPS 誘導小鼠膿毒癥后,小鼠腎小球濾過功能指標BUN 和SCr 和腎小管損傷指標KIM-1 都明顯增高,提示AKI 的發生[16,17]。HE 染色也顯示腎組織結構的破壞,表現為腎小管上皮細胞出現大量空泡,小管內可見散在鑄型和脫落細胞及炎性細胞的浸潤,與文獻報道一致[7,15]。 本研究中酮脂灌胃的小鼠上述指標和腎臟結構都趨于正常,明確了酮體對膿毒癥腎損傷的保護作用。 此外,大量研究已經證明活性氧爆發導致的氧化應激損傷是AKI 發病的關鍵因素之一[6,18]。 在生理條件下,細胞內氧化應激與抗氧化防御處于平衡,當活性氧生成過多時,抗氧化通路被激活以清除增多的活性氧,以維持細胞正常功能,其中SOD、CAT 和GSH 都是胞內重要的抗氧化物質[5,6]。 本研究發現,LPS 處理的小鼠腎組織內上述幾種抗氧化酶活性均顯著下降,脂質過氧化終產物MDA 含量也明顯增加。 因此,減輕腎臟氧化應激可能對急性腎損傷起到保護作用。
近年來,酮體作為信號分子,在調節蛋白翻譯后修飾以及炎癥和氧化應激過程中的重要作用備受關注[9,19]。 β-羥基丁酸是循環血中酮體的主要形式,生理條件下,人血液中β-羥基丁酸濃度維持在0.02 ~0.10mmol/L,禁食48 ~72h 可提升至2 ~3mmol/L,更長時間的禁食或生酮喂養會進一步增加其至5 ~8mmol/L[9,10]。 有研究發現,在人胚胎腎細胞,β-羥基丁酸可以通過促進組蛋白乙酰化來增加抗氧化基因的表達,從而減輕細胞氧化應激[20]。 也有研究發現,β-羥基丁酸可以通過增加谷胱甘肽過氧化氫酶活性對缺血性腦卒中起到保護作用[11]。 總之,酮體已經在細胞、動物和在體層面都顯示出相當的益處,但尚未研究觀察酮體對膿毒癥急性腎損傷的影響。因此本研究通過灌胃酮脂升高小鼠血酮濃度并且改善了小鼠腎功能和腎損傷,同時伴隨抗氧化酶活性的提高,更重要的是發現抗氧化通路FoxO3a 及下游靶蛋白SOD2 表達的增強,從而介導腎臟抗氧化應激,這與既往研究結果一致[20]。
綜上所述, 酮體可以通過促進抗氧化通路FoxO3a 和SOD2 的表達,減輕氧化應激損傷來防止腎功能惡化和腎組織的破壞。 本研究也存在一定的不足,酮體上調FoxO3a 和SOD2 表達的具體機制,還需要進行更深層次地驗證。

