miR-16-5p通過調控PD-L1表達影響肝星狀細胞炎癥反應的研究
詹東昂 柯峰 楊超 劉華
肝纖維化是對一系列慢性肝損傷的愈合反應,主要特征為細胞外基質(extracellular matrix,ECM)過度沉積并最后發展為肝硬化[1]。肝星狀細胞被激活后增殖,大量分泌ECM導致肝纖維化發生[2]。miRNA為小分子非編碼RNA,長度約21~25個堿基,廣泛參與調控細胞的增殖、凋亡及機體炎癥反應等多種生命活動[3-5]。相關研究報道miRNA參與調節肝纖維化的發生,如馬艷華等[6]研究表明健康人與肝纖維化患者的血漿樣本中存在104個差異miRNA,其中72個表達下調,包括miR-450b-5p、miR-455-5p等,32個miRNA表達上調,包括miR-16-5p、miR-182-5p等;冉龍嬌等[7]也發現在肝星狀細胞的活化及肝纖維化過程中,均有多種miRNA出現差異表達,或上調或下調。通過靶基因預測在線分析發現,miR-16-5p可能與程序性死亡受體-1(programmed cell death-1,PD-1)存在結合位點,PD-1及其配體PD-L1(CD274)屬于負共刺激分子,主要參與調控多種腫瘤及自身免疫性疾病的免疫逃逸過程,抑制免疫應答的激活,目前作為腫瘤等治療的重要免疫檢查點[8]。相關研究表明,抑制PD-1/PD-L1表達與治療自身免疫性肝炎密切相關[9]。因此推測miR-16-5p可能介導PD-L1表達參與調控活化的肝星狀細胞及炎癥反應。本實驗以大鼠肝星狀細胞HSC-T6為研究對象,探討miR-16-5p是否參與調控PD-L1表達而影響肝星狀細胞生理形態及炎癥水平,以期為臨床上治療肝纖維化及炎癥提供可能的治療靶點,現報道如下。
1 材料和方法
1.1 主要材料 肝星狀細胞HSC-T6(武漢普諾賽生命科技有限公司);DMEM培養基(美國Hyclone公司,批號:SH30022.01B);FBS(美國 Gibco公司,批號:10270-106);PBS(批號:P1010)、胰蛋白酶(批號:T1350)和濃度測定試劑盒(批號:PC0020)均來自北京索萊寶科技有限公司;Trizol試劑(美國Ambion公司,批 號 :15596026);轉 化 生 長 因 子 β1(transforming growth factor-β1,TGF-β1,英國Abcam公司);CCK-8試劑盒(中國Solarbio公司,批號:CA1210);蛋白質Marker(美國Helix公司,批號:P12103);PVDF轉移膜和化學發光試劑(中國Millipore公司,批號:IPVH00010);鼠抗細胞PD-L1抗體、兔抗NF-κB抗體、兔抗甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體 、羊抗兔IgG和羊抗鼠IgG(中國Bioswamp公司);兔抗磷酸化的NF-κB(nuclear factor kappa B,p-NF-κB)抗體(中國CST公司)。
1.2 方法
1.2.1 細胞培養、分組及處理 HSC-T6細胞培養于含10%FBS的DMEM培養基中,于37℃、5%CO2培養箱內培養,均按照1∶2~1∶4進行傳代。將細胞分為6組并分別處理:對照組、模型組(5 ng/ml TGF-β1處理48 h)、miR-16-5p超表達組(轉染miR-16-5p mimics 24 h后,再用 5 ng/ml TGF-β1處理48 h)、miR-16-5p抑制組(轉染miR-16-5p inhibitor 24 h后,再用5 ng/ml TGF-β1處理48 h)、超表達-空載組(轉染mimics-NC 24 h后,再用5 ng/ml TGF-β1處理48 h)和抑制-空載組(轉染inhibitor-NC 24 h后,再用5 ng/ml TGF-β1處理48 h)。
1.2.2 細胞轉染 將 100 pmol miRNA、5 μl Lipofectamine 2000分別稀釋于250 μl Opti-MEM中,混勻后,將兩者混合液室溫孵育20 min,然后將其加入到融合度為90%的細胞中,37℃、5%CO2轉染4 h后,更換新鮮培養基,培養24 h,測定miR-16-5p的表達水平以觀察轉染效果。
1.2.3 各組細胞 TNF-α、IFN-γ、miR-16-5p、PD-L1、IL-6、IL-10 mRNA表達水平檢測 采用RT-qPCR法。加入TGF-β1處理48 h收集細胞,用Trizol法提取各組細胞總RNA,將mRNA反轉錄成cDNA。以cDNA為模板進行qPCR擴增。反應條件為:95℃預變性3 min,95 ℃變性5 s,56 ℃退火10 s,72 ℃延伸25 s,共40個循環,其中GAPDH和U6作為內參進行樣品間的校正,使用2-ΔΔCt法進行統計分析。引物序列見表1。

表1 引物序列
1.2.4 各組細胞形態學觀察 收集各組細胞,稀釋細胞懸液濃度至1×105個細胞/孔,每孔2 ml,37℃、5%CO2培養箱中培養過夜,使細胞貼壁。對照組于正常培養基中培養,模型組、miR-16-5p超表達組、miR-16-5p抑制組、超表達-空載組和抑制-空載組的細胞培養基中加入終濃度為5 ng/ml的TGF-β1,繼續培養24、48、72或48 h。取出細胞培養板,光鏡下觀察各組細胞形態,拍照、收樣。
1.2.5 各組細胞增殖能力檢測 采用CCK-8法。將細胞濃度稀釋為3×103個細胞/孔,取100 μl細胞液接種到96孔板,37℃、5%CO2培養箱中培養過夜,使細胞貼壁。對照組于正常培養基中培養,另外5組細胞培養基中加入終濃度為5 ng/ml的TGF-β1刺激48 h,然后均加入10 μl CCK-8溶液,繼續培養4 h。酶聯免疫檢測儀測量各孔450 nm處的吸光值,以吸光值表示細胞增殖能力。同時設置調零孔(培養基、CCK-8溶液),每組設定3個復孔。
1.2.6 各組細胞PD-L1、NF-κB、p-NF-κB蛋白表達水平檢測 采用Western blot法。收集各組細胞,加入適量預冷的1×PBS洗滌后,按照每1×106個細胞加入裂解液200 μl,充分裂解后,取上清液進行蛋白質定量。SDS-PAGE電泳后,選用90 V轉膜50 min,5%脫脂奶粉4℃封閉過夜,加一抗,PD-L1抗體(1∶2 000)、NF-κB抗體(1∶1 000)、p-NF-κB抗體(1∶1 000)和GAPDH抗體(1∶10 000)室溫孵育1 h,洗膜,按照1∶10 000稀釋HRP標記的二抗,室溫孵育1 h。洗膜,選用ECL化學發光法顯色,通過TANON GIS軟件讀取相關條帶灰度值。
1.3 統計學處理 采用SPSS 23.0統計軟件。計量資料以表示,多組比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 對照組和模型組細胞形態學比較 光鏡下觀察可見,對照組和模型組細胞在開始培養時(0 h),細胞形態和數量無明顯差異。與對照組同期培養時間相比(24、48、72 h),模型組細胞數量明顯增多,延展性更好,并且5 ng/ml TGF-β1刺激后,細胞表現為肌纖維細胞形態的特征。隨著培養時間增加,細胞密度增大,形態變小,呈現出多邊形的梭形,且相鄰細胞有偽足相連,在培養板表面整齊均勻分布。見圖1。
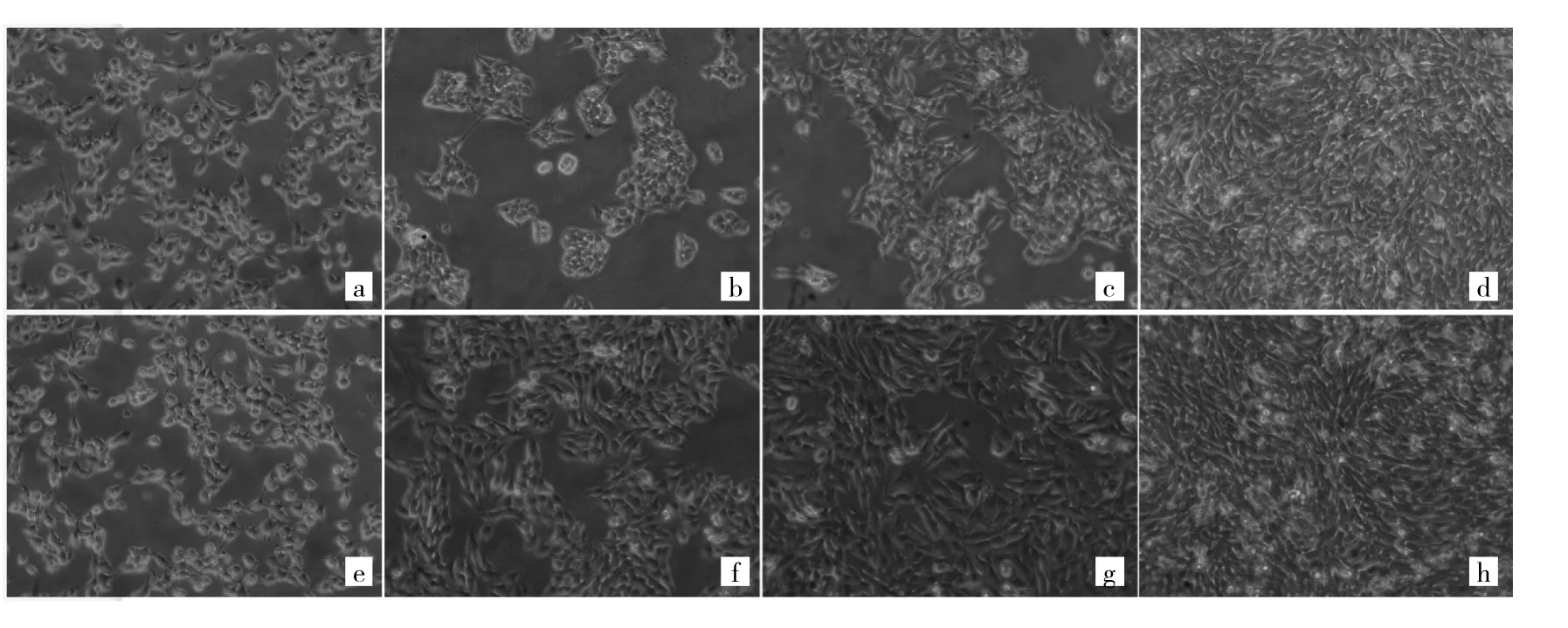
圖1 對照組和模型組細胞形態學比較(a、b、c、d:分別為對照組細胞培養0、24、48、72 h;e、f、g、h:分別為模型組細胞培養0、24、48、72 h;×200)
2.2 TGF-β1不同作用時間的模型組細胞TNF-α、IFN-γ mRNA表達水平比較 與TGF-β1作用0 h相比,TGF-β1作用24 h時的模型組細胞TNF-α、IFN-γ mRNA表達水平比較差異均無統計學意義(均P>0.05);TGF-β1作用48、72 h時的模型組細胞TNF-α、IFN-γ mRNA表達水平比較顯著增高(均P<0.05),且以48 h時最高(P<0.05)。見圖2。
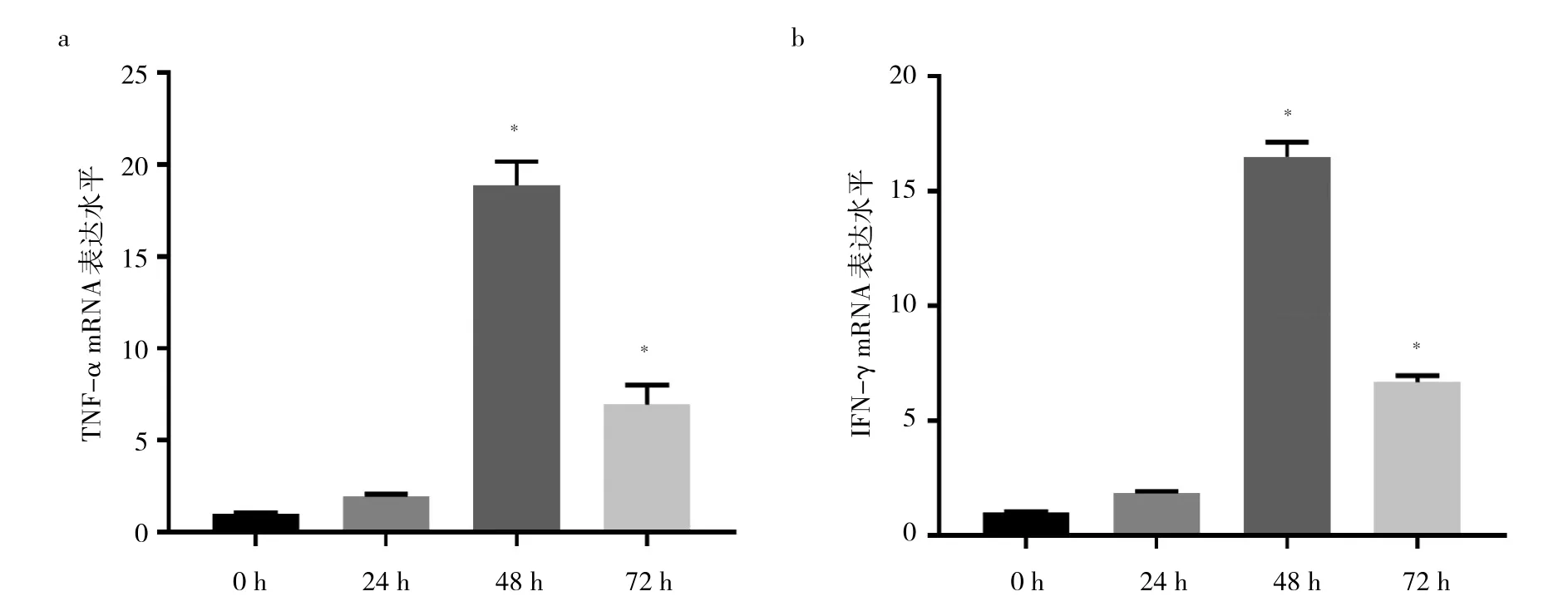
圖2 TGF-β1不同作用時間的模型組細胞TNF-α、IFN-γ mRNA表達水平比較
2.3 各轉染組細胞轉染效果比較 與對照組相比,超表達-空載組和抑制-空載組細胞中miR-16-5p表達水平差異均無統計學意義(均P>0.05);與超表達-空載組相比,miR-16-5p超表達組細胞miR-16-5p表達水平升高(P<0.05);與抑制-空載組相比,miR-16-5p抑制組細胞miR-16-5p表達水平降低(P<0.05)。見圖3。
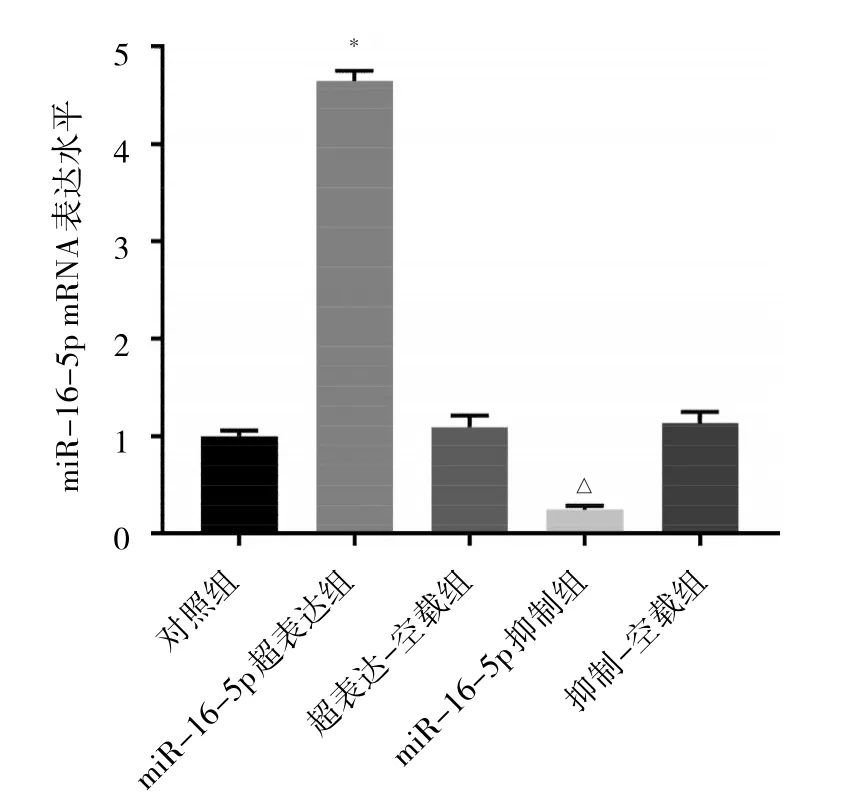
圖3 各轉染組細胞miR-16-5p表達水平比較
2.4 模型組、miR-16-5p超表達組、miR-16-5p抑制組、超表達-空載組和抑制-空載組細胞形態學比較與模型組相比,miR-16-5p超表達組細胞數量明顯減少,肌纖維細胞形態減少;miR-16-5p抑制組細胞數量明顯增多,形態無明顯變化;超表達-空載組和抑制-空載組細胞形態及數量無明顯差異。見圖4。

圖4 模型組、miR-16-5p超表達組、miR-16-5p抑制組、超表達-空載組和抑制-空載組細胞形態學比較(a:模型組;b:miR-16-5p超表達組;c:miR-16-5p抑制組;d:超表達-空載組;e:抑制-空載組;×200)
2.5 各組細胞增殖能力比較 與模型組相比,miR-16-5p-超表達組A值明顯降低(P<0.05),細胞增殖能力下降;miR-16-5p抑制組A值明顯升高,細胞增殖能力增強(P<0.05);超表達-空載組和抑制-空載組細胞增殖能力均無明顯變化(均P>0.05)。見圖5。

圖5 各組細胞增殖能力比較
2.6 各組細胞PD-L1、NF-κB、p-NF-κB蛋白表達水平比較 與模型組相比,超表達-空載組和抑制-空載組細胞中PD-L1、p-NF-κB/NF-κB蛋白表達水平均無統計學差異(均P>0.05);miR-16-5p超表達組PD-L1蛋白表達水平升高(P<0.05),p-NF-κB/NF-κB蛋白表達水平降低(P<0.05);miR-16-5p抑制組PD-L1蛋白表達水平降低(P<0.05),p-NF-κB/NF-κB蛋白表達水平均升高(均P<0.05)。見圖6。

圖6 各組細胞PD-L1、NF-κB、p-NF-κB蛋白表達水平比較(a:蛋白表達電泳圖比較;b:PD-L1蛋白表達水平比較;c:p-NF-κB/NF-κB蛋白表達水平比較)
2.7 各組細胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA表達水平比較 與模型組相比,超表達-空載組和抑制-空載組細胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA 表達水平比較差異均無統計學意義(均P>0.05);miR-16-5p超表達組miR-16-5p、PD-L1、IL-10 mRNA表達水平均升高(均 P>0.05),TNF-α、IFN-γ、IL-6 mRNA 表達水平均降低(均P>0.05);miR-16-5p抑制組miR-16-5p、PD-L1、IL-10表達水平均降低(均P<0.05),TNF-α、IFN-γ、IL-6 mRNA表達水平均升高(均P<0.05)。見圖7。
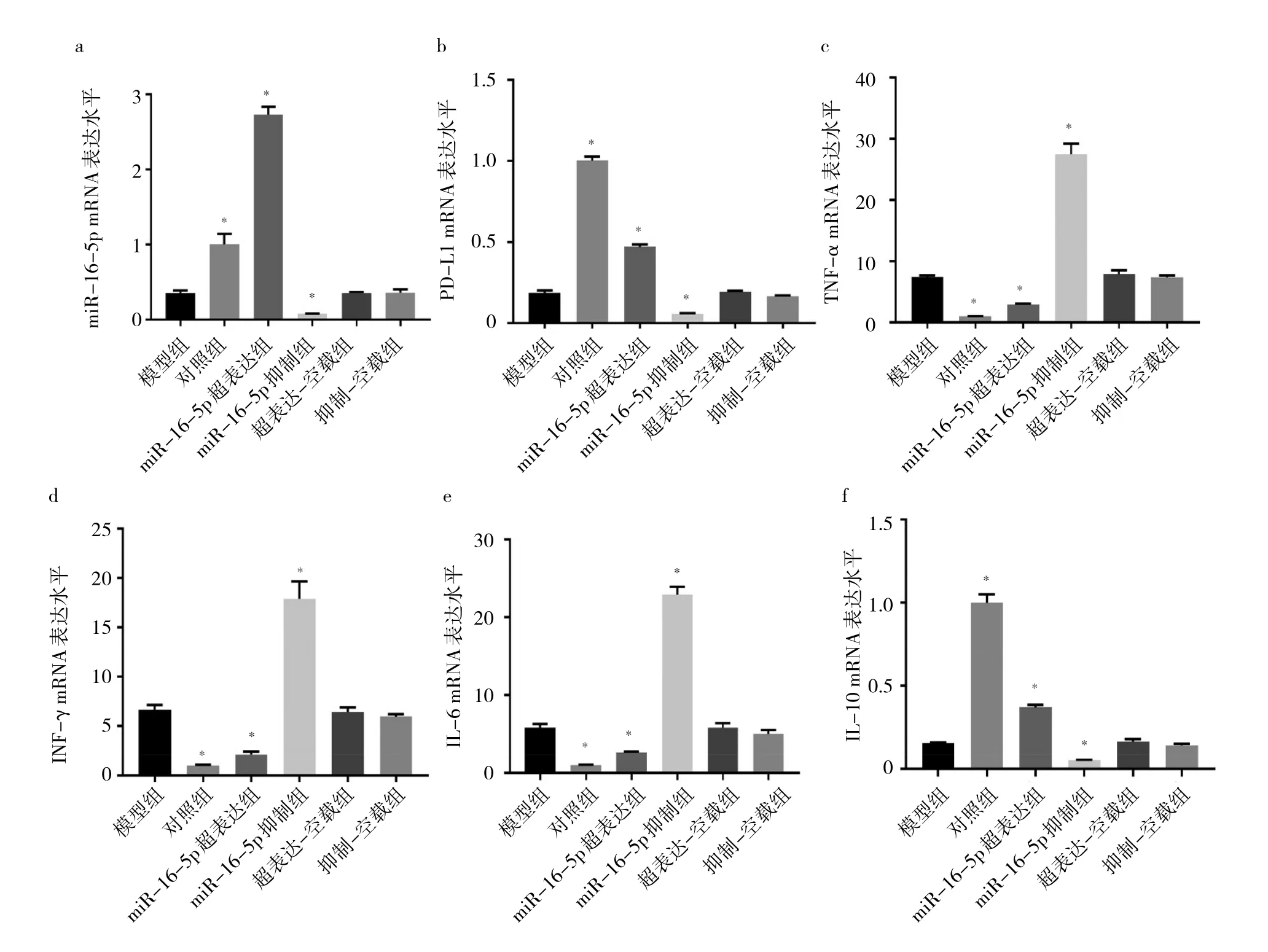
圖7 各組細胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA表達水平比較
3 討論
肝星狀細胞分為靜息和激活兩種狀態,在某些介質因素如活性氧物質、纖維化細胞因子如TGF-β、血小板源生生長因子(platelet derived growth factor,PDGF)[10]等的刺激下,肝星狀細胞被激活,增殖并轉化為肌成纖維細胞樣細胞(myofibroblast like cells,MFB)[2]。肝星狀細胞的活化屬于級聯活化模式,肝細胞受損后分泌有絲分裂的作用因子刺激自身細胞增殖,喪失接觸抑制能力,同時與其毗鄰細胞共同作用釋放大量TNF-α、TNF-β、IFN-γ等細胞因子促進肝星狀細胞活化、增殖,另外MFB樣細胞也會自分泌TGF、PDGF等細胞因子促進自身的活化及增殖等[11]。本研究選用TGF-β1刺激HSC-T6細胞0、24、48、72 h,TGF-β1介導的TGF-β/Smad信號通路是肝星狀細胞活化及增生的關鍵環節[10],結果顯示細胞增殖具有時間誘導依賴性,細胞數量隨藥物處理時間的延長而增多,另外發現TGF-β1刺激HSC-T6細胞48 h,細胞內TNF-α和IFN-γ表達含量顯著升高,這表明TGF-β1處理48 h時,細胞內的炎癥反應最強,HSC活化正處于最繁盛時期。因此篩選此時間點為TGF-β1的最佳作用時間。
我國有大量的急性肝炎發展為慢性炎癥,最終形成肝硬化的病例。肝纖維化的發展速度受發病病因、環境和遺傳因素等的影響[12]。近年來大量文獻表明多種miRNA與肝纖維化的發生密切相關,miRNA的異常表達參與調控HSC的活化及肝纖維化相關信號通路[13]。如Lakner等[14]通過miRNA微陣列分析靜息態HSC被激活后miRNA的表達情況,發現3種miRNA表達上調(miR-34c、miR-184和miR-221),8種miRNA表達下調(miR-16、miR-19a、miR-19b、miR-29a、miR-29c、miR-92a、miR150、miR-194)。本研究發現肝星狀細胞被TGF-β1刺激活化后,胞內miR-16-5p的表達水平也出現下調,并且預測的目的靶蛋白PD-1表達水平也明顯下降,與miR-16-5p的表達呈正相關。PD-1是一種免疫共抑制分子,通過負調控T、B細胞激活而抑制免疫應答,張宏宇等[15]研究表明PD-1通過抑制其表達降低肝細胞損傷,減少炎癥反應,抑制肝炎向肝纖維化的發展。本研究檢測肝星狀細胞活化后相關炎癥細胞因子,發現促炎癥因子p-NF-κB/NF-κB、TNF-α、IFN-γ、IL-6表達水平顯著升高,而抗炎因子IL-10表達水平明顯降低。NF-κB可調控多種炎癥和抗炎因子的表達來調節肝星狀細胞的活化、增殖從而影響肝纖維化的發展[16-17];IFN-γ和TNF-α在人表皮淋巴管內皮細胞的炎癥反應中具有協同促進PD-L1表達的作用[11]。與之相同,對比模型組,miR-16-5p超表達組細胞內miR-16-5p、PD-L1表達上調,炎癥反應降低,抑制細胞增殖;miR-16-5p抑制組miR-16-5p、PD-L1表達下調,細胞活化增殖,炎癥反應加劇。
綜上所述,miR-16-5p在激活的肝星狀細胞中的表達水平低于靜息態細胞,高表達miR-16-5p可促進PD-L1表達上調,抑制細胞增殖,降低細胞炎癥反應,其作用機制可能參與治療肝纖維化的發展。

