美洲商陸PaENO基因克隆及其表達分析
趙 樂,朱畇昊,許 姣,宋夢瑤,馮衛生,鄭曉珂*
(1 河南中醫藥大學 藥學院,鄭州 450046;2 呼吸疾病中醫藥防治省部共建協同創新中心,鄭州 450046)
烯醇化酶(enolase,ENO)是糖酵解途徑的一個關鍵酶,能夠催化2-磷酸甘油酸(2-phosphoglycerate,2-PGA)轉變為磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)的可逆反應。烯醇化酶廣泛存在于原核和真核生物中,氨基酸序列保守程度較高,參與生物體內的能量代謝,而且是細胞中含量最豐富的胞質蛋白之一[1]。人體內有3種烯醇化酶,分別是α、β、γ-ENO,其中α-ENO普遍分布在各個組織,β-ENO主要存在于肌肉組織,γ-ENO只分布在神經組織[2],其中對α-ENO研究較為深入,除了具有糖酵解的酶活性以外,α-ENO還與多種疾病的發生有關,如癌癥、自身免疫性疾病、缺血和細菌感染等[3]。在擬南芥中也有3種烯醇化酶AtENO1、AtENO2(LOS2)和AtENO3(AtENOC),其中AtENO2與人的α-ENO相似性較高,都含有烯醇化酶N端保守結構域和DNA結合區[4]。
近年來,在植物中的研究表明,ENO除了作為一種糖酵解的酶,在植物的生長發育以及應對非生物脅迫過程也發揮重要作用。敲除擬南芥AtENO2基因,會導致細胞變小和細胞分化缺陷,使根、芽和維管等組織的發育出現障礙、花器官形成受到損傷[1, 5]。AtENO2還能夠以轉錄因子的形式調控STZ/ZAT10基因的表達,參與植物應對低溫脅迫[6]。植物蛋白質組學分析也發現,ENO在多種植物中參與逆境脅迫,如鹽脅迫、干旱和冷脅迫,在受到干旱脅迫時玉米中ENO活性和mRNA的轉錄水平都明顯上升,蛋白表達水平也升高[7],鎘(cadmium,Cd)脅迫處理后,酵母和擬南芥中ENO蛋白的表達豐度顯著提高[8]。
美洲商陸(PhytolaccaamericanaL.)又名垂序商陸,是商陸科商陸屬多年生草本植物,對重金屬錳(manganese,Mn)和Cd具有超富集作用[9],是一種比較理想的可用于植物修復的超富集植物[10]。前期美洲商陸應答Cd脅迫的蛋白質組學和轉錄組學結果研究表明,Cd處理后PaENO蛋白的表達水平顯著升高,Western blot的結果也表現出相同的趨勢[11-12],說明PaENO可能參與美洲商陸應對Cd脅迫。本研究從美洲商陸葉中克隆了PaENO基因,進行了序列分析、原核表達與純化、表達模式以及抗Cd分析,為今后研究PaENO基因在美洲商陸應對Cd脅迫過程中的分子機制奠定了基礎。
1 材料和方法
1.1 材料及處理
美洲商陸種子采自河南省中藥植物園,根據河南中醫藥大學生物制藥工程實驗室前期報道方法[12],種子分別用98%硫酸和70%乙醇進行表面消毒各15 min,再用無菌水漂洗3次,然后將種子放置于1/2 MS培養基上,在人工氣候箱中生長,培養條件為光照16 h、23 ℃,黑暗8 h、20 ℃。3周后種子萌發長成幼苗,將幼苗轉移到含1/2 Hoagland營養液的培養瓶中繼續生長,每2 d更換1次營養液。培養3周后,美洲商陸幼苗長出2片子葉和6片真葉,在Hoagland營養液加入400 μmol/L CdCl2,進行Cd脅迫處理,對照和處理都有3個獨立的生物學重復,然后分別在Cd處理0、2、12、24 h采集美洲商陸幼苗的根、莖、葉等組織,用于RNA的提取。
1.2 方 法
1.2.1PaENO基因克隆使用植物總RNA提取試劑盒(天根)提取美洲商陸根、莖、葉的總RNA,經檢測完整后,使用TransScriptⅡ反轉錄酶試劑盒(全式金)提取得到的美洲商陸根、莖、葉組織的總RNA為模板,Oligo(dT)20為引物,反轉錄得到美洲商陸各組織的cDNA。
根據河南中醫藥大學生物制藥工程實驗室獲得的美洲商陸轉錄組數據(SRA No. SRP105831),設計1對特異性引物PaENO-F(ATGGTTACCATCAAGTGCGTCAAAG)和PaENO-R(TTAGTAGGGCTCAACAGGCTGG),用PrimerSTAR HSTaq(TaKaRa)擴增PaENO基因,PCR程序為:95 ℃ 2 min;95 ℃ 10 s,59 ℃ 15 s,72 ℃ 1 min 30 s,35個循環;72 ℃延伸8 min。PCR結束后,在反應體系中加入rTaq(TaKaRa),在72 ℃反應10 min進行平末端加A反應,然后進行瓊脂糖凝膠電泳檢測,回收純化與目的基因大小一致的條帶,進行T-A克隆,將其連接到pMD19-T載體上,轉化Trans5α感受態細胞,挑單克隆進行菌落PCR鑒定,陽性克隆進行測序。
1.2.2PaENO基因的序列分析利用NCBI blastx,將PaENO的基因序列與nr(non-redundant)數據庫進行序列比對。用DNAMAN 6.0將PaENO蛋白與其他植物的ENO蛋白進行氨基酸序列比對,使用ProtParam tool預測PaENO蛋白的理化性質,用InterPro Scan分析PaENO蛋白的保守結構域,用SWISS-MODEL預測PaENO蛋白的三維結構,使用TargetP 1.1、SignalP 5.0和TMHMM 2.0等軟件分別預測PaENO蛋白的亞細胞定位、信號肽和跨膜域,利用MEGA 7軟件 NJ(Neighbor-Joining)法構建系統進化樹。
1.2.3PaENO基因的原核表達和純化根據PaENO基因的序列信息,選擇合適的酶切位點,將其連接到原核表達載體pET-28a上,設計1對原核表達引物PaENO-Exp-F(CGGAATTCATGGTTACCATCAAGTGCG,劃線序列為EcoRⅠ酶切位點),PaENO-Exp-R(CCGCTCGAGTTAGTA-GGGCTCAACAGGC,劃線序列為XhoⅠ酶切位點),以1.2.1中測序正確的pMD19-T-PaENO質粒為模板,用PrimerSTAR HSTaq(TaKaRa)擴增PaENO基因的ORF序列,PCR程序為:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 15 s,72 ℃ 1 min 30 s,30個循環;72 ℃延伸8 min。經電泳檢測回收PCR產物,然后用EcoRⅠ和XhoⅠ對原核表達載體pET-28a和PCR回收產物進行雙酶切,雙酶切完成后回收載體和目的基因,用T4DNA 連接酶在16 ℃過夜連接載體和目的基因,然后取連接產物轉化BL21(DE3)感受態細胞,挑單克隆進行菌液PCR和雙酶切鑒定,將鑒定正確的單克隆送上海生工進行測序。
將測序正確的單克隆接種到LB液體培養基中過夜培養,根據生物制藥工程實驗室已發表的誘導純化方法[13],加入IPTG使其終濃度為0.4 mmol/L,然后在28 ℃、150 r/min條件下誘導PaENO蛋白的表達,用SDS-PAGE 檢測目的蛋白的表達。用Ni親和層析試劑盒(康為世紀)純化目的蛋白,然后用含不同濃度咪唑(50、100、200、300、400和500 mmol/L)的緩沖液梯度洗脫目的蛋白,經SDS-PAGE檢測后,收集含有單一條帶的蛋白樣品進行透析和超濾。
1.2.4PaENO基因表達模式分析將美洲商陸各組織的cDNA稀釋10倍,作為實時熒光定量PCR(qRT-PCR)的模板,以美洲商陸的α-TUBLIN基因[12,14]作為內參基因(α-TUBLIN-qF:ATTGG-GTAGATTGCCAGGAG和α-TUBLIN-qR:AG-TTTGTGGACTGGTGCTCCAC),檢測PaENO基因在美洲商陸根、莖、葉等組織中的表達,以及在Cd處理0、2、12和24 h葉片中的表達。PaENO基因的qRT-PCR引物為PaENO-qF(AGAGTCCAAAAGGCCATCGA)和PaENO-qR(CCACAGAAAGGTCAGCGATG)。每個樣品重復3次,在ABI QuantStudio 5 實時熒光定量PCR系統進行分析。qRT-PCR的反應體系為:cDNA模板2 μL,正反向引物各0.8 μL,2×TransStartTop Green qPCR SuperMix (TransGen) 10 μL,加ddH2O至20 μL,反應程序設定為:94 ℃ 30 s;94 ℃ 5 s,56 ℃ 15 s,72 ℃ 30 s,40個循環,用ABI Q5系統自帶軟件,采用2-ΔΔCT方法進行基因相對表達量的分析。
1.2.5 大腸桿菌抗Cd分析為了檢測PaENO對Cd的抗性,將含有pET-28a和pET28a-PaENO質粒的大腸桿菌BL21 (DE3)菌株,在37 ℃、200 r/min條件下過夜培養,然后將其稀釋到OD600為0.1,在LB液體培養基中加入IPTG(終濃度為0.4 mmol/L)和CdCl2(終濃度為1 mmol/L),每隔1 h在600 nm處測定吸光度,檢測大腸桿菌在Cd脅迫條件下的生長速率。同時各取100 μL含有pET-28a和pET28a-PaENO質粒的大腸桿菌,均勻涂布在LB固體培養基上(含有0.4 mmol/L IPTG和1 mmol/L CdCl2),在37 ℃培養48 h,觀察大腸桿菌在Cd脅迫下的生長狀況。
2 結果與分析
2.1 PaENO基因克隆
通過分析本實驗室的美洲商陸轉錄組數據,有一條注釋為ENO的轉錄本,長度為1 855 bp,包含一個完整的開放閱讀框(ORF),根據ORF序列信息,設計特異性引物,擴增得到一個長度約為1 300 bp的PCR產物(圖1),測序后獲得美洲商陸PaENO基因的ORF序列信息,大小為1 335 bp,編碼444個氨基酸,GenBank登錄號為JN656932.1。
2.2 PaENO蛋白序列分析
ProtParam預測結果顯示,PaENO蛋白的分子量為48.16 kD,理論等電點是5.39。InterPro保守結構域分析結果表明,PaENO蛋白屬于烯醇化酶家族(IPR036849),在N端4~139 aa為烯醇化酶N端結構域(IPR020811),在C端147~440 aa是烯醇化酶C端TIM 桶狀結構域(IPR020810)。TargetP預測結果表明PaENO可能位于細胞質,SiganlP預測PaENO不含信號肽,TMHMM預測顯示PaENO蛋白沒有跨膜結構域。用PredictProtein預測PaENO蛋白二級結構,結果顯示PaENO蛋白由35.36% α-螺旋、13.06% β-折疊和51.58%的無規則卷曲組成。以人的γ-ENO晶體結構(1TE6)為模板,根據SWISS-MODEL三維結構的預測結果,PaENO可能具有四級結構,以同源二聚體的形式在發揮功能,Mg2+是其激活劑。
根據NCBI Blastp的比對結果,PaENO與冰葉日中花(Mesembryanthemumcrystallinum,McENO,AAA21277)、甜菜(Betavulgaris,BvENO,XP_010683886)、菠菜(Spinaciaoleracea,SoENO,XP_021857227)等植物的ENO蛋白氨基酸序列相似性較高,分別為93.47%、92.34%和92.12%,而與擬南芥(Arabidopsisthaliana,AtENO2,NP_181192)、煙草(Nicotianatabacum,NtENO,NP_001312148)、釀酒酵母(Saccharomycescerevisiae,ScENO,1ONE_A)等物種的ENO蛋白氨基酸序列相似性為88.06%、87.84%和59.56%。將這7條ENO蛋白進行氨基酸多序列比對分析,發現ENO蛋白含有4個保守金屬離子結合位點(39S、250D、300E、327D)以及3個保守基序(Motif 1、Motif 2、Motif 3)(圖2)。
系統進化分析也表明,PaENO與冰葉日中花、甜菜、菠菜等植物的ENO蛋白親緣關系較近,處于同一進化分支上,然后與大豆、擬南芥、海島棉、煙草等植物聚為一大類,屬于雙子葉植物,水稻、小麥、玉米等單子葉植物聚為一類,與苔蘚、藻類、酵母等物種的ENO蛋白親緣關系較遠(圖3)。

圖3 PaENO蛋白的系統進化分析
2.3 PaENO蛋白的原核表達和純化
使用pET-28a表達載體,選擇合適的酶切位點(EcoRⅠ和XhoⅠ),構建pET-28a-PaENO原核表達載體,經雙酶切驗證和DNA測序,確定PaENO基因序列沒有發生突變。將構建成功的原核表達載體pET-28a-PaENO轉化大腸桿菌BL21(DE3)感受態細胞,過夜培養后加入IPTG誘導目的蛋白的表達,用SDS-PAGE檢測PaENO蛋白的表達。結果如圖4所示,經IPTG誘導后,在50 kD左右出現目的條帶(圖4,A),然后用超聲破碎大腸桿菌細胞,離心后分別取上清和沉淀進行SDS-PAGE檢測,發現PaENO在上清和沉淀中都有表達,而且在上清中PaENO蛋白的表達量較高(圖4,A)。
使用Ni親和層析試劑盒純化PaENO蛋白,用含不同濃度咪唑的緩沖液梯度洗脫目的蛋白,然后進行SDS-PAGE檢測,結果表明低濃度咪唑(50、100、200 mmol/L)洗脫樣品中,PaENO蛋白含量較少,PaENO蛋白主要集中在高濃度咪唑(300、400、500 mmol/L)洗脫樣品中,其中以400 mmol/L咪唑洗脫效果最好(圖4,B)。收集高濃度咪唑(300、400、500 mmol/L)洗脫樣品,進行透析和超濾,最終獲得純化的PaENO蛋白(圖4,C)。
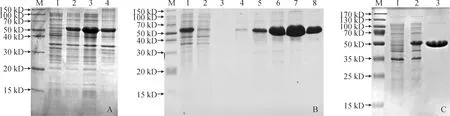
M. Marker;A.原核表達及可溶性分析:1. 未誘導的E. coli(含pET-28a-PaENO);2. IPTG誘導的E. coli(含pET-28a-PaENO);3. 上清;4. 沉淀。B. 咪唑梯度洗脫: 1. IPTG誘導的E. coli(含pET-28a-PaENO);2. 流穿峰;3-8. 50、100、200、300、400和500 mmol/L咪唑洗脫。C. SDS-PAGE純化分析:1. 未誘導的E. coli(含pET-28a-PaENO);2. IPTG誘導的E. coli(含pET-28a-PaENO);3純化的PaENO蛋白
2.4 PaENO基因表達分析
qRT-PCR結果顯示,PaENO基因在美洲商陸的根、莖、葉中都有表達,在葉中表達量最高,為根的2.5倍,其次是根,莖中表達量最低,僅為根中1/5。用400 μmol/L Cd處理后,在不同時間點(0、2、12和24 h)檢測PaENO基因在美洲商陸葉片中表達量的變化,結果(圖5)表明,Cd脅迫后2 h,PaENO基因表達量迅速升高,達到0 h的9.54倍,到12、24 h,PaENO的表達量降低,為0 h的3.12和2.89倍,說明Cd處理后PaENO基因的表達量迅速升高,參與美洲商陸應對Cd脅迫。
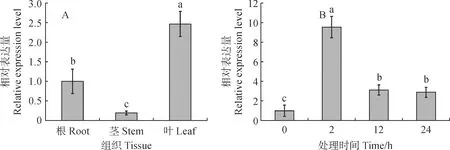
A.組織表達分析;B. Cd處理后葉中表達變化。不同小寫字母表示在不同組織(A)或Cd處理后不同時間點(B)PaENO基因表達差異顯著(P<0.05)
2.5 大腸桿菌抗Cd分析
為了進一步研究表達PaENO蛋白的大腸桿菌對鎘的抗性,將表達空載體(pET-28a)和PaENO(pET-28a-PaENO)的大腸桿菌分別均勻涂布在含1 mmol/L CdCl2的LB平板生長48 h,發現表達PaENO的大腸桿菌比轉空載體的大腸桿菌要明顯抗鎘(圖6,A)。通過細胞計數,表達PaENO蛋白的大腸桿菌在LB平板上有(2 163±45)個單菌落,而轉空載體的大腸桿菌只有(10±2)個單菌落。在含1 mmol/L CdCl2的LB液體培養基中的生長曲線也表明,表達PaENO蛋白的大腸桿菌比轉空載體的大腸桿菌要明顯抗鎘。表達空載體的大腸桿菌在LB液體培養基中(含1 mmol/L CdCl2)從3 h到22 h,其吸光度OD600一直維持在0.6左右,基本沒有生長,而表達PaENO的大腸桿菌在含1 mmol/L CdCl2的LB液體培養基中卻能夠一直生長,其OD600從0 h的0.1一直上升到22 h的1.7(圖6,B)。

A. LB固體平板; B. LB液體培養基
3 討 論
根據環境保護部和國土資源部聯合發布的《全國土壤污染狀況調查公報》,全國土壤鎘污染狀況不容樂觀,已成為一個嚴重的環境問題[15]。鎘水溶性高,且極易被植物吸收進入食物鏈,危害人類健康[16-17]。植物修復是利用超富集植物恢復重金屬污染土壤生產力的有效方法之一[18-19]。中國野生植物資源豐富,生長在天然污染環境中的超富集植物數量也很多,目前有正式報道的鎘超富集植物有天藍遏藍菜[20]、東南景天[21]、美洲商陸[9]、龍葵[22]、寶山堇菜、長柔毛委陵菜、伴礦景天和皖景天等,在修復鎘污染土壤方面各有特色。在重金屬污染區生長的美洲商陸能夠在葉片中積累高達402 mg/kg的鎘[23],且植物體內的鎘含量與土壤中鎘濃度呈正相關。與其他鎘超富集植物相比,美洲商陸不僅能夠積累大量的鎘,而且還具有生物量大(野外最高可達3 m)和生長時間短(3個月,一年可收兩季)等優點,這些顯著的優點使美洲商陸不僅是修復鎘污染土壤的潛力物種,而且是研究植物鎘超富集分子機制的有價值材料。
前期研究第一次發現糖酵解途徑的PaENO與美洲商陸鎘脅迫應答反應有關,鎘脅迫后美洲商陸PaENO的蛋白表達水平提高了3.14倍,western blot結果也表現出相同的趨勢,而糖酵解途徑的其他酶蛋白表達水平則顯著受到抑制[11]。后續研究美洲商陸應對鎘脅迫的轉錄組學變化,一共獲得了5 054個差異表達基因,表明細胞壁的固定化、螯合作用、液泡區隔化以及硫醇化合物含量的升高,可能是美洲商陸耐受鎘脅迫的重要機制,而且在鎘處理后,PaENO基因的表達水平顯著升高[12]。本研究克隆了美洲商陸的PaENO基因,進行了生物信息學分析并使用原核系統在大腸桿菌中表達和純化了PaENO蛋白,為后續研究PaENO酶促動力學參數以及通過氨基酸點突變研究PaENO關鍵催化位點奠定了基礎; qRT-PCR分析發現,鎘脅迫后2 h內PaENO基因的表達量迅速升高為0 h的9.54倍,隨著鎘處理時間的延長,其表達量降低,但仍高于0 h,這與轉錄組學變化趨勢一致;通過鎘抗性實驗,初步證實了表達PaENO蛋白能夠顯著提高大腸桿菌對鎘的抗性。
擬南芥AtENO2(LOS2)除了作為一種糖酵解的酶,在擬南芥應對冷脅迫中還能作為轉錄因子發揮功能。LOS2蛋白同時位于細胞核和細胞質中,能夠和擬南芥STZ/ZAT10基因的啟動子結合,LOS2基因突變破壞了冷響應相關基因的轉錄,導致擬南芥對冷脅迫的敏感性[6]。最近研究發現,擬南芥能夠從LOS2基因的第二個起始密碼子ATG(對應第93位甲硫氨酸)選擇性翻譯為轉錄因子AtMBP-1,AtMBP-1能夠抑制STZ/ZAT10基因的表達,參與ABA信號通路的響應[24]。這些結果表明AtMBP-1蛋白是LOS2蛋白的轉錄因子形式,作為一種負調控因子,參與擬南芥的生長發育以及應對逆境脅迫。
結合前期的研究基礎以及本研究結果,鎘處理后美洲商陸PaENO的蛋白和基因表達水平都顯著升高,以及表達PaENO蛋白能夠顯著提高大腸桿菌對鎘的抗性,說明PaENO這一在正常條件下負責糖代謝的酶,可能以轉錄因子(PaMBP-1)的形式在美洲商陸應對鎘脅迫過程中發揮調控作用,但這種功能具體是通過何種機制實現的,具體調控下游哪些信號通路的相關基因,還有待進一步研究闡明。

