梨葉片黃化復綠過程中bHLH轉錄因子的表達分析
張舒琴,張海燕,于 淼,胡小妹,邢楊天,劉 倫
(安徽農業大學 園藝學院,合肥 230036)
中國是世界上梨栽培面積最大的國家,2020年,中國梨栽培總面積達87.0萬公頃,總產量約1.61×107t,占世界總面積和總產量的67.3%和69.7%[1]。碭山境內黃河故道地區是中國梨主產區之一,其主栽品種‘碭山酥梨’具有適應性強、抗逆性強、產量高、耐粗放管理等優點,但近年來由于缺鐵所導致的葉片黃化已儼然成為了制約當地梨產業發展的生理性病害之一。
鐵是植物體內重要的微量元素,參與植物葉綠素的生物合成、氧化應激保護和各種代謝途徑[2]。雖然土壤中鐵含量高,但由于土壤pH的影響,其生物活性量很低[3],缺鐵易導致葉綠體結構受損,葉綠素合成受阻,葉綠素降解加劇,植株表現為幼葉黃化[4]。為應對缺鐵脅迫所帶來的影響,植物形成了以雙子葉植物和非禾本科植物為代表的鐵還原策略Ⅰ和以禾本科植物為代表的鐵螯合策略Ⅱ兩種鐵吸收機制[5],而梨的鐵吸收方式屬于鐵還原策略Ⅰ。其首先通過根系向根際分泌H+,從而酸化土壤,緊接著在鐵離子螯合還原酶FRO2(ferric-chelate reductase oxidase2)的作用下,Fe3+被還原成易被植物體吸收利用的Fe2+形式,繼而通過鐵轉運蛋白IRT1(iron regulated transporter1)轉運至細胞內[6],供植物體生理、生化過程所需。
鐵代謝基因的表達受以bHLH(basic-helix-loop-helix)轉錄因子為主的轉錄調控[7]。bHLH是廣泛分布于植物中的最大轉錄因子家族之一,由堿性氨基酸區(N-末端)和螺旋-環-螺旋區(C-末端)所組成[8],除參與調控逆境脅迫、花青素代謝和細胞生長外[9],bHLH在提升植物抗缺鐵脅迫能力也具有重要意義[7],涉及FIT(FER-like iron deficiency-induced transcription factor)、PYE(POPEYE)、BTS(BRUTUS)、URI(upstream regulator of IRT1)等途徑參與調控鐵的吸收代謝[10]。在擬南芥中,缺鐵脅迫可誘導bHLH Ⅲa類轉錄因子FIT的表達,并促使其結合于IRT1、FRO2啟動子而提升其抗缺鐵能力[11]。除此之外,FIT對下游基因的結合活性受其互作蛋白基因AtbHLH38/39/100/101(bHLH Ⅰb類)的影響,其功能缺失三突變體在缺鐵條件下的擬南芥葉片嚴重萎黃,且外源鐵處理無法促進其鐵的吸收,葉片持續黃化[12-13]。另一方面,bHLH Ⅳa類轉錄因子AtbHLH34/104/105/115也可于缺鐵條件下與bHLH Ⅰb類基因啟動子結合而促進其表達,從而以FIT依賴性途徑調控鐵的吸收[14-16]。與此同時,bHLH Ⅳb類轉錄因子AtbHLH121/URI也參與了擬南芥缺鐵脅迫響應,其可通過磷酸化作用與bHLH Ⅳc互作或直接作為bHLH Ⅰb類轉錄因子的上游而維持擬南芥鐵穩態平衡[17-18]。與之相反,AtbHLH47/PYE可通過與AtbHLH105互作以及其他作用方式而抑制其活性,抑制鐵的轉運和貯藏[19-20],而AtbHLH11也可通過招募Fe代謝共抑制子TPR/TPL而起到抑制bHLH Ⅳc類轉錄因子對bHLH Ⅳb類轉錄因子的調控效應[21]。BTS則可與AtbHLH105和bHLH115相互作用,并促進其降解,從而負調控植株鐵吸收[22]。除擬南芥bHLH轉錄因子之外,大豆[23]、番茄[24]、蘋果[25]和楊樹[26]等物種的bHLH也在不同程度上響應了缺鐵脅迫。因此,bHLH轉錄因子在缺鐵脅迫過程中發揮著極其重要的功能。
前期研究結果表明,缺鐵黃化復綠葉內Fe2+顯著降低,而施用濃度為0.2% FeSO4可誘導黃化葉的復綠,并造成其葉內Fe2+含量的顯著增加[27],說明該黃化葉復綠與其鐵代謝能力的增強相關。推測鐵代謝中心調控因子bHLH在此過程中起著重要作用。但目前為止,關于以PbrbHLH鐵代謝調控因子,在梨葉缺鐵黃化復綠中的研究尚未見報道。
為揭示PbrbHLH在梨葉缺鐵黃化復綠過程中的功能,本研究以‘碭山酥梨’正常植株與缺鐵黃化植株為試材,以外源0.2% FeSO4噴施黃化葉面,通過轉錄組測序和實時熒光定量PCR技術,篩選并分析了梨葉內和根中響應缺鐵黃化葉復綠的PbrbHLH基因及其相對表達量,探究了PbrbHLH在地上部葉內和地下部根系內的調控模式;通過與各時期葉內Fe2+含量[27]進行關聯分析,篩選調控梨缺鐵黃化復綠的關鍵PbrbHLH基因,旨在為研究‘碭山酥梨’缺鐵黃化調控機制提供候選基因,并為培育抗缺鐵梨品種提供理論基礎。
1 材料和方法
1.1 試驗材料及處理
試驗以安徽省碭山縣園藝場15年生‘碭山酥梨’缺鐵黃化植株與正常植株為試驗材料,在保證立地條件與栽培管理水平一致的情況下,于生長期對缺鐵黃化植株全樹葉面噴施0.2% FeSO4(2 g/L FeSO4)溶液,每株樹施用量為10 L,對照組為噴施清水的正常植株和黃化植株,每3株樹為1個處理,每個處理包含3個生物學重復,共計梨樹27棵。取清水處理的正常、黃化植株葉片及其地下部砧木(杜梨)的幼嫩根毛,并于FeSO4分別處理3、6、9和12 d收集黃化植株葉片,所有樣品經液氮固定后,于-80 ℃保存待用。
1.2 方 法
1.2.1bHLH基因的篩選各葉樣RNA-seq分析數據由華大基因交互式報告平臺提供(https://report.bgi.com/ps/login/login.html)。梨PbrbHLH全基因家族及相關命名均參考Dong等[28]的研究。以P-value (N/C)≤0.02為標準[29],初步篩選對照組正常植株葉片內差異表達的PbrbHLH,再根據FeSO4處理黃化植株3、6、9和12 d的基因整體表達趨勢,進一步篩選出候選PbrbHLH基因。基于NCBI梨基因組數據庫(https://www.ncbi.nlm.nih.gov/genome/12793),查詢并獲取‘碭山酥梨’的候選bHLH基因的全長序列;同時基于GDR(https://www.rosaceae.org/species/pyrus/all)在線網站,獲取杜梨基因組數據,以Bioedit(Version 7.0.9)進行Blast序列分析,獲取其內的與該候選基因同源的基因序列,并以DNAMAN(version 9.0)進行序列的兩兩比對,以此初步驗證Blast比對結果,其基因命名據其相應‘碭山酥梨’基因ID而定。
1.2.2 候選bHLH基因的生物信息學分析使用ExPaSy(http://www.expasy.org/ tools/)在線網站具對篩選得到的梨候選PbrbHLH基因編碼蛋白序列的氨基酸數、分子量、等電位點、脂肪族氨基酸數和蛋白質疏水性等理化性質進行分析。使用在線工具MEME(http://meme-suite.org/)對梨候選PbrbHLH基因進行motif基序分析,獲取文件,并以TBtools的Gene Struture View(Advanced)功能進行可視化分析。于擬南芥數據庫TAIR(https://www.arabidopsis.org/)獲取該候選基因的同源序列,對篩選得到的兩物種bHLH基因所編碼的蛋白序列采用ClustalW 2.0進行多重比對,以MEGA 7.0軟件進行系統進化樹的構建(鄰接法)與可視化,其中自展值的初始值設置為1 000次,最后以PowerPoint 2016進行系統進化樹的美化。
1.2.3 RNA提取與實時熒光定量PCR按照天根植物多糖多酚RNA提取試劑盒操作方法提取‘碭山酥梨’葉片總RNA。采用PC54-TRUEscript RT kit(+gDNA Eraser)反轉錄試劑盒(試劑盒均購自北京艾德萊生物科技有限公司)合成cDNA。使用Premier 5.0軟件對篩選出的梨候選bHLH基因設計實時熒光定量PCR(quantitative real-time PCR, qRT-PCR)引物(表1)。試驗于BIO-RAD T100 PCR擴增儀進行,反應總體系為:10 μL SYBR Green Master Mix,2 μL模板cDNA,上游引物和下游引物各加0.8 μL,6.4 μL DEPC,設置反應程序為:95 ℃預變性90 s,95 ℃變性30 s,60 ℃退火5 s,72 ℃延伸30 s,72 ℃再延伸10 min,共40個循環,每個樣本含3次生物學重復。以梨GAPDH基因為內參,使用2-ΔΔCT法求得待測樣品的相對表達量[30]。

表1 實時熒光定量PCR引物序列
1.3 數據分析
數據處理運用Excel以單因素方差分析(ANOVA)法,并以Duncan多重極差法進行各處理的平均值檢驗,并運用SPSS 23軟件(SPSS Inc, Chicago, IL, USA)在0.05的水平(LSD),分析各處理間顯著差異性。關聯性分析運用雙變量分析的方法,于0.05水平對均值和標準差進行雙側檢驗。
④待連接端面用專用電熱板加熱,加熱板溫度設定為210±10℃,待連接件的端面加熱時間為5 min,加熱壓力為1.73MPa。
2 結果與分析
2.1 梨候選PbrbHLH基因的生物信息學分析
2.1.1 梨候選PbrbHLH基因的鑒定與其蛋白理化性質分析以P-value(N/C)≤0.02為標準,于正常植株葉片和黃化植株葉內共鑒定到64個差異表達PbrbHLH基因,進一步分析FeSO4處理后3、6、9和12 d葉內該基因的表達量,最終篩選得到21個呈現一定表達規律的PbrbHLH基因(圖1)。

N. 正常植株;C. 清水處理;下同
該21個候選基因所編碼的蛋白分子長度不等(表2),其氨基酸數在147(PbrbHLH155)~714(PbrbHLH78)之間,相對分子質量差異較大,介于16 676.43(PbrbHLH155)~79 095.60(PbrbHLH78)Da之間,理論等電點范圍位于4.97(PbrbHLH7)~9.43(PbrbHLH119)內。該21個PbrbHLH蛋白中13個蛋白成員呈酸性,其內酸性氨基酸所占比重較大。而蛋白質疏水性的分析結果表明,所有蛋白的疏水性平均值均為負值,表明其均為親水性蛋白。

表2 梨PbrbHLH轉錄因子的理化性質
2.1.2 梨候選PbrbHLH基因motif與系統進化分析以MEME在線軟件對鑒定、篩選得到的21個PbrbHLH基因進行基序(motif)預測,發現其內存在多種motif結構,其中motif 1、motif 2(除PbrbHLH183外)廣泛分布于各個基因,表明其可能是梨PbrbHLH基因的保守基序。多數PbrbHLH基因內含2~3個motif,而PbrbHLH104、PbrbHLH122兩基因內motif數最為豐富,高達8個。除此之外,相鄰分支上的PbrbHLH轉錄因子基序組成大致相同(圖2)。
對以Bioedit分析所獲得的擬南芥基因組內PbrbHLH同源序列進行分析發現(圖3),21個梨PbrbHLH基因共對應了20個擬南芥AtbHLH基因,其中PbrbHLH104和PbrbHLH122的擬南芥同源序列均為AtbHLH137。參考Heim等[31]對擬南芥AtbHLH的分類研究,發現該同源AtbHLHs基因涉及Ⅲ、Ⅳa、Ⅴ、Ⅶ、Ⅺ、Ⅻ這6大亞族。而就梨PbrbHLH基因而言,其主要分布位于Ⅲ亞族和Ⅻ亞族,分別擁有8個和5個PbrbHLHs,其次為Ⅳa和Ⅶ亞族,均含3個PbrbHLHs,而Ⅺ亞族內,有且僅有PbrbHLH15。而擬南芥Ⅲ、Ⅳa亞族AtbHLH參與了缺鐵脅迫在內的植物逆境脅迫的響應[32],說明該亞族內的PbrbHLHs在調控鐵代謝方面可能具有重要功能,如PbrbHLH41、PbrbHLH78、PbrbHLH119等。目前關于其他4個亞族bHLH與逆境脅迫(缺鐵等)的相關研究較少,但其在正常葉、黃化葉以及FeSO4所調控的缺鐵黃化葉復綠過程中的表達差異特性,也說明了其在鐵代謝和葉綠素代謝方面可能具有一定的調控作用,且相關基因的具體功能有待進一步研究。
2.2 梨候選PbrbHLH基因在梨葉缺鐵黃化復綠中的表達分析
為探究bHLH轉錄因子在梨葉黃化復綠中的表達模式,采用qRT-PCR分析了該21個梨候選PbrbHLH基因在清水處理正常葉片(N)和黃化葉片(C),以及外源FeSO4處理后3、6、9和12 d時的表達。如圖4所示,C葉內PbrbHLH7/29/41/104/119/122/128/135/155/183/191這11個基因表達量均顯著高于N葉,其中PbrbHLH41/104/122/155/183/191這6個基因均在FeSO4溶液處理后3~9 d內較C葉顯著下調,且除PbrbHLH41/183/191在處理后12 d的表達量與C葉無顯著差異外,其他3個基因的該時期表達量仍顯著低于C葉;與前者變化規律不同,PbrbHLH7/29/119/128這4個基因的表達量在處理后3和12 d與C葉均無顯著差異,但其在處理后6和9 d的表達量也較C葉顯著下降。而PbrbHLH135在FeSO4處理后的表達規律基本與PbrbHLH7/29/119/128這4個基因的表達規律相反。

不同小寫字母表示同一基因不同處理間在P<0.05水平上的差異顯著性,下同
C葉內PbrbHLH15/42/46/53/69/78/89/115/137/144這10個基因表達量則均顯著低于N葉,FeSO4溶液處理后3 d,PbrbHLH15/78/89/144表達量均較C葉顯著上調,而其他基因的該時期表達量與C葉無顯著差異;在處理后6 d,除PbrbHLH42外,其他9個基因的表達量均較C葉顯著增加,且達到峰值,并基本于該時期后,其表達量逐步降低,直至達到與C葉無顯著差異或顯著低于C葉的水平。
同時,為探究同一bHLH轉錄因子在梨地上部與地下部表達的協同/拮抗性,試驗分析了杜梨(‘碭山酥梨’砧木)根系內相關基因的表達特性。如圖5所示,黃化梨樹的砧木根內PbbHLH29/41/53/89/119/128/135/155/183/191這10個基因相對表達量顯著高于正常梨樹砧木根系,與葉內相關基因的表達趨勢一樣;而黃化梨樹的砧木根內PbbHLH53/89基因表達量則較正常梨樹砧木根系顯著降低,該基因變化趨勢也與其在梨葉內的表達模式相一致。與上述結果不同,黃化梨樹和正常梨樹的砧木根中PbbHLH7/46/78/115/137/144基因表達量并無顯著差異。由此說明缺鐵脅迫條件下的葉內和根中bHLH的響應可能存在一定差異,但多數梨bHLH基因在葉片和根系的表達調控中具有協同性。

圖5 正常與黃化梨樹根中PbrbHLH基因相對表達量
為進一步探討PbrbHLHs與葉片復綠的關系,試驗分析了正常葉、黃化葉以及FeSO4處理后各時期相關基因表達量與各葉樣內Fe2+含量[27]的相關性。結果表明,在所篩選的21個梨PbrbHLHs基因中,有且僅有PbrbHLH41和PbrbHLH78與各葉樣內Fe2+含量顯著相關,其中PbrbHLH78與各葉樣內Fe2+含量呈顯著正相關,PbrbHLH41與各葉樣內Fe2+含量呈顯著負相關(圖6)。因此,相較于其他19個PbrbHLHs基因而言,PbrbHLH41和PbrbHLH78在調控缺鐵黃化葉復綠過程中的作用可能更強。值得注意是,PbrbHLH41和PbrbHLH78同屬Ⅲ 亞族,但其調控模式卻截然相反,再次說明了同一系統分支內PbrbHLHs基因的功能多樣性,也表明PbrbHLHs可能以協同或拮抗的作用方式而參與調控同一生理作用。
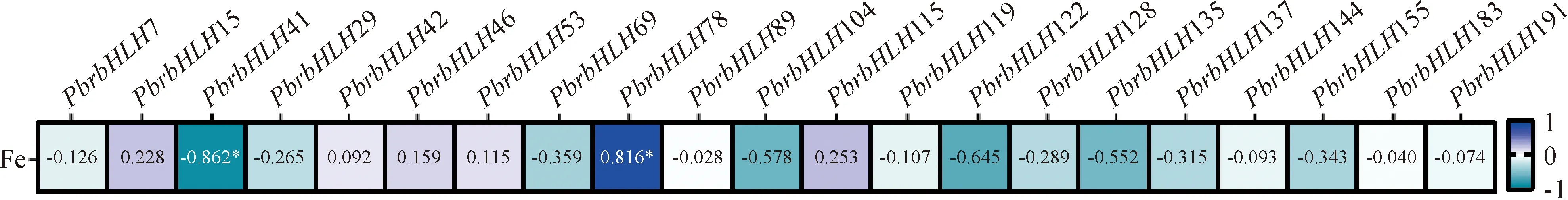
*表示顯著相關
3 討 論
植物體內鐵含量雖然很低,但其對于維持葉綠體結構、促進葉綠素合成,維持植株生長發育具有重要意義[2]。研究表明,較強的鐵吸收能力可保證番茄在缺鐵脅迫條件下的鐵吸收和葉綠素的合成,從而避免其葉片黃化[33],且可保證堿性土壤條件下小麥的葉綠素生物合成、光合作用和正常生長[34]。因此,鐵吸收能力的增強可穩定或增強葉綠素合成而避免或改善葉片失綠。所以外源FeSO4所調控的的缺鐵黃化葉復綠現象及其葉內Fe2+含量的增加均反映出了其鐵吸收能力的增強。
梨樹鐵吸收依賴于HA、IRT1、FRO2等基因的表達[5],而其和相關調控網絡均受bHLH類轉錄因子的轉錄調控[9]。近年來,隨著基因組學研究的開展,更多植物內bHLHs基因被鑒定且被證實參與其缺鐵脅迫應答[23-26]。雖然白梨基因組的測序早已完成[35],但直至近年,才見其PbrbHLH全轉錄因子家族的報道[28],并揭示了其與梨幼苗抗冷、抗旱、葉綠素降解及ROS積累相關,表明PbrbHLHs響應梨非生物脅迫。本試驗中,共64個PbrbHLHs于清水處理正常葉和黃化葉顯著差異表達,且21個PbrbHLHs與FeSO4所調控的黃化葉復綠相關,說明該基因可能與擬南芥[36]、蘋果[25]、柚子[37]內部分bHLHs一樣,參與調控鐵的吸收、轉運。除此之外,多數PbrbHLHs基因在根中的表達模式與葉內表達模式相一致,說明其在地上部和地下部的協同調控性。
另一方面,不同處理葉樣中Fe2+含量[27]與該葉樣內PbrbHLHs表達量的相關性分析結果表明,PbrbHLH41和PbrbHLH78可能在調控‘碭山酥梨’缺鐵黃化葉內Fe2+積累及其復綠過程中發揮重要作用。外源FeSO4處理上調了葉內以PbrbHLH78為代表的鐵代謝正調控因子的表達,從而可能以促進根系鐵的吸收、轉運以及優化葉內Fe的分配和還原等方式,促進葉內Fe2+的積累;而同時該處理也降低了葉內以PbrbHLH41為代表的鐵代謝負調控因子的表達,繼而可能以解除其對于鐵代謝相關過程抑制作用的方式,參與調控葉內Fe2+的積累,促進葉片復綠。
而系統進化樹分析結果表明,PbrbHLH41和PbrbHLH78與擬南芥AtbHLH1和AtbHLH42均處于第Ⅲ亞族,其表達模式卻截然相反。迄今,關于AtbHLH1和AtbHLH42研究甚少,但不乏關于該亞族基因功能的研究。例如,AtbHLH6可激活ABA信號[38],而ABA可促進葉綠素降解而使葉片黃化[39],推測AtbHLH6可能間接引起葉片黃化;而AtbHLH29則可維持缺鐵條件下的葉綠素穩定,改善葉片黃化[40]。因此,同一亞族內的基因可能存在拮抗性調控,與本文處于同一亞支的PbrbHLH41和PbrbHLH78相似。
綜上所述,本研究以轉錄組測序結合qRT-PCR,分析了PbrbHLHs基因在梨缺鐵黃化葉復綠過程中的表達,說明了PbrbHLHs可能參與梨樹缺鐵黃化葉復綠,且通過不同葉樣內Fe2+含量和相關基因表達量的相關性分析,發現PbrbHLH41、PbrbHLH78在梨缺鐵黃化葉復綠過程中起重要作用,且兩者作用模式可能相反。但是,還需要進一步的研究來解析PbrbHLHs在葉片缺鐵脅迫應答和黃化葉復綠過程中的作用和途徑,并且對該脅迫條件下關鍵PbrbHLHs轉錄因子的特征分析,對于揭示PbrbHLHs在梨葉中的功能機制也至關重要。

