腫瘤新抗原免疫治療的研究進展*
王倩倩,畢紋玫,魏陽,馮燮林,蔣文軍,吳少波
611731 成都, 電子科技大學 醫學院 (王倩倩);213300 江蘇 常州,溧陽市中醫醫院 檢驗科 (畢紋玫); 610041成都, 四川省腫瘤醫院·研究所,四川省癌癥防治中心,電子科技大學醫學院 胸部腫瘤內科 (魏陽), 肝膽胰外科(馮燮林), 研究所 (蔣文軍);610052成都,中國醫學科學院 輸血研究所 (吳少波)
惡性腫瘤嚴重地威脅人類的健康, 目前腫瘤治療手段仍主要是外科手術、放療及化療。對于早期甚至一些進展期癌癥患者,根治性外科手術治療仍是首選的方案,手術后再根據病理結果和實際的臨床分期,給予適當的術后輔助治療,如靜脈化療、局部放射治療、基因靶向治療等,盡可能防止腫瘤復發和轉移。而對于中晚期尚未遠端轉移的腫瘤患者,大多采用綜合性的治療,如使用介入等手術方法、化療或者放療等聯合療法。這些治療方法都具有其局限性,常引起患者不同程度的不良反應,或出現藥物副作用,及抗藥和耐藥性,整體療效欠佳,患者長期生存率低。近幾年來,腫瘤新抗原已越來越來多進入臨床試驗,成為腫瘤免疫治療的新領域,期待不久能應用于晚期癌癥患者的有效治療。腫瘤抗原是指與細胞惡性轉化和腫瘤發生發展過程中相關的新產生或過度表達的蛋白和多肽分子,可分為腫瘤相關抗原(tumor associated antigens,TAA)和腫瘤特異性抗原(tumor specific antigen,TSA)。TAA常常是腫瘤細胞過量表達的癌基因編碼蛋白、胚胎性蛋白或過量表達的糖蛋白等,但并非腫瘤細胞所特有,在正常細胞中也有低水平的表達。TAA在免疫治療中易發生機體的免疫耐受以及自身免疫損傷,且由于其免疫原性弱,很難誘導持久的特異性免疫應答,從而極大限制了它們的臨床應用,甚至可能導致免疫激活相關的嚴重自身免疫性疾病[1]。TSA又稱為腫瘤新抗原,是腫瘤細胞在化學、物理及生物(如病毒)等致癌因素誘發或自發突變而形成的新型多肽,這些新抗原由于其高度特異性、顯著外源性等特點而成為一種理想的免疫治療靶點[2-3]。
自1988年De Plaen等[4]通過cDNA文庫篩選鑒定了第一個T細胞識別的新抗原以來,一系列與人類腫瘤相關的自體突變新抗原的研究日益引起了人們的重視, 研究表明新抗原在特異性T細胞介導的抗腫瘤免疫中發揮了關鍵作用[5-7]。圖1展示了腫瘤新抗原研究的發展概況。本文就腫瘤新抗原的篩選、基于新抗原免疫治療的臨床應用以及遇到的相關問題進行綜述。
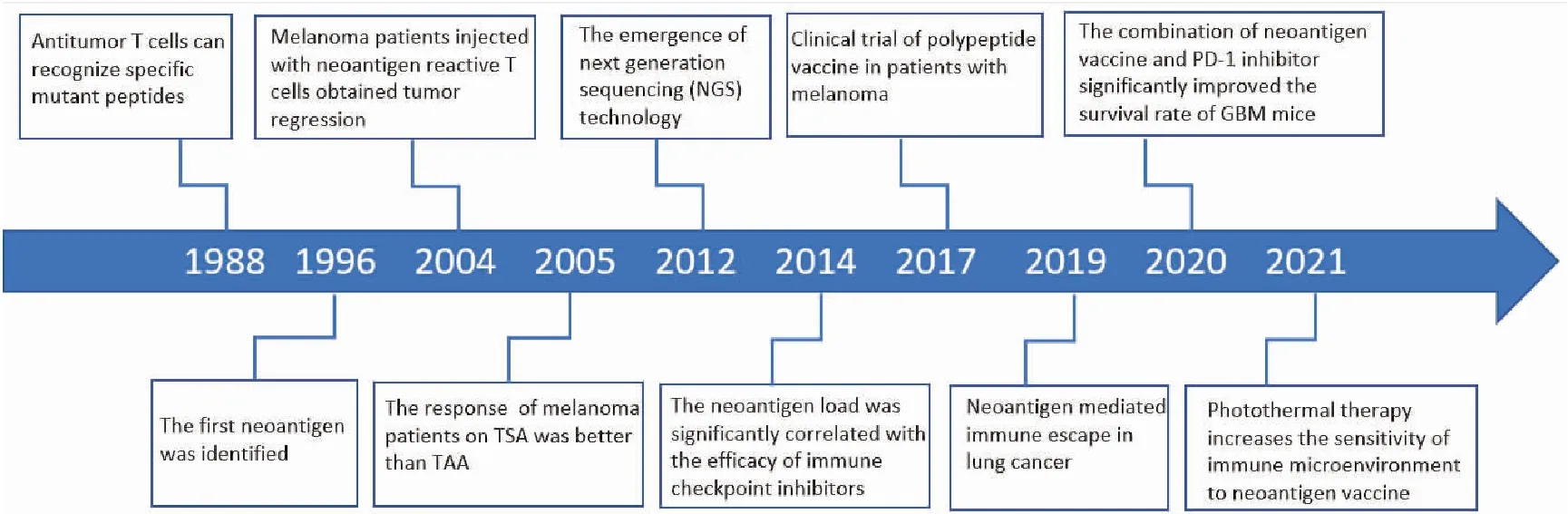
圖1 腫瘤新抗原的研究歷程
1 腫瘤新抗原的篩選
腫瘤新抗原具有腫瘤細胞的特異性,腫瘤細胞的基因組突變在不同個體間、不同腫瘤組織類型甚至同一腫瘤組織的不同細胞克隆之間都存在異質性,并且隨腫瘤發展的不同階段而發生變化[8-9]。利用現代基因深度測序方法,可以鑒別出腫瘤的大量體細胞突變,結合現代蛋白質組學和生物信息學技術,從中篩選出可能被T細胞識別并具有較強免疫原性的腫瘤新抗原多肽基因序列[10]。目前腫瘤新抗原篩選大致分為3種主要方法(圖2):1)應用新一代測序技術(next generation sequencing,NGS)對腫瘤細胞或正常細胞測序(如外周血細胞),確定腫瘤組織基因突變位點,通過RNA測序(RNA-seq)找出腫瘤特異性突變位點的多肽基因序列并評估突變位點等位基因的表達,通過主要組織相容性復合體(major histocompatibility complex,MHC)-肽計算機軟件預測MHC遞呈的多肽,通過全外顯子基因組測序確定腫瘤組織基因突變位點,人工合成新抗原多肽,并進行體外T細胞識別驗證;2)基于高通量基因測序等技術,鑒定腫瘤細胞特異性突變位點,并篩選潛在與人白細胞抗原(human leukocyte antigen,HLA)親和力較高的新抗原多肽分子構建串聯小基因,在體外轉錄形成可表達多個多肽分子的RNA,再將RNA轉染到抗原呈遞細胞中,與腫瘤浸潤淋巴細胞(tumor infiltrating lymphocytes,TILs)共培養,鑒定新抗原的免疫反應性;3)于數據庫或文獻中鑒定腫瘤細胞特異性突變位點,進而體外檢測免疫反應活性。
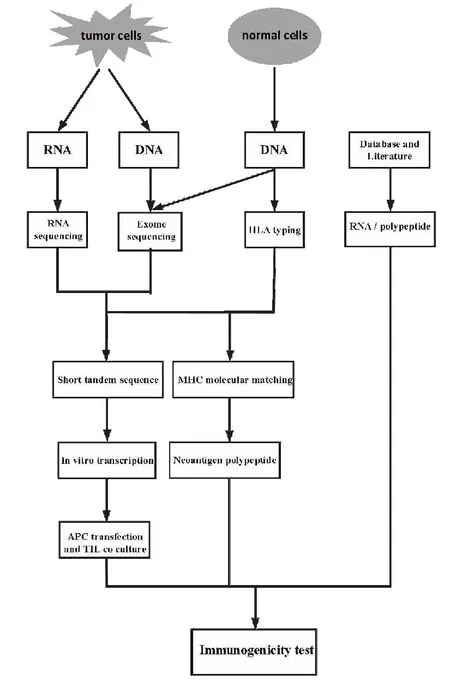
圖2 新抗原的篩選方式
2 基于腫瘤新抗原的臨床試驗進展
2.1 基于新抗原的治療性疫苗
腫瘤突變的多樣性及異質性,使得個體化治療性腫瘤疫苗成為有價值的研究方向[11]。研究者可通過皮下注射或者體外電脈沖甚至納米材料輔助的方式將疫苗遞送至患者體內[12],機體免疫系統識別疫苗所引入的特異性新抗原,引起效應細胞激活和釋放一系列效應分子,達到攻擊和清除腫瘤細胞或抑制腫瘤生長的目的[13-14]。其中,樹突狀細胞疫苗、病毒載體疫苗、多肽疫苗、DNA及RNA疫苗(核酸疫苗)在多種腫瘤的研究中顯示,新抗原特異性T細胞浸潤和抗腫瘤免疫反應可被有效激活[15-16]。Ott等[17]進行了一項針對20種預測的腫瘤新抗原設計的長肽疫苗的試驗,結果表明在6名接種疫苗的黑色素瘤患者中,4名患者接種25個月后沒有復發,而2名復發患者在進行了抗程序性死亡受體(programmed cell death protein,PD-1)治療后,腫瘤完全消退。近期Hu等[18]的相關研究證明黑色素瘤患者的個體化新抗原疫苗接種可誘導具有細胞毒性基因特征的持久性和特異性記憶T細胞克隆,并且出現了多個不同功能T細胞受體(T cell receptor,TCR)克隆型,擴大了腫瘤特異性細胞毒性的范圍。Ding等[19]以12例重度轉移性肺癌患者為試驗對象, 應用特異性樹突狀細胞疫苗,客觀有效率與疾病控制率得到有效提高。Cafri等[20]應用mRNA 疫苗接種了轉移性胃腸道癌癥患者,成功誘導了突變特異性T細胞應答,并證明了該疫苗在胃腸道腫瘤患者中應用的安全可行性。新抗原疫苗的出現為腫瘤的免疫靶向治療帶來了里程碑的突破,在系列實體腫瘤臨床試驗中取得一定效果,并表現出良好的應用前景,而其高度特異性的特點也伴隨著生產周期較長以及生產成本較高的代價,探尋通用型疫苗或許是未來值得研究探索的方向。
2.2 基于新抗原的過繼性免疫治療
過繼性細胞療法(adoptive cell therapy,ACT)是指給腫瘤患者輸注具有抗腫瘤活性的免疫效應細胞,使其在腫瘤患者體內發揮抗腫瘤作用。不同于傳統的過繼細胞療法,基于新抗原的ACT在增加效應T細胞數量的基礎上,更加強調靶向實體腫瘤的特異性殺傷能力。ACT大致可分為兩種治療策略:一是從現有腫瘤團塊中分離自然發生的腫瘤特異性T細胞,經過體外擴增后回輸至患者體內;第二是從患者外周血中分離出T細胞,并進行基因修飾,使其表達TCR或嵌合抗原受體等可特異性識別腫瘤細胞的受體后回輸。早期已有研究證明,TILs與卵巢癌[21]、乳腺癌[22]、原發性皮膚黑色素瘤[23]、結直腸癌[24]的臨床預后密切相關。Zacharakis等[25]學者報告了1例針對4種突變蛋白(slc3a2、KIAA0368、CADPS2、CTSB)的轉移性乳腺癌患者的特異性TILs的過繼轉移聯合療法使腫瘤持久完全消退。ACT依賴于足夠數量的抗腫瘤T細胞介導腫瘤的消滅和根除。而對于TILs水平較低的頭頸部鱗狀細胞癌,可能不具備足夠數量的浸潤淋巴細胞進行過繼轉移。Wei等[26]用體外擴增TILs和HLA匹配的異體C1R細胞作為抗原提呈細胞來篩選新抗原特異性TCR, 并通過體內實驗驗證了其抗腫瘤效能。雖然過繼性免疫治療表現出了良好的治療前景,隨著研究深入, 一些阻礙因素也逐漸顯露,例如靶標毒性(過繼T細胞對表達相同靶向抗原的正常組織造成損傷)、脫靶毒性(過繼T細胞誤傷了表達與靶點抗原相似表位的正常組織)以及免疫微環境對T細胞的抑制作用[27-28],因此篩選合適的靶向抗原、優化過繼性T細胞的制備工藝、改善免疫微環境以提高T細胞活性等方向仍需要更多的探索。
2.3 新抗原負荷預測免疫檢查點抑制劑療效
針對PD-1和細胞毒性T淋巴細胞抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)的免疫檢查點抑制劑的臨床試驗中取得了令人欣喜的結果,然而仍有部分患者在病情得到控制后有復發跡象,并可能出現致命的耐藥性[29]。大量的文獻報道證明腫瘤突變負荷(tumor mutation burden,TMB)與新抗原負荷呈正相關[30]。有研究表明,抗PD-1/PD-L1 或CTLA-4去除免疫抑制,在高突變負荷患者體內可激發機體特異性免疫應答從而顯著提高殺傷腫瘤細胞能力。Rizvi等[31]對PD-1抗體pembrolizumab治療的非小細胞肺癌患者的進行全外顯子組測序,發現擁有較高的非同義突變負荷的患者得到了更持久的臨床獲益(局部或穩定反應時間大于 6 個月)。Snyder等[32]對接受CTLA-4抑制劑Ipilimumab和tremelimumab治療的黑色素瘤患者腫瘤組織及匹配的血液樣本進行了全外顯子測序,結果證明突變負荷與黑色素瘤患者的臨床獲益程度呈現正相關。 McGranahan等[33]也證明了晚期非小細胞肺癌和黑色素瘤患者對PD-1和CTLA-4阻斷劑的敏感性在克隆新抗原富集的腫瘤中增強。反之,低TMB的癌癥,如前列腺癌等,免疫檢查點抑制劑效果就收效甚微。免疫抑制劑療效的預測標志物對于提高免疫抑制有效性至關重要,特別是對于臨床應用最為廣泛的PD-1/PD-L1抑制劑或CTLA-4 抑制劑,從近年來的研究結果來看,接受免疫抑制療法患者的TMB與其臨床獲益呈顯著相關性[34-35]。因此,TMB與新抗原負荷有望成為判斷免疫檢查點抑制劑療效和患者預后的理想生物學標志物。
2.4 基于新抗原免疫療法的聯合治療
目前關于聯合治療大致可分為與其他免疫療法的聯合以及與其他常規療法的聯合。由于PD-1/PD-L1途徑對CD8+T細胞介導的抗腫瘤免疫反應具有免疫抑制作用,一些基于新抗原的疫苗或ACT療法聯合檢查點抑制劑的臨床前研究和早期臨床試驗已經產生了強大的T細胞應答和抗腫瘤作用。Liu等[36]在抗PD-L1耐藥小鼠的膠質母細胞瘤中鑒定了內源性新抗原特異性CD8+T細胞,通過新抗原疫苗與PD-L1抑制劑聯合應用可顯著提高其生存率。Ni等[37]發現一種雙佐劑新抗原納米疫苗(banNV)可使T細胞上的免疫檢查點PD-1致敏,在構建的新抗原特異性大腸癌小鼠模型中,aPD-1+banNVs治療的小鼠第48天的存活率提高到70%,而單獨使用banNVs的存活率僅為40%。此外,化療對免疫系統的調節作用已經改變了我們對化療單純的殺瘤作用的認識,一些化療藥物已經被證明可以誘導亞克隆新抗原,有助于增加突變負荷,并可能與改善抗原呈遞或T細胞應答反應有關[38-39]。最新研究表明,以棘狀金納米顆粒為基礎的光熱療法通過熱誘導細胞和分子損傷破壞腫瘤微環境增加新抗原疫苗的敏感性,而新抗原疫苗可克服光熱療法誘導的局部免疫抑制,兩者相輔相成,有效地根治大的原發腫瘤,并對轉移性腫瘤形成遠距作用[40]。此研究為中晚期腫瘤的治療帶來了新的希望。
3 腫瘤新抗原的免疫逃逸問題
基于新抗原的免疫治療取得了一定的臨床療效,并且有望成為腫瘤免疫治療的優質靶標,但是作為一種新興的治療方式,尚未形成成熟的設計及應用體系,在發展過程中仍面臨著許多亟待解決的問題與挑戰,包括:腫瘤異質性對個體化新抗原疫苗的限制;免疫抑制環境的形成對于為腫瘤免疫逃逸創造機會;個體化新抗原疫苗與過繼免疫T細胞的制備成本高昂且周期較長;缺乏特異性免疫學指標評價新抗原免疫療法的免疫應答反應。
其中,腫瘤微環境在腫瘤免疫治療的應答率和臨床結果方面起關鍵作用。研究表明,具有高TMB和豐富免疫細胞浸潤的實體瘤更易在治療過程中被消滅。但在免疫監視的生存壓力下,腫瘤細胞不斷進化并且改變著其分子表達,以逃避免疫監視甚至產生免疫抑制。腫瘤免疫編輯過程中,免疫系統與腫瘤的關系可分為3個階段,即清除、相持和逃逸階段。免疫系統在腫瘤發生中往往扮演了雙重作用,免疫系統在抑制腫瘤生長的同時又對腫瘤具有免疫選擇壓力下的重塑作用,其中弱免疫原性的腫瘤可能逃脫免疫系統的監視,從而發生逃逸[41-42]。腫瘤細胞在免疫編輯過程中進化出幾種機制來逃脫免疫反應[43-44]:1)腫瘤細胞通過改變自身抗原如抗原丟失或下調MHC的表達從而躲避免疫系統的監視;2)腫瘤細胞通過改變微環境如改變信號通路來促進炎癥因子的分泌或新生異常血管,一方面維持腫瘤的生長與侵襲,另一方面導致氧、氮自由基的積累可抑制免疫細胞的功能;3)腫瘤細胞通過分泌外泌體、表達抑制性配體介導免疫逃逸。新抗原具有較強的免疫原性,在免疫編輯過程中將極大可能的激發免疫系統的殺傷能力從而被消除,但研究發現腫瘤新抗原仍可能逃避免疫系統的監視。Rosenthal等[45]對非小細胞肺癌的研究中發現免疫編輯的強弱與免疫浸潤強度密切相關。免疫浸潤的腫瘤區域免疫編輯結果可導致HLA雜合性喪失或表達的新抗原減少,另一方面,新抗原突變基因的啟動子超甲基化降低了新抗原的表達。總之,新抗原逃避免疫逃逸機制的空白區域具有開發拓展的重要價值。
4 總結與展望
雖然新抗原疫苗在腫瘤治療領域具有廣闊前景,但面臨如下幾點主要挑戰:1)腫瘤的高度異質性,即表現在空間(細胞間、組織間及器官間)及時間上(同一腫瘤病灶在不同的臨床分期)而呈現不同表型特性、高度的遺傳異質性和基因突變的多樣性。因而所篩選的腫瘤新抗原,難以覆蓋所有腫瘤細胞表型和潛在靶點。此外腫瘤患者HLA的異質性,新抗原的提呈和識別存在多態性和顯著的個體差異性。這樣高度個性化的治療,限制了新抗原疫苗的廣泛應用;2)腫瘤與周圍微環境形成相對穩定的小生態系統,具有高度異質化、抑制免疫系統作用、易形成免疫逃逸及保持相對的獨立性,是新抗原疫苗治療實體瘤面臨的重要屏障;3)對新抗原的預測缺乏準確性、完整性及有效性。對插入和缺失的突變檢測能力十分有限。加上HLA的異質性,增添了預測和篩造表位的難度;4)生產周期長而成本高:新抗原疫苗的生產一般需3~5個月,周期過長以致晚期患者等待的時間難以接受,并且價格高昂,一般患者也難以負擔;5)缺乏新抗原免疫治療的療效評價系統:新抗原疫苗屬于主動性的治療性方法,暫缺直接的標志物。
腫瘤新抗原免疫治療充滿挑戰,也孕育更多的發展機遇。首先,我們猜想是否在腫瘤患者中可能存在通用型抗原從而使疫苗為廣大患者服務呢?雖然不同患者間存在通用型的新抗原的概率較低,因很少能從驅動基因發掘新抗原,人們在嘗試從非驅動基因突變中發現具有讓多數患者獲益的新抗原。其次是搞高預測準確性和優化疫苗設計,采用更標準化及統一化的算法系統,增加基因融合、缺失和插入等基因突變因素,并增大MHC II類型識別表位的新抗原的篩選;增強多表位疫苗的設計,減少免疫逃逸的情形,并改良和開發新型佐劑,提高免疫原性。最后,增加聯合治療的方案,如腫瘤抗原疫苗,能誘導抗腫瘤特異性T細胞的形成,結合免疫抑制劑療法,起協同抗腫瘤的效應;而結合化療,可降低化療劑量和不良反應的發生率;與靶向藥聯合使用,可減輕腫瘤負荷,而獲更佳療效。
隨著NGS、蛋白組學及生物信息學的飛速發展、腫瘤與免疫相互作用的研究愈發深入,新抗原免疫治療設計、研發與應用勢必快速發展,相信不久的將來,更完善的新抗原精準免疫療法將為腫瘤治療帶來一次新革命。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

