免疫熒光技術在魚類生殖細胞發育研究中的應用
楊聰慧, 楊福忠, 朱 辣, 羅心玥, 趙如榕, 張 純*
(1. 省部共建淡水魚類發育生物學國家重點實驗室, 湖南師范大學生命科學學院, 長沙 410081; 2. 湖南湘云生物科技有限公司, 常德 415101)
生殖細胞發育相關的功能分子標記在研究試驗對象的生殖和育性機理中發揮著重要作用, 已被廣泛應用于人類及其他模式生物的生殖細胞發育研究中[1-2], 但在魚類中應用較少。本研究使用的功能分子標記為RNA Pol II CTD(S5)蛋白, 即RNA聚合酶II中最大亞基RPB1的羧基末端結構域(carboxy terminal domain of RNA polymerase II, RNA Pol II CTD)的第5位絲氨酸磷酸化(phosphorylation of serine-5, S5)蛋白。RNA Pol II CTD是RNA聚合酶II具有活性的必需結構和進行轉錄調控活動的主要參與元件, 其作為主要的轉錄調控因子, 負責協調酶復合物的協同轉錄、調控染色質狀態以及新生RNA的加工[3-4]。RNA Pol II CTD是一條高度保守的重復序列, 由7個氨基酸殘基(酪氨酸1-絲氨酸2-脯氨酸3-蘇氨酸4-絲氨酸5-脯氨酸6-絲氨酸7)作為重復單位元件, 重復次數為26~52次。該結構的七肽會發生磷酸化和去磷酸化的循環反應, 從而影響RNA聚合酶Ⅱ對mRNA的5'帽子和3'末端的加工及基因外顯子的識別剪切過程[5]。其中, RNA Pol II CTD(S5)的磷酸化修飾主要發生在轉錄起始階段[6], 這使其可作為轉錄活性標記因子來顯示生物是否進行了基因轉錄及基因轉錄的活躍狀態。所以, 采用RNA Pol II CTD(S5)蛋白作為魚類生殖細胞發育的功能分子標記, 對不同發育狀態魚類生殖細胞的染色體進行免疫熒光分析, 可發展為定位和檢測與生殖細胞分裂過程的調控及發育密切相關的基因轉錄活性區域及其細胞相特征的一個有效途徑。
免疫熒光原位雜交技術(immunofluorescencein situhybridization technique, Immuno-FISH), 簡稱免疫FISH, 是利用抗原與抗體反應的原理, 將特異性抗原或抗體定位于試驗細胞或細胞中的染色體上的一種常用標記技術, 用以對特異蛋白抗原或抗體在細胞或染色體上的分布、表達量等情況進行研究, 以達到定量、定位檢測的效果。該技術已在人、小鼠、斑馬魚、果蠅等模式生物的染色體免疫熒光定位分析中有較多報道[7-11]。在魚類中, 常使用熒光原位雜交技術(fluorescencein situhybridization, FISH)對特異性遺傳序列進行染色體定位, 利用5S rDNA(染色體臂間標記因子)、著絲粒DNA(著絲粒標記因子)等串聯重復序列作為探針進行多倍體鑒定、雜交檢測或染色體結構畸變等研究[12-13]。目前, 利用基因轉錄表達調控相關的功能分子標記進行魚類生殖細胞染色體免疫熒光分析的研究很少。因此, 本研究選用了常規淡水試驗魚鯉(Cyprinus carpio, 俗稱common carp)作為研究對象, 對其生殖細胞的染色體進行RNA Pol II CTD(S5)蛋白定位分析, 以探討魚類生殖細胞染色體免疫熒光的方法。
1 材料與方法
1.1 試驗材料
本試驗所取用的試驗魚鯉來自于湖南師范大學省部共建淡水魚類發育生物學國家重點實驗室及湖南湘云生物科技有限公司, 性腺組織等需解剖后取材, 試驗魚在被解剖前都使用2-苯氧乙醇(美國西格瑪)實施昏迷處理。
1.2 試驗方法
1.2.1 染色體制片
試驗魚剪鰓放血5~10 min后進行解剖, 取性腺用以制備生殖細胞染色體, 取腎臟用以制備體細胞染色體。用腎臟進行染色體制片時, 需要在取材之前根據魚的體重注射適量植物血球凝集素(phytohemagglutinin, PHA)溶液, 以刺激腎組織中的淋巴細胞分裂, 并根據魚的體重注射適量秋水仙素溶液, 以阻止細胞完成細胞分裂。將取好的材料放在培養皿中, 添加適量生理鹽水(質量分數為0.8%)以維持材料的細胞形態。用小剪刀剪碎相關材料, 移置15 mL離心管中吹打7~9 min。靜置6~9 min后, 緩慢吸取上清液, 注意不要吸取沉淀, 離心(1 200 r/min, 5 min), 棄上清液, 留沉淀。在離心得到的細胞沉淀中加入0.050% KCl低滲液(腎臟細胞用0.075% KCl低滲液), 低滲60~120 min, 離心(1 200 r/min, 5 min), 棄上清液, 留沉淀。加入適量卡諾氏液(注意卡諾氏液需要現配現用, 甲醇和乙酸3∶1體積比的混合液), 反復固定細胞沉淀2~5次, 每次固定15 min, 離心(1 200 r/min, 5 min), 棄上清液, 留沉淀。固定好后, 加入少許卡諾氏液, 吹散細胞沉淀。滴片時, 將細胞懸液滴于載玻片正中央。細胞懸液于4℃或-20℃冰箱保存。
1.2.2 免疫熒光定位
在低溫下, 加入適量5%多聚甲醛, 固定相關細胞及染色體制片10 min, 使用1×磷酸緩沖鹽溶液(phosphate buffer saline, PBS)重復清洗3次, 每次2 min。然后將染色體制片置于2.0% Triton X-100溶液中5 min, 使用1×PBS重復清洗3次, 每次2 min。將染色體制片置于5%牛血清白蛋白溶液中, 封閉20 min。加入適量一抗RNA Pol II CTD(S5)(1∶100 dilution;Abcam5131)稀釋液, 將染色體制片放在濕盒中, 4℃下孵育12 h, 然后使用1×PBS重復清洗。在避光條件下, 加入適量異硫氰酸熒光素(fluorescein Isothiocyanate, FITC)標記的二抗稀釋液, 在37℃下孵育60 min, 使用1×PBS重復清洗幾次。滴加少量4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI, 質量濃度為0.2 mg/mL)染液, 采用熒光數碼顯微攝像系統(DM4B, 徠卡Leica, 德國)觀察和拍照。
2 結果與分析
2.1 染色體制片的影響
在免疫熒光試驗過程中, 染色體標本的儲存方式、儲存條件、儲存時間及滴片時的處理方式對試驗效果有著非常重要的影響。在其他試驗條件保持相對穩定的前提下, 本研究設置儲存時間梯度并對不同儲存方式(制備好的細胞懸液或染色體制片)進行了對比試驗。結果表明(表1), 以細胞懸液的方式于-20℃儲存的染色體標本做出的免疫熒光試驗效果比較好, 即滴片需現滴現用, 不能以滴在玻片上的形式儲存。當然, 若儲存時間較久, 染色體形態也會發生改變, 從而影響試驗結果。因此, 在儲存過程中需勤換存儲液, 以保護染色體的形態及其固有的蛋白活性。此外, 在試驗過程中還發現, 由于蛋白質加熱后易失活, 在冰凍玻片上滴片后, 不能用酒精燈烤片, 應靜置于常溫, 讓其自然風干。

表1 片齡以及儲存環境的不同對鏡檢效果統計Tab. 1 Microscopy results statistics of specimens preserved in different methods and duration
2.2 洗片方式的影響
由于用以免疫熒光試驗的染色體制片沒有經過烘烤, 導致染色體在玻片上的黏附程度以及形態的穩定性會有所下降。而且, 在后續的試驗過程中, 完成每一步反應后都需要對染色體制片進行清洗, 清洗的程度對后續的反應以及最終試驗結果中細胞的形態有著重要的影響。最終鏡檢結果中變形的細胞如圖1所示。在其他試驗條件保持相對穩定的前提下, 本研究對洗片過程中不同搖晃程度、搖晃時間及洗片溶液等因素進行了對比試驗。
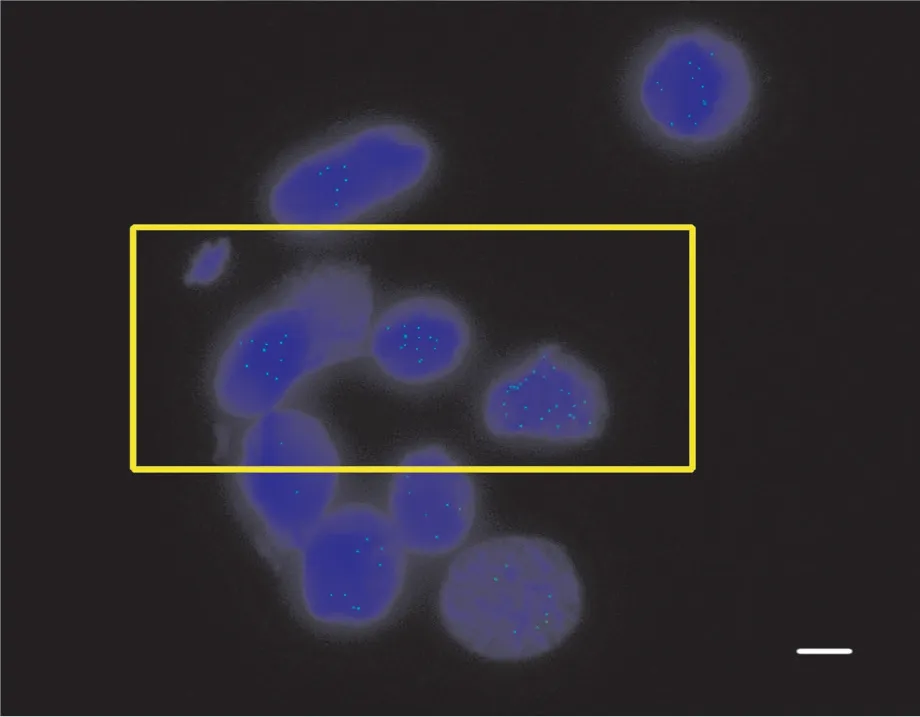
圖1 免疫熒光定位檢測中變形的細胞(比例尺為15 μm)Fig. 1 The distorted cells in immunofluorescence experiment (Scale bar is 15 μm)
為了更直接地觀察洗片方式對細胞形態的影響, 在染色體制片完成后直接對玻片進行清洗, 再用吉姆薩染液進行染色觀察, 最后選擇幾種具有代表性的洗片方式進行完整的免疫熒光試驗。試驗全程均使用黏附正電荷防脫玻片。
結果表明(表2), 在洗片過程中搖晃時間越長, 最終試驗結果中的細胞變形越厲害, 但完全不搖晃又可能會導致熒光鏡檢時的背景有些許不干凈。因此, 可以選擇每間隔2 min輕輕搖晃, 以保證洗干凈殘留的試劑。染色體制片在預試驗吉姆薩染液染色觀察后, 需要用流水沖洗。考慮到流水沖洗的影響, 本研究做了一個不洗片直接染色后沖洗的染色體制片。結果表明, 在玻片背面用流水沖洗并不會影響細胞的形態。因此, 本試驗發現也可以采用沖洗的方法來清洗免疫熒光試驗過程中殘留在玻片上的試劑。
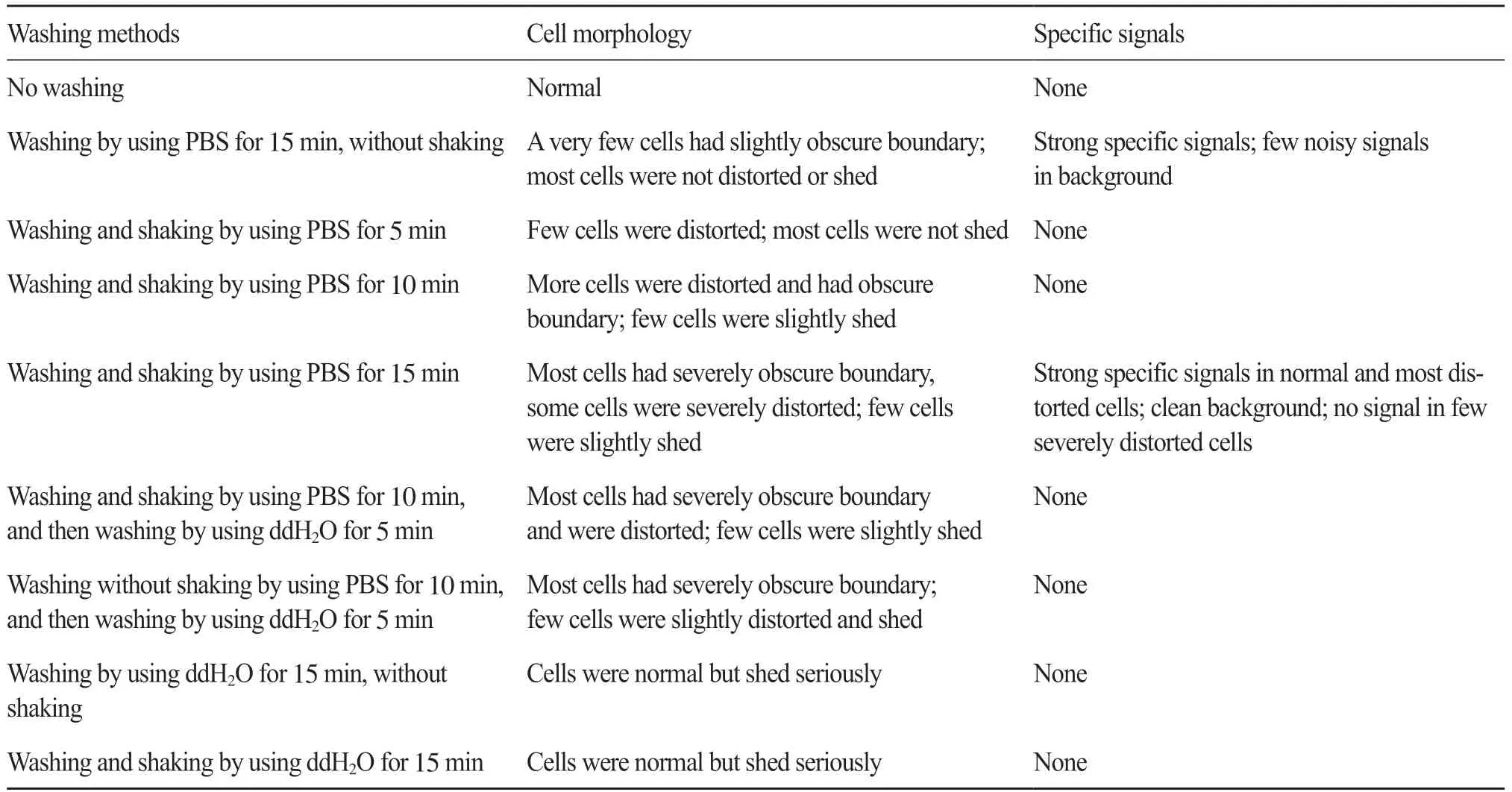
表2 洗片方式對鏡檢結果的影響Tab. 2 Microscopy results statistics of specimens treated in different washing methods
2.3 RNA Pol II CTD(S5)蛋白免疫FISH在鯉生殖細胞的定位特征
以鯉體細胞作為對照, 利用免疫熒光技術對RNA Pol II CTD(S5)蛋白在鯉生殖細胞染色體中進行定位分析, 結果發現(圖2), 在鯉的生殖細胞分裂相中可檢測到規律性的特異性定位信號。對免疫熒光試驗結果進行統計后發現, 鯉體細胞染色體的RNA Pol II CTD(S5)定位信號數目明顯比生殖細胞的多, 且在數目上呈現一定的規律性(表3):體細胞間期分裂相主要呈現21~24個信號, 也有一部分為8~12個信號;中期分裂相主要呈現10~12個信號, 也有一部分為1~5個信號。在鯉生殖細胞中(表4), 處于減數第一次分裂前期的生殖細胞主要呈現8~20個信號, 數目明顯多于處于其他減數分裂階段的生殖細胞的信號數。隨著減數分裂的進行, 生殖細胞中的特異性信號逐漸減少, 在成熟精子中則檢測不到相關信號。該結果表明, 鯉雄性生殖細胞發育過程中的基因轉錄活性具有一定的規律性。

表3 鯉體細胞中信號數目統計Tab. 3 Statistics of signals number in somatic cells of common carp

表4 鯉生殖細胞中信號數目統計Tab. 4 Statistics of signals number in germ cells of common carp

圖2 RNA Pol II CTD(S5)蛋白在鯉體細胞和生殖細胞染色體中的免疫熒光檢測Fig. 2 Immunofluorescence detection of RNA Pol II CTD (S5) protein in chromosomes of common carp somatic and germ cells
3 討論
生殖生物學一直是生命科學領域的重要研究課題之一, 而魚類的生殖發育研究在基礎理論及育種實踐方面都具有非常重要的意義。在生殖細胞發育的研究中, 有效的功能分子標記有助于研究試驗對象的生殖發育及其調控網絡的分子機理, 在哺乳動物和臨床醫學領域研究中已經得到了廣泛應用[1-2]。例如, 我國學者已經從單細胞水平系統闡述了人類精子發生過程中的基因表達調控網絡和細胞命運轉變路徑, 挖掘出多個只在特定細胞類型表達的關鍵功能分子標記[14]。在魚類中, 得以鑒定的生殖細胞標記基因也日益增多, 包括vasa、nanos、dnd(dead-end)、dazl(deleted in azoospermialike)、sdf1(stromal cell-derived factor-1)和cxcr(chemokine receptor)等[15-19]。但這些基因的表達多集中在原生殖細胞(primordial germ cells, PGCs), 而魚類生殖細胞的發育過程(以雄性生殖細胞為例)涉及PGCs、精原細胞、初級精母細胞、次級精母細胞、精子細胞和精子等多種細胞類型。因此, 僅使用上述幾個分子標記來探索魚類生殖細胞的發育機理還遠遠不夠, 亟需挖掘新的功能分子標記并應用于魚類生殖細胞的發育過程研究中。本研究利用RNA Pol II CTD(S5)蛋白作為分子標記對鯉雄性生殖細胞核進行免疫熒光試驗, 成功獲得了定位信號, 并對染色體標本保存條件、洗片方式等技術參數進行探討和總結。該研究結果不僅為魚類生殖發育過程中基因轉錄活性的相關研究奠定重要的候選標記, 還為該技術的廣泛應用提供了重要經驗。
關于利用RNA Pol II CTD蛋白作為分子標記來做免疫熒光的研究在許多生物中均已有所報道。例如, 在非洲爪蟾卵母細胞中, 通過免疫熒光顯色將RNA聚合酶II大亞基RPB1定位于細胞核核漿, 發現少量RPB1與燈刷染色體的轉錄單位有關, 并在RNA Pol II CTD(S2)和RNA Pol II CTD(S5)上發生磷酸化[20]。在小鼠卵母細胞減數分裂過程中, 通過磷酸化的RPB1的免疫熒光染色體定位, 檢測到p-RNA Pol II CTD(S2)準確定位于微管組織中心(microtubule-organizing center, MTOC)和著絲粒中;p-RNA Pol II CTD(S5)與減數分裂過程中紡錘體的微管保持共同定位, 并維持紡錘體結構的穩定性;p-RNA Pol II CTD(S7)與微管的聚合狀態有關[21]。在哺乳動物(人和小鼠)細胞中, 通過免疫熒光試驗檢測到p-RNA Pol II CTD(T4)與RNA Pol II的超磷酸化形式(Pol IIO)密切相關, 推測其可能參與了基因轉錄延伸的調控[22]。在小鼠的精巢組織中, 通過免疫組化檢測到p-RNA Pol II CTD(S5)抗體于小鼠每一類生殖細胞中均有陽性反應, 直至第8階段精子細胞;而在人類精巢組織中, 于精母細胞粗線期到第3階段精子細胞有陽性反應, 其余階段無陽性反應[23]。目前為止, 很少有在魚類中進行的RNA Pol II CTD蛋白定位研究。本研究在鯉細胞中對RNA Pol II CTD(S5)蛋白免疫熒光FISH進行開創性探索試驗, 發現與RNA Pol II CTD(S5)蛋白關聯的轉錄活性位點數在體細胞和生殖細胞不同階段均呈現出規律性分布, 該結果可直接反映出魚類生殖細胞發育過程中的基因轉錄活躍性, 并且熒光位點數目與染色體數目具有一定的關聯性, 在魚類多倍化研究方面也具有重要的意義。

