3株牛支原體對牛體的試驗感染研究
駱 璐,陳忠瓊,謝建華,蔣佳利,凌洪權,歐陽吳莉,曾 政
(重慶市動物疫病預防控制中心,重慶 渝北 401120)
牛支原體(Mycoplasmabovis,M.bovis)是嚴重危害養牛業發展的一種重要傳染性病原體,其能夠引起肉牛和奶牛支氣管炎、肺炎、關節炎和乳腺炎[1]。1961年,美國最早報道了一起由牛支原體感染引起的牛乳腺炎[2],而后,隨著牛及牛產品(牛乳、牛精液等)的國際貿易增加,該病原在世界范圍內開始蔓延。2008年6月,我國湖北、重慶、甘肅、貴州、山東等地區相繼發現了以肺肉變及壞死為主要特征的牛呼吸道傳染病[3],同年9月,辛九慶等首次從患肺炎的犢牛肺臟中分離到牛支原體,標志著牛支原體在我國的定植[4]。
傳染性牛支原體肺炎是由牛支原體引起的,以壞死性肺炎為主要特征的牛細菌性呼吸系統疾病,患病率達50%~100%,平均病死率為10%,高者可達40%,這給我國養牛業造成了嚴重的經濟損失[5]。研究顯示,該病原主要侵害3~12月齡的犢牛,牛一旦感染,可持續帶菌并排菌。在生產實際中,大量使用抗菌藥導致牛支原體的耐藥性逐漸升高[6-7]。為有效防控該病并防止超級耐藥菌的出現,已有大量研究報道了有關牛支原體滅活疫苗、亞單位疫苗等的研制,但國內外仍無商業化的有效疫苗可用于預防牛支原體感染[8]。
本試驗采用臨床分離到的3株牛支原體分離株感染犢牛,觀察并記錄感染犢牛的臨床癥狀和體征,剖檢觀察肺部病變情況,采用實驗室診斷方法對牛支原體感染情況進行分析,從而得出3株牛支原體分離株的特征,為疫苗株的篩選提供理論基礎。
1 材料與方法
1.1 主要試劑 牛支原體ELISA抗體檢測試劑盒,購自北京寶威特生物技術有限公司;DL-2 000 DNA Marker,購自天根生化科技(北京)有限公司;PPLO Broth、PPLO Agar,均購自Becton Dickinson and Company;Yeast Extract、馬血清,均購自賽默飛世爾科技公司;青霉素鈉,購自成都科龍化工試劑廠;2×Taq酶,購自寶生物工程(大連)有限公司;DNA/RNA抽提試劑盒,購自上海華舜生物技術有限公司;瓊脂糖凝膠粉,購自上海普洛麥格生物產品有限公司;菌株保守序列擴增引物由生工生物工程(上海)股份有限公司合成。
1.2 菌株 采用本實驗室前期從患有嚴重呼吸道癥狀的病/死牛肺部分離到的3株牛支原體分離株,分別為W70株、Q3株和JX02株,由本實驗室暫存。牛支原體的復蘇培養和鑒定具體方法參照本實驗室前期發表的文章[9]。復蘇后的菌種用聚合酶鏈式反應(PCR)擴增后,通過瓊脂糖凝膠電泳進行鑒定。引物序列:上游引物Mbl:5′-TTTAGCTCTCATTAGAACAAAT-3′;下游引物Mb2:5′-GCCTCTCTTTAAGAATGTC-3′。
1.3 試驗動物 選擇當地黃牛與西門塔爾牛冷凍精液人工配種得到的4~7月齡子代犢牛12頭,經檢測均為牛支原體陰性。所有受試犢牛雇傭專人負責看護、飼喂、清掃和日常管理。
1.4 試驗設計 將12頭準備進行人工感染的犢牛隨機分為4個組,每組3頭,分別是感染組(W70組、Q3組和JX02組)和陰性對照組。同組犢牛混群飼養,不同組犢牛飼養圈舍相距10 m以上。感染組采用氣管環注射法進行感染,用30 mL注射器吸取20 mL濃度為1×109CCU/mL的病原菌液體培養物,在咽部下方、靠近氣管上部,將注射器針頭穿透頸部皮膚和肌肉層后,從兩氣管環狀軟骨中間連接處進針穿透氣管,緩慢推注菌液至氣管中。共人工感染2次,間隔時間7 d。陰性對照組采用相同方法、次數、劑量注射培養用的肉湯培養基。
1.5 犢牛人工感染牛支原體模型的建立 感染后30 d無菌剪取肺部病變組織,勻漿后涂布于固體培養基,挑取單菌落,采用煮沸法提取菌落DNA,進行PCR擴增及電泳,如感染組出現陽性條帶,并結合觀察到的臨床癥狀,可判斷氣管環注射法使牛支原體在肺臟成功定植,犢牛人工感染牛支原體模型建立成功。
1.6 臨床觀察 感染后30 d內,每天觀察犢牛的精神狀態、食欲狀況、反芻狀態、被毛情況、眼鼻分泌物情況、臨床三大體征(呼吸、脈搏、體溫)等。
1.7 剖檢觀察和組織病理學檢查 感染后30 d,剖檢所有犢牛,觀察肺部有無壞死灶、肺臟顏色變化情況、肺組織和胸腔粘連情況、胸腔積液情況、肺萎縮情況、肺部肉樣變情況等。記錄臟器病理變化情況并按照病理評分標準(表1)進行評分,評分標準參照參考文獻[10],并結合實際略作改動。剖檢觀察后,分別取陰性對照組正常肺部組織及感染組病變肺部組織,制成石蠟切片,在顯微鏡下觀察組織病理學變化。
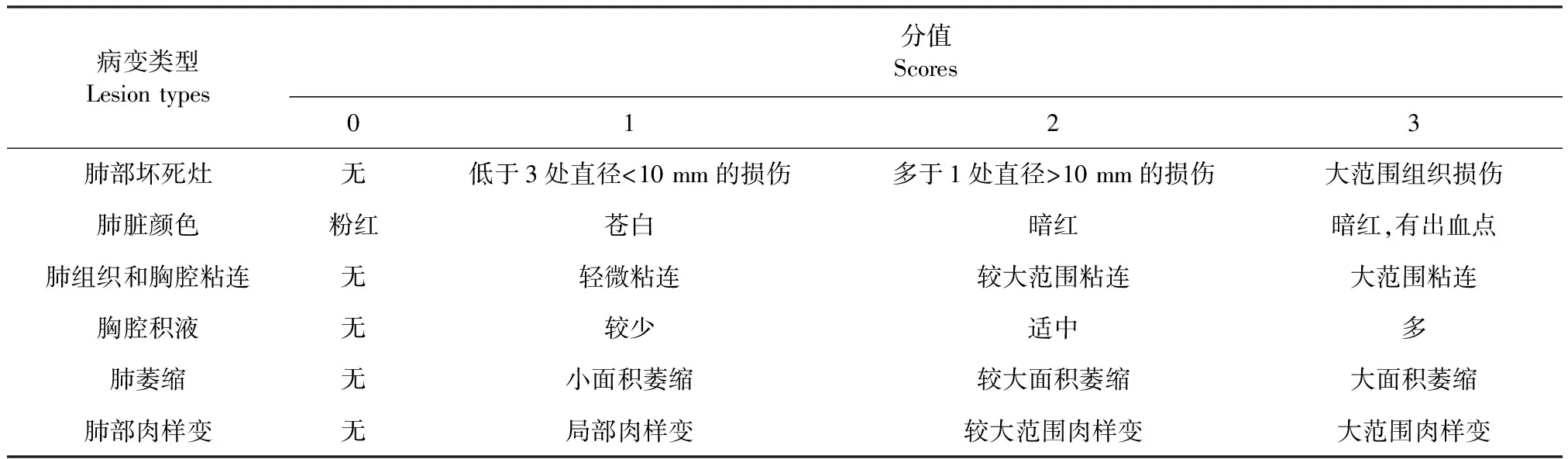
表1 病理評分標準[10]
1.8 血清抗體ELISA檢測 從感染開始第1天起,連續每天對所有犢牛進行頸靜脈采血,4 ℃靜置過夜,分離血清,存放于-20 ℃,待30 d觀察期結束后統一用ELISA法進行牛支原體血清抗體檢測。
2 結果
2.1 犢牛人工感染牛支原體模型的建立 3株牛支原體人工感染后,感染組犢牛均在2~7 d后開始出現不同程度呼吸道癥狀。鼻孔開始大量分泌黏液,并伴有少量膿性分泌物,眼角有淡黃色膿性分泌物。偶見咳嗽、噴嚏,聽診有啰音,其中以W70組最為明顯。陰性對照組未表現出明顯的臨床癥狀。剖檢犢牛時無菌剪取肺部病變組織,勻漿后涂布于固體培養基,培養的菌落用PCR法進行檢測,感染組出現陽性條帶,確定為牛支原體。上述臨床癥狀和實驗室檢測結果均證明本試驗的動物模型建立成功。
2.2 臨床三大體征監測 比較各組試驗犢牛的脈搏、體溫和呼吸頻率的平均水平,結果如圖1所示,陰性對照組和感染組的脈搏頻率均在正常值范圍內(72~100 次/min)[11];W70組的體溫和呼吸頻率均在人工感染后的第2天逐漸升高,到第2次人工感染(第7天)后出現大幅上升,到第9天體溫達到最高峰40.1 ℃,呼吸頻率達到最高頻次44 次/min;JX02組和Q3組也存在同樣的趨勢,但相對W70組幅度較小。
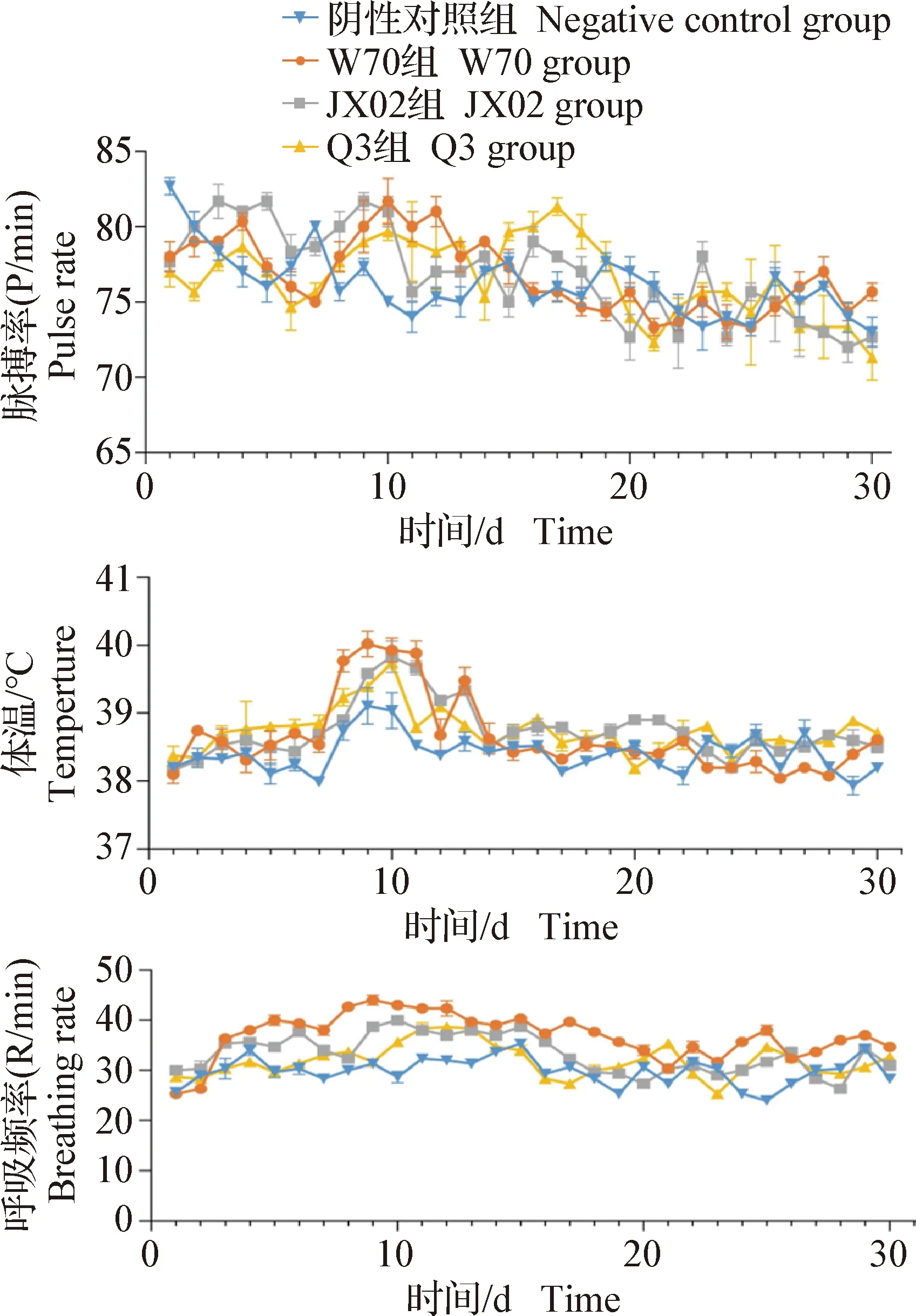
圖1 臨床三大體征變化
2.3 剖檢觀察 試驗觀察期結束后剖檢試驗犢牛結果顯示,感染組犢牛的肺部均存在不同程度的病變,包括肺臟出血、萎縮,表面圓形暗紅色壞死灶(圖2A),局部出現白色結節,肺部實變(圖2B),氣管內有大量黏性分泌物等;陰性對照組犢牛肺部質地柔軟,顏色呈粉紅色,無病變(圖2C)。根據病理評分標準,對各感染組犢牛進行分值累加并求平均數,結果W70組平均12.0分,JX02組平均7.3分,Q3組平均5.6分,陰性對照組未發現病理變化,記為0分,評分結果見表2。
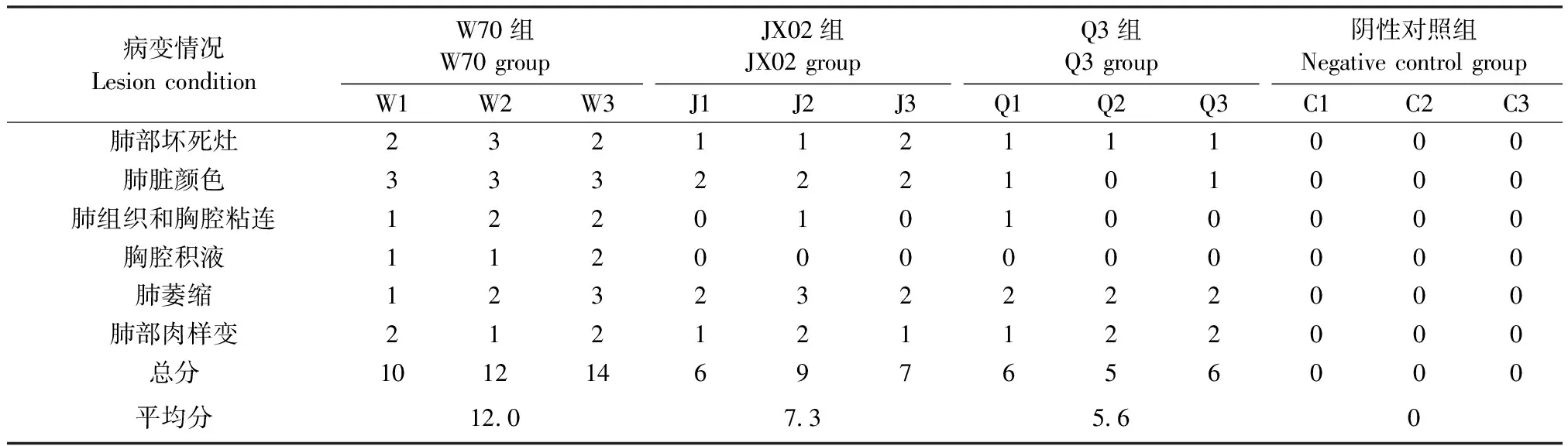
表2 病變情況評分
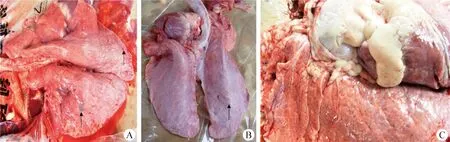
圖2 肺部剖檢觀察
2.4 組織病理學檢查 通過光學顯微鏡觀察肺部病理組織切片發現,陰性對照組肺小葉無肉眼可見病理變化(圖3A);W70組表現為肺泡壁增厚,肺泡腔內充滿均質漿液,肺泡擴大,肺泡腔內充滿大量的中性粒細胞,肺泡內纖維素性滲出物,紅細胞大量溶血,中型粒細胞壞死、纖維素溶解,細支氣管周邊炎性浸潤,大量中性粒細胞聚集,血管周邊大量淋巴細胞浸潤,黏膜(固有層)大量淋巴細胞浸潤,肺萎陷等(圖3B);JX02組出現肺泡壁毛細血管紅細胞溶血,肺泡萎陷,細支氣管(終末)周邊肺泡壁增厚,局部淤血(圖3C);Q3組出現細支氣管黏膜下淋巴細胞浸潤,肺泡壁增厚,周邊肺泡壁部分塌陷,周邊結締組織增生,細支氣管內有散落的纖維素和中性粒細胞(圖3D)。
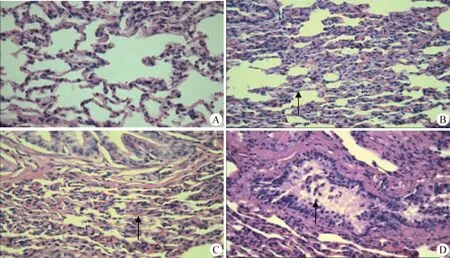
圖3 肺部組織病理切片(H.E.染色,400×)
2.5 血清抗體ELISA檢測 血清抗體檢測發現,各感染組的抗體水平變化趨勢相同。各感染組首次感染后血清抗體水平均有所升高,第2次感染后抗體水平均出現明顯增長趨勢,且均在感染后15 d時出現高峰,而后開始消減。其中W70組的抗體最高OD值可達1.24,直到試驗結束時抗體OD值仍維持在0.74;JX02組的抗體OD值峰值為1.15,試驗結束時消減至0.5,并有持續下降的趨勢;Q3組在首次感染后抗體水平較另外2個感染組高,達到峰值(1.01)的時間更早,但其峰值較低,且最終維持的抗體水平也最低(0.44),見圖4。
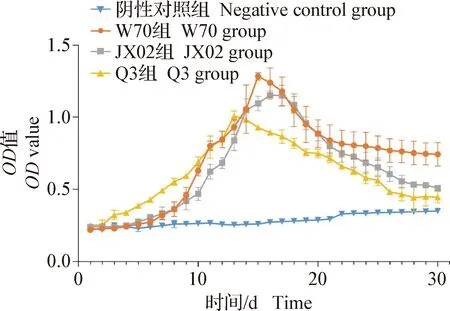
圖4 血清抗體水平
3 討論
支原體在動植物以及人體中廣泛存在,種類繁多,其中牛源支原體就有20多種[10]。為探究牛支原體的致病特性,本課題組前期通過牛支原體分離株感染健康雞胚和BALB/c小鼠成功復制了牛支原體感染的病理模型,在小鼠感染模型中,通過致死率對牛支原體的毒力進行了初步評價,發現W70株對小鼠的毒力最強,其次是Q3株,最后是JX02株[12]。而本次犢牛的感染模型中,毒力強弱順序依次為W70株>JX02株>Q3株,說明相同的菌株會因不同環境、不同接種方式、不同宿主等表現出不同的侵襲力。因此,在進行疫苗候選株篩選時,回歸本體動物的攻毒試驗是必不可少的環節。
通過對試驗動物的臨床癥狀觀察表明,本試驗采用的氣管環注射法能夠成功還原牛支原體肺炎感染模型,感染組犢牛均表現出體溫升高、呼吸頻率加快等癥狀,而W70組在感染約10 d時,體溫和呼吸頻率均超過了正常范圍。此外,感染組犢牛還表現出咳嗽、流黏液性鼻液、眼部分泌物增多、腹式呼吸等臨床癥狀,這與自然感染所報道的臨床癥狀相似[13]。本試驗感染組犢牛脈搏頻率均在正常值范圍內,表明脈搏頻率受牛支原體感染的影響較弱。病理組織學檢查結果顯示,感染組犢牛的肺部組織均存在不同程度的病變,主要以間質性肺炎和纖維素性滲出性肺炎為主,其中W70組的肺部組織損傷最為嚴重,該結果也證明了W70株對牛的肺部有較高的致病性。
本試驗血清抗體檢測結果顯示,無論是毒力較強的W70株還是其他2個毒力較弱的JX02株和Q3株,均在首次感染后約15 d時達到最高抗體水平,但高濃度的抗體水平持續時間較短,這也是支原體在牛群中難以消除、易反復感染的原因之一。提示在今后牛支原體疫苗的實際應用中,若要維持較高的抗體水平,還需更進一步制定合理的免疫程序和確定合適的免疫劑量。
本試驗結果顯示,牛支原體W70株、JX02株和Q3株對犢牛均有致病性,但W70株的毒力最強。結合本實驗室前期研究成果[14],這可能與W70株的全菌蛋白條帶數量較多有關,牛支原體侵襲力與蛋白質表達量和功能的關系還有待進一步研究。總之,本試驗成功篩選出W70株作為牛支原體疫苗候選株,同時也為后續蛋白質組學研究和牛支原體細胞感染模型的建立提供了思路。

