例講奧賽考點
——碳正離子的產生及穩定性比較
唐生岳
(江蘇省大豐高級中學)
化學反應的實質是舊鍵的斷裂和新鍵的形成.有機化學反應中舊鍵的斷裂主要有2種方式:一種是均裂形成自由基;另一種是異裂形成碳正離子(或是形成碳負離子).有機反應的機理主要包括自由基反應機理、親電反應機理、親核反應機理及環狀過渡態的周環反應機理.其中,考查最多的是親電反應(加成或取代)機理和親核反應(加成或取代)機理,而親電反應機理是碳正離子或是具有缺電子特征結構的物質與具有富電子特征結構的物質間的反應,親核反應是負離子或富電子結構物質進攻正電性或是缺電子的物質間的反應,而其中最為重要的是碳正離子的形成和碳正離子的穩定性對有機反應機理的影響.因此,對碳正離子的穩定性等的考查成了化學奧賽、高考強基考試的必考考點.本文以化學奧賽真題為例講解碳正離子的穩定性及碳正離子對反應機理的影響.
1 碳正離子的產生及其穩定性比較
1.1 碳正離子的產生
碳原子上連接有1個電負性較大的原子或者基團,如鹵素原子(—X)、羥基(—OH)等,當這些電負性較大的原子或者基團離去時,會將碳原子的1個電子帶走,從而形成碳正離子;也可以是碳碳雙鍵中的π鍵斷裂,碳與氫離子結合而形成碳正離子,如乙烯分子與HBr反應時π 鍵斷裂,1 個碳原子先與H+結合,形成了乙基正離子.
比如(CH3)3C—I在硝酸銀的存在下離去碘離子就可以形成(CH3)3C+,再如(CH3)3C—OH 在酸性條件下,羥基質子化后去水,也可以形成(CH3)3C+.
1.2 碳正離子的結構特征
碳正離子中最簡單的是CH3+,其結構如圖1 所示.由此可以看出碳正離子是1個缺電子結構(碳原子的最外層只有6個電子).從雜化角度來看碳正離子的碳原子是以sp2雜化形式存在的,其中3個雜化軌道分別與3個氫原子形成了3個σ鍵,還有1個垂直于sp2雜化軌道(或說垂直于3個氫原子形成的平面)的空的p軌道.由于H 原子沒有孤對電子,所以甲基正離子中的正電荷集中而得不到分散,因此CH3+很不穩定.如果甲基正離子的氫原子被其他原子或原子團取代后,形成各種不同的碳正離子,可簡單表示為如圖2所示結構,其中x、y、z處于同一平面,碳原子的空軌道垂直于此平面,這些原子或原子團會對碳正離子的穩定性產生影響.

圖1
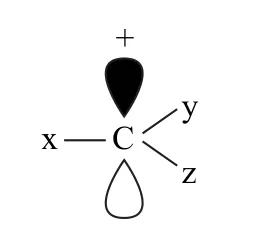
圖2
1.3 碳正離子的穩定性
1)烷基與空的p軌道的超共軛效應.當x、y、z被烷基取代后,可以形成sp3雜化軌道,與碳原子的空的p軌道形成σ-p超共軛效應(之所以稱為超共軛,是因為鍵所占軌道與空的p軌道不能完全平行并共面,所以形成的軌道重疊比較小,即超軛效應的強度低于共軛效應),使得碳正離子的電荷得到分散而更趨向于穩定.由此也可以得出,三級碳正離子(也稱叔碳正離子)的穩定性強于二級碳正離子(也稱仲碳正離子),強于一級碳正離子(也稱伯碳正離子),強于甲基正離子,記為3°>2°>1°>甲基正離子.
2)碳碳雙鍵與空的p軌道間的共軛效應.當x、y或z中有R—CH=CH—時,碳碳雙鍵中的π鍵與空的p軌道相互平行,軌道間重疊相對較充分,從而能提高碳正離子的穩定性.我們可以通過書寫共振式的方法對此進行驗證.簡單舉例:π-p共軛對碳正離子的穩定性影響遠比烷基的超共軛效應對碳正離子穩定性的影響大.
3)當x、y或z中有雜原子,如O、N 等時,由于其原子含有孤電子對,與碳正離子的空的p軌道可以形成p-p共軛,碳正離子的缺電子結構轉化為符合八隅體的氧正離子或氮正離子等,從而更有效地分散碳正離子的正電荷,也就更好地穩定了碳正離子,我們對此也可用共振式表示,如圖3所示.
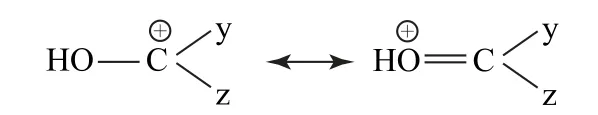
圖3
這樣的p-p共軛對穩定碳正離子的作用強于π-p共軛對穩定碳正離子所作的貢獻,因此也會使碳正離子更為穩定.
另外,當碳正離子與雜原子間連接有π鍵時,可以形成更大的共軛體系,可以使碳正離子更加穩定.比如,芐基正離子與對甲氧基芐基正離子或者是鄰甲氧基芐基正離子相比較,后者會比前者更為穩定,因為甲氧基中氧原子提供1對電子形成推電子共軛效應,更好分散碳正離子的正電荷;如果是間甲氧基芐基正離子時,甲氧基的氧原子就不能很好地與碳正離子形成推電子共軛效應,只能是因氧原子具有較大的電負性,對碳正離子起到的是吸電子誘導效應,這樣就不利于穩定碳正離子,其穩定性將會弱于芐基正離子.
4)碳正離子的重排.碳正離子形成后,只要是結構允許,碳正離子就可以發生重排,使其轉化成更為穩定的碳正離子.發生遷移的原子或原子團,可以是氫原子、甲基,甚至是苯基等.例如,
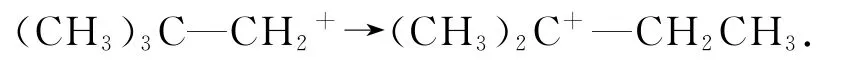
2 中學化學奧賽真題解析
例1(第32屆中學生化學奧賽初賽第10題,有刪減)以下正離子可以經過4π電子體系的電環化反應形成環戊烯正離子,該離子可以失去質子形成共軛烯烴(如圖4).

圖4
根據以上信息,畫出下列反應主要產物的結構簡式(產物指經處理后得到的化合物).

解析本題中的已知條件告訴我們“正離子可以經過4π 電子體系的電環化反應形成環戊烯正離子”,因此在解題時我們首先可以考慮的是能不能在所給條件下形成相應的2個特征結構:①形成(碳)正離子;②4π 電子體系的電環化反應形成環戊烯正離子.所以我們可以圍繞特征結構的形成過程來分析和解決問題.
(1)該反應物是在酸性條件下反應的,即可以進行質子化得到相應的碳正離子,這里形成的碳正離子有2種可能:①氧原子質子化,再得到其共振結構;②碳碳雙鍵的質子化形成碳正離子.但在2個變化中只有①的變化可以形成題給條件下的4π電子體系,其反應機理如圖5所示.

圖5
(2)從反應條件可以看出,在銀離子存在下,可以奪去1個氯離子,形成環丙基的碳正離子,由于三元環的角張力較大,因此引起了開環而形成新的碳正離子,這里我們要注意其開環的動力來自與碳相連的氧原子,可以利用氧原子的孤電子對與碳正離子的空軌道形成p-p共軛而使碳正離子的電荷分散,從而形成更為穩定的碳正離子.并且,此碳正離子正好符合題給條件提示的兩大特征,從而即可得到相應的產物,其反應機理如圖6所示.
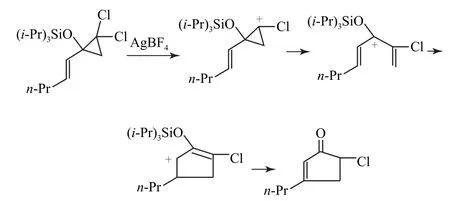
圖6
(3)第(3)小題的第一步可以參考第(1)小題的經驗,先是氧原子質子化,再寫出其共振式就可以得到我們需要的目標碳正離子,即完成第一步反應,形成環戊烯正離子,而此時形成的碳正離子,與其左側的碳碳雙鍵發生親電加成反應,形成比較穩定的六元環狀碳正離子.該碳正離子與苯環又可以發生親電取代(傅-克烷基化反應)的過程,形成穩定的六元環狀化合物.其形成的機理如圖7所示.
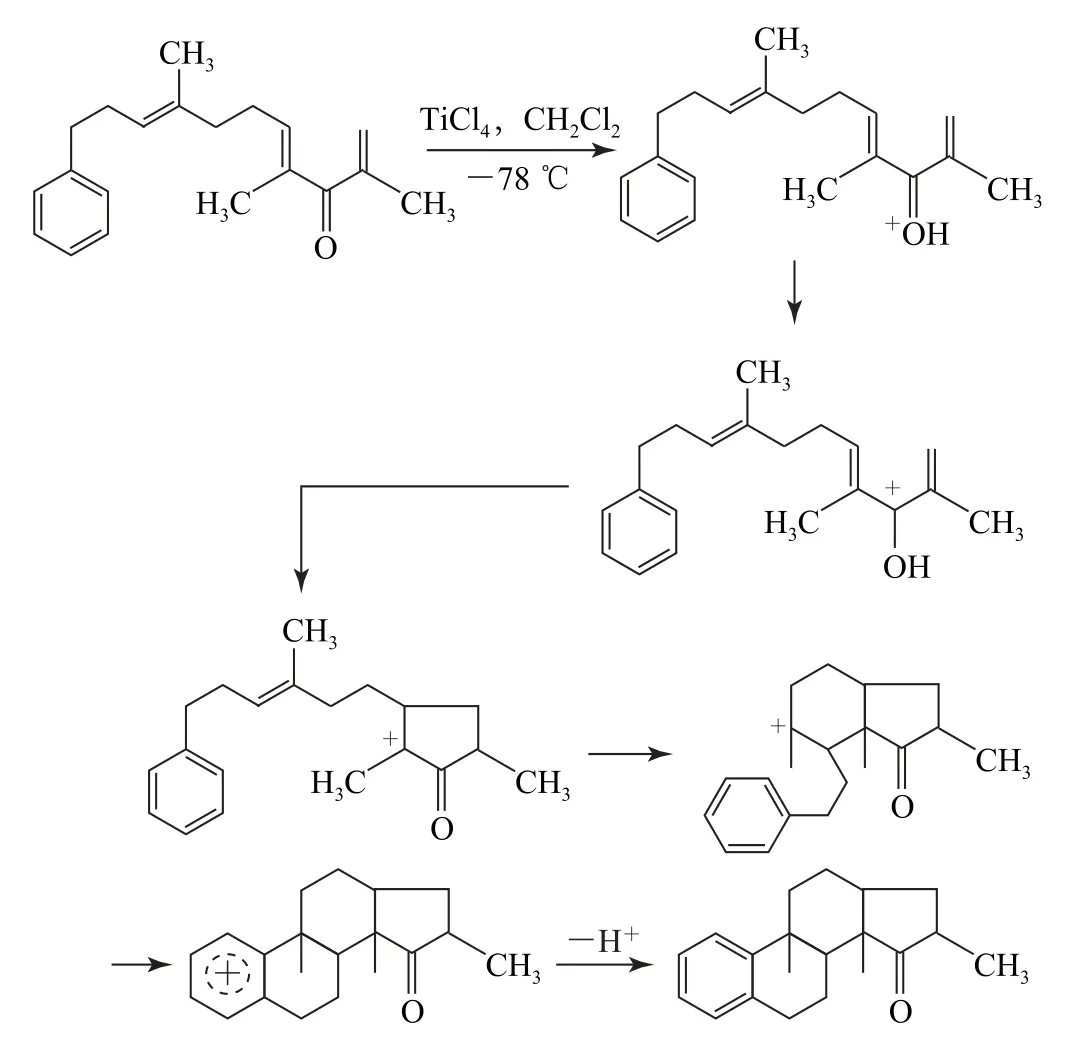
圖7

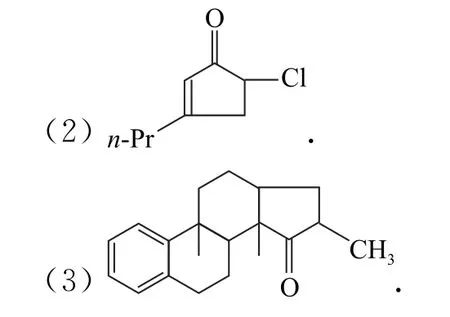
例2[第35 屆中學生化學奧賽初賽(江蘇賽區)第8題] 在酸性條件下,請按失水從易到難給以下化合物排序_________.

解析本題是醇在酸性條件下的失水過程.首先是羥基的質子化H2O+—R,然后脫水形成碳正離子,因此本題表面看是醇在酸性條件下的脫水反應,實質是形成碳正離子的過程.A、D 形成的碳正離子分別為,從這2個碳正離子可以看出,它們符合休克爾的“4n+2規則”,即可知兩者都具有芳香性,但A 形成三元環狀碳正離子的角張力比較大,穩定性弱于D 形成的七元環狀碳正離子;而B形成的碳正離子,具有4n特征的環形結構,有反芳香性,不穩定;而C是苯酚,羥基與苯環直接相連,其氧原子的1對孤對電子與苯環間可以形成p-π共軛,即其碳氧鍵具有部分雙鍵的性質,很難質子化脫水形成碳正離子,因此在4種物質中苯酚是最難質子化脫水形成苯正離子的物質.故在酸性條件下脫水由易到難的順序為D>A>B>C.
答案D>A>B>C.
可以看出,以上2道試題表面上都不是直接比較碳正離子的穩定性,但其考查的實質就是在比較碳正離子的穩定性.比如在某過程中有多種碳正離子可以形成,但由于碳正離子穩定性的差異,從而就得到了其產物的唯一性.我們在學習中首先要了解碳正離子形成的方式或是過程,然后對可能形成的碳正離子進行比較,從而分析出一個更為穩定的碳正離子,這樣就可以更好地解決問題.在掌握了碳正離子的形成、特征、穩定性的影響因素以后,再通過適當的變式訓練,可以提升我們對碳正離子的理解,同時也可以提升我們對碳正離子在反應機理中的應用的理解.
(完)

