肝細胞癌假包膜的MRI表現預測其生物學特征的臨床應用價值*
李增暉 龍金津 李勇 張小明 陳天武 李興輝
(四川省醫學影像學重點實驗室·川北醫學院附屬醫院放射科,四川 南充 637000)
肝細胞癌(Hepatocellular carcinoma,HCC)在全球癌癥發病率中占第六位,在因癌癥所致的死亡率中占到第三位,其發病率和死亡率還在不斷地增加,其中50%發生在中國[1-2],肝細胞癌容易侵犯肝內的血管系統,尤其是門靜脈系統,而手術切除是目前治療HCC最有效的措施,但術前有無合并門靜脈癌栓(Pvein tumor thrombus,PVTT)、肝內轉移以及術后腫瘤復發、轉移等直接影響患者治療手段的選取和臨床預后。然而,假包膜是HCC的特征性表現之一,也是腫瘤血流動力學改變的一個重要影響因素[3]。假包膜的形成是在各種酶、細胞因子和生長因子的作用下腫瘤細胞快速增長以及宿肝反應的結果[4]。據文獻報道HCC假包膜的出現是影響患者預后的利好因素[5],但學者Kojiro[6]提出不同意見,其研究發現在132例HCC中假包膜組的肝內血管癌栓形成、肝內轉移明顯多于沒有纖維包膜組,且有假包膜組病理學分級明顯高于沒有假包膜組。基于這種爭議,本研究回顧性分析經手術病理證實為HCC的MRI檢查圖像,判定HCC假包膜完整性與其生物學特性之間的差異性,包括患者病灶病理學分級、有無合并PVTT、術前肝內轉移、術后復發及術后肝內轉移等數據,從而探索HCC假包膜完整性的MRI表現預測HCC病理分級、治療方式及預后的臨床應用價值。
1 資料與方法
1.1 一般資料 選取2018年1月~2019年12月在我院經手術病理證實的53例HCC患者。患者年齡20~82歲,平均(52.5±29.2)歲,其中男性46例,女性7例。腫瘤大小1.0~13.4 cm,平均(5.16±3.09) cm。根據HCC病灶的直徑大小分為三組:小肝癌組(≤3 cm),結節型肝癌組(>3 cm且≤5 cm),巨塊型肝癌組(>5 cm)。所有患者均于術前1個月內行MRI平掃及動態增強掃描檢查,無肝癌治療病史,且有完整半年以上的MRI隨訪檢查資料。本研究經我院倫理委員會批準。
1.2 方法
1.2.1 掃描技術 患者檢查前均禁食6 h,檢查前30 min行均勻呼吸及屏氣訓練。采用GE 3.0T MRI掃描儀(Discovery MRI 750),32通道全腹部相控陣體部線圈行肝臟平掃及動態增強掃描。患者在靜息狀態下取仰臥位,雙臂上舉,定位中心位于患者劍突下緣,掃描范圍從膈頂至肝臟下緣。MRI掃描方案主要包括橫斷位T2WI、體素內不相干運動擴散加權成像(Intravoxel incoherent motion diffusion-weighted imaging,IVIM-DWI)和3D LAVA-FlexT1WI平掃和多期動態增強掃描,具體掃描參數如下:T2WI:TR/TE=970/90 ms,FOV=28~34 cm,矩陣=192~256*192~256,NEX=2,層厚=5 mm,層間距=0 mm。 DWI:TE=minimum ms,彌散方向3in1,矩陣=192~256*192~256,b值=0、50、100、150、200、300、500、800、1000、1500 s/mm2,NEX=1(b值0~500),NEX=2(b值800~1500)。3D LAVA-Flex T1WI:TR=4.6 ms,TE=2.2/1.1 ms,flip angle=15~20°,矩陣=192~256*192~256,FOV=28~34 cm,層厚=5 mm,層間距=0 mm。動態增強掃描對比劑采用美國Medrad 公司MRI專用雙管高壓注射器經前臂靜脈注射MRI造影劑釓噴酸葡胺( Gd-DTPA,GE藥業),濃度為0.5 mmol/mL,劑量0.2 mmol/kg,約20 mL,速率為3.0 mL/s,20 mL生理鹽水灌洗。每一時相采集時間13~18 s[7]。
1.2.2 圖像分析 所有MRI圖像傳至PACS閱片工作站,由兩位有5年以上工作經驗的腹部放射科醫師盲法閱片,對術前HCC腫瘤的假包膜完整性、PVTT、肝內轉移以及術后隨訪是否伴發腫瘤復發、轉移等進行觀察,對判斷有分歧的病例,協商解決,最后達成一致。按照有無假包膜及假包膜的完整性分為完整假包膜、部分及無假包膜。HCC假包膜通過多期動態增強掃描的延時期進行觀察,當延遲相顯示腫瘤周圍的高信號邊緣,則認為存在假包膜[8],腫瘤所有層面均可見完整環周延遲相強化則為完整假包膜組。在T2加權磁共振成像(T2 weighted imaging,T2WI)、擴散加權成像(Diffusion-weighted imaging,DWI)及動態對比增強(Dynamic contrast enhancement,DCE)序列對PVTT進行觀察,門靜脈分支及主干內癌栓均視為并發癌栓,并與血栓進行鑒別。術后轉移灶與術后復發病灶進行鑒別,轉移灶為術后非手術區的病灶;復發病灶為手術區周圍的病灶,均為術后至少6個月的隨訪結果。
1.3 肝癌病理分級 HCC病理分級依照本院術中病理結果進行分級,參照Edmondson-Steiner分級方法[9]分為高中低分化三等級。
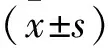
2 結果
2.1 不同HCC病灶大小與假包膜完整性的統計 本研究共53例HCC患者,54例腫瘤的MRI影像資料,1名患者原發腫瘤為2例。其中,完整假包膜HCC患者20例,平均值(3.75±1.99)cm,部分及無假包膜HCC患者34例,平均值(5.99±3.33)cm。假包膜完整性與病灶大小相關性研究,不同肝癌病灶大小與假包膜是否完整的差異有統計學意義(P<0.05),提示肝癌病灶越大,假包膜越不完整。見表1。

表1 HCC病灶大小與假包膜完整性的統計(n)
2.2 假包膜完整性與PVTT的關系 PVTT T2WI顯示為門靜脈腔內略高信號,DWI為高信號,DCE顯示為中度強化。本研究中,54例腫瘤,20例為完整假包膜HCC,其中2例有PVTT;34例為部分假包膜或無假包膜,其中12例有PVTT,2檢驗兩組之間存在明顯差異(P<0.05)。見圖1、表2。
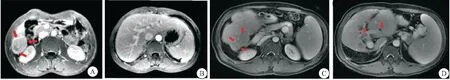
圖1 2例HCC患者有無門靜脈癌栓的MRI圖像
2.3 假包膜完整性與肝內轉移的關系 本研究中完整假包膜HCC20例,其中術前轉移肝內4例;部分及無假包膜34例,其中術前肝內轉移10例,盡管部分及無假包膜組伴發肝內轉移發生率高于完整假包膜組,但經2檢驗組間差異無統計學意義(P=0.446)。見圖2A~2B、表2。
2.4 假包膜完整性與術后復發的關系 在20例完整假包膜HCC患者中,術后一年內復發為4例;部分及無假包膜HCC為34例,其中術后一年內復發為18例,2檢驗兩組間差異有統計學意義(P=0.017)。見圖2C~2D、表2。
2.5 假包膜完整性與術后轉移的關系 完整假包膜HCC患者20例,其中術后一年內轉移為2例;部分或無假包膜HCC患者34例,其中術后一年內轉移為21例,2檢驗兩組差異有統計學意義(P=0.01)。見圖2E~2F、表2。
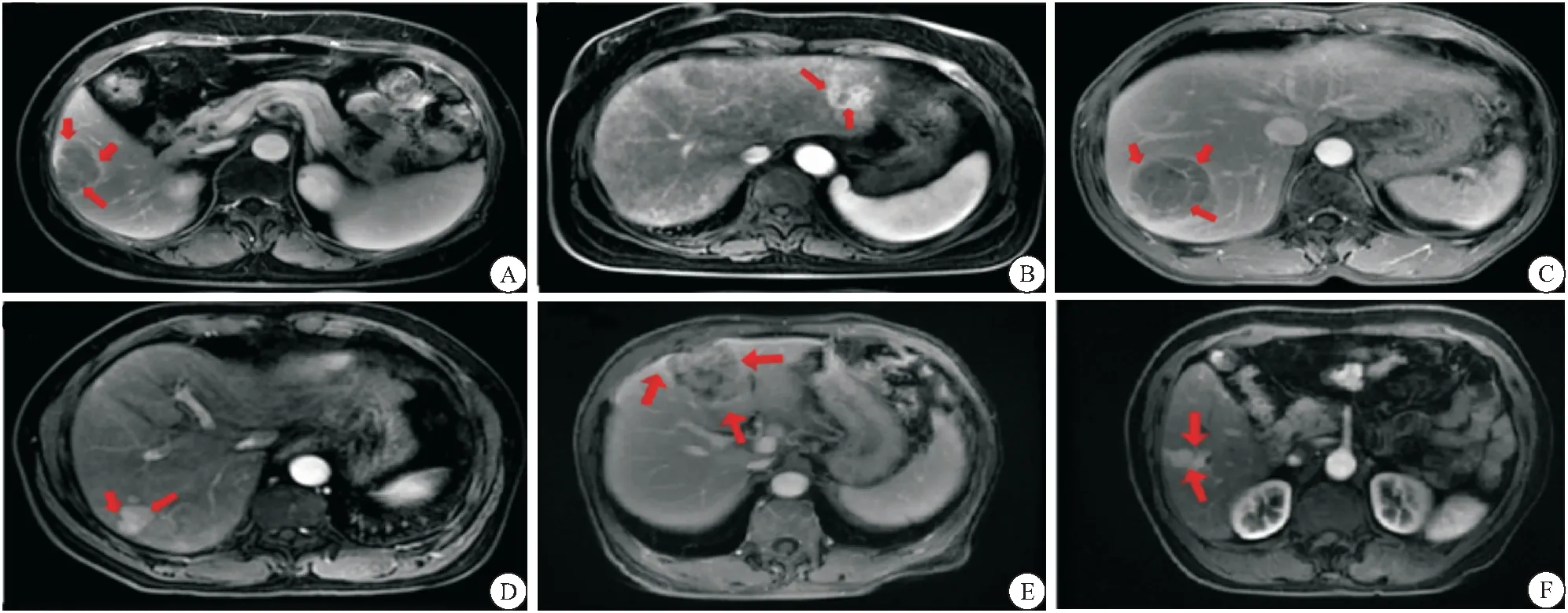
圖2 HCC包膜完整性伴發肝內轉移、術后復發、術后轉移的MRI圖像
2.6 假包膜完整性與病理分級的關系 根據Edmondson-Steiner病理分級,高分化10例(圖3A~3B),中分化37例(圖3C~3D),低分化7例(圖3E~3F)。假包膜完整高、中、低三型HCC分別為 5、13、2例,部分及無假包膜病例分別為5、24、5例,盡管隨著肝癌病理分型降低,HCC假包膜的完整率有降低趨勢,但三組之間差異無統計學意義(P>0.05)。見表2。

圖3 3例不完整假包膜HCC患者的病理分級
3 討論
有學者提出HCC假包膜完整率為14%~44%,且隨著腫瘤體積的增大,包膜完整度降低[10],本研究發現HCC完整包膜20例(37%),與以上研究結果相符。針對國內外研究關于HCC假包膜完整性是否影響患者預后、病理分級等爭論,本研究首次納入了PVTT發生、術前轉移、術后復發、術后肝內轉移、HCC病理分級五項生物學特征指標,并對術后復發和肝內轉移進行了區分,采用MRI評價HCC假包膜完整性與其生物學特征的關系,擬更加全面的預測HCC治療方式、惡性程度及預后。

表2 HCC假包膜完整性與其生物學行為的關系[n(×10-2)]
3.1 完整假包膜組與部分或無假包膜組之間PVTT發生率的差異性分析 HCC容易侵犯肝內血管系統,尤其是門靜脈系統。據文獻報道PVTT的發生率為44%~62.2%[11],遠高于肝靜脈癌栓(Hepatic vein tumor thrombus,HVTT)、下腔靜脈癌栓(Inferior vena cava tumor thrombus,IVCTT)及膽管癌栓(Bile duct tumor thrombus,BDT),HVTT和BDT的發生率為0.7%~20%和1.84%~13%[12]。PVTT是進展期HCC的常見并發癥,它的存在是腫瘤分期重要決定因素,對治療的選擇和預后影響也很大[13]。相關研究表明PVTT不僅與瘤內的異常血管結構、門靜脈逆流和凝血功能異常有關,并且和不同的基因、micro RNAs及蛋白的異常表達有關[14],Quirk等[15]發現10%~40%HCC在首診時已伴發PVTT。本研究結果顯示,部分或無包膜HCC并發PVTT的比例明顯高于完整假包膜HCC,與以上文獻結果相符,提示HCC完整假包膜對PVTT的形成起了抑制作用。
3.2 HCC假包膜完整性與術前轉移術差異分析 多發性肝癌分為兩類:肝內轉移(IM)和多中心起源(MO),前者是真正復發的肝癌,后者是第二原發癌。臨床通常很難區分這兩種類型,主要根據腫瘤的位置或復發時間,而影像學診斷很大程度上依據腫瘤的大小來區分IM和MO。本研究中,盡管部分及無假包膜組伴發肝內轉移發生率高于完整假包膜組,但組間差異不具有統計學意義(P=0.446)。推測MRI區分IM和MO的局限性可能會對本部分數據結果存在一定的偏差,而Furuta等[16]學者研究發現利用體細胞單核苷酸變異信息、全基因組測序能夠準確鑒別IM和MO,但有待進一步深入研究。
3.3 HCC假包膜完整性與術后復發的差異性分析 本研究顯示,完整假包膜HCC的復發率明顯低于部分或無假包膜HCC,與江旭等[17]研究結果相符。在校正腫瘤的大小和分級后,具有完整假包膜的HCC在手術切除和射頻術后的復發率更低[18]。本研究中對病理分級做了校正,但未對腫瘤大小進行校正的前提下,影像資料所得出的結論符合臨床的結果。如果影像學上存在假包膜的破裂提示腫瘤已經侵犯出病灶周圍組織,這是一個預后差的表現[19],一旦腫瘤細胞突破肝包膜將具有更強的侵襲力,與腫瘤的早期復發相關性更大[20]。對具有假包膜的HCC,放射科醫生必須仔細檢查假包膜的完整性。
3.4 HCC假包膜完整性與術后肝內轉移的差異性分析 本研究結果發現具有完整假包膜的HCC在手術和射頻術后轉移率更低。腫瘤的假包膜由內、外兩層組成[8,21],致密的假包膜內層被認為是一層物理性屏障把腫瘤細胞限制在腫瘤邊界內,假包膜內狹窄的血管則阻止腫瘤細胞通過[22],從而抑制HCC的癌細胞擴散[18]。另一方面,以前的研究[23]發現HCC包膜完整程度與HF-1α、VEGF等腫瘤血管生產相關因子的表達有關系,這同樣是一個預后不好的表現。假包膜破裂或缺乏,腫瘤細胞通過血管易侵犯病灶周圍的組織[24],使得在原發病灶切除后,病灶以外的組織容易發生轉移。本研究主要評價了術后肝內轉移,而肝外其他器官或組織的轉移,由于缺乏相應的影像學資料,統計結果偏差較大,故沒納入統計。
3.5 HCC假包膜完整性與病理分級的差異性分析 HCC假包膜跟腫瘤病理演變密切相關,故通過評估其假包膜完整性可間接預測肝癌的病理變化。朱西琪等[5]研究發現假包膜組病理ES分級高于無假包膜組。本研究中發現,盡管隨著肝癌病理分型降低,HCC假包膜的完整率有降低趨勢,但三組之間差異不具有統計學意義,提示依據ES病理分級,假包膜完整性尚不能作為判斷HCC惡性程度的預測指標。故推測其結果不一致的原因在于研究對象不同,前者研究對象是直徑小于3cm的小肝癌,而本研究并未限制腫瘤的大小。
本研究尚存在一定局限性:①收集的樣本量偏小,后續研究中需擴大樣本量。②已有研究證實CT或MRI所示的假包膜征象與病理檢查證實腫瘤假包膜是一致[22 ],故并未對MRI假包膜表現與術后病理學檢查進行對照研究。③通過影像學資料,難以對IM和MO進行區分,在術前肝內轉移率的統計上有一定偏差,這部分可以在后續應用基因測序進行深入研究。④由于術后肝外轉移的影像資料數據量太小,故沒做相應的差異性分析。
4 結論
本回顧性研究發現部分及無假包膜HCC伴發PVTT形成、術后復發、術后肝內轉移的發生率顯著高于具有完整假包膜HCC,通過首次增強MRI圖像能初步預測部分或無假包膜HCC預后不好。因此,在診斷HCC時,放射科醫生應進一步關注其假包膜的完整性,這對HCC患者的治療方案選擇和預后判斷起到一定的指導作用。

