功能性超聲心動圖參數在新生兒膿毒癥休克中的臨床應用價值
鐘雋鐫 莫鏡 帥春 王越 張靜 馬冬菊 林穎儀 葉秀楨
(廣東省婦幼保健院新生兒科/廣東省新生兒重癥醫學專業質量控制中心,廣東廣州 510000)
2019年聯合國兒童基金會的數據顯示,全球5歲以下兒童死亡中,46%的死亡發生在新生兒期[1]。膿毒癥休克是新生兒感染性疾病死亡的主要原因,特別是難治性膿毒癥休克,病死率高達80%[2]。膿毒癥休克的良好預后強烈依賴于早期識別與及時精準干預,故早期甄別可能發生難治性膿毒癥休克病例,對提高救治成功率有著重要意義。
已有研究結果發現,高乳酸血癥、代謝性酸中毒、低蛋白血癥、血管活性藥物評分高與膿毒癥休克的不良預后相關,但其早期預測價值不高[3-6]。一項早產兒膿毒癥休克研究[7]發現,休克早期的功能性超聲心動圖參數與不良預后相關。2020年歐洲兒科和新生兒重癥監護協會發布的危重新生兒和兒童重癥超聲國際循證指南強烈建議使用功能性超聲心動圖獲得血流動力學參數,以指導臨床決策[8]。目前對于新生兒膿毒癥休克血流動力學參數研究較少。國內的研究主要是使用超聲心輸出量監測儀(ultrasonic cardiac output monitor,USCOM)監測血流動力學參數,以指導治療。但最近研究結果顯示,USCOM與超聲心動圖所測得的心輸出量(cardiac output,CO)存在較大的偏差,尤其是CO較高時及檢查對象是先天性心臟病術后的患兒時[9-10]。本研究是國內首次探討新生兒膿毒癥休克早期功能性超聲心動圖參數的臨床應用價值,并發現平均動脈壓與心臟指數比值(mean arterial pressure to cardiac index ratio,MAP/CI)可作為一種快速評估新生兒外周血管阻力(systemic vascular resistance,SVR)的參數,為新生兒膿毒癥休克的臨床治療提供客觀依據。
1 資料與方法
1.1 研究對象
回 顧 性 納入2019年1月1日—2020年11月30日廣東省婦幼保健院新生兒科收治的膿毒癥休克新生兒。納入標準:符合新生兒膿毒癥休克診斷標準[11-12],即為由嚴重感染導致的心血管功能障礙。排除標準:(1)除卵圓孔未閉與無血流動力學意義的動脈導管未閉外的先天性心臟病患兒;(2)存在致殘性先天性畸形或懷疑先天性遺傳代謝性疾病的患兒;(3)缺少功能性超聲心動圖參數的患兒。
符合納入標準的膿毒癥休克新生兒共154例,排除82例(有血流動力學意義的動脈導管未閉12例,先天性畸形4例,懷疑遺傳代謝性疾病或染色體病3例,缺少功能性超聲心動圖參數63例),最終共72例膿毒癥休克新生兒納入分析。根據膿毒癥休克評分的最高值(床邊膿毒癥休克評分≥2分或計算式膿毒癥休克評分≥3.5或改良計算式膿毒癥休克評分>80.5)[13-14],將患兒分為非難治性組(42例)與難治性組(30例)。本研究獲得我院倫理委員會批準(202001115)。
1.2 功能性超聲心動圖參數監測
采用帶有12 MHz探頭的M9超聲診斷儀(邁瑞醫療,深圳)在使用血管活性藥物前對納入對象進行功能性超聲心動圖參數監測。由一名接受過重癥超聲課程培訓的新生兒科醫生使用同一臺超聲診斷儀完成圖像采集和數據測量。
功能性超聲心動圖參數包括(1)速度-時間積分(velocity-time integral,VTI):于心尖五腔心切面獲得血流,將取樣容積置于左室流出道瓣下約0.5 cm處,調整入射角度與血流方向一致,采用頻譜多普勒,獲得VTI;(2)左室流出道內徑(left ventricular outflow tract diameter,LVOTd):于胸骨旁左室長軸切面,主動脈瓣環下方0.5 cm測量,即 為LVOTd;(3)每 搏輸出量(stroke volume,SV):π×(LVOTd/2)2×VTI;(4)CO:(SV×心率)/體重(kg);(5)心臟指數(cardiac index,CI):(SV×心率)/{[0.035×體重(kg)+0.1]×1 000};(6)左室射血分數(left ventricular ejection fraction,LVEF):于胸骨旁左室長軸切面,將取樣線置于二尖瓣尖與腱索之間,垂直左心室長軸,采用M超模式,獲得LVEF。
1.3 循環系統評分
循環系統評分[13-15]包括以下幾個方面。(1)血管活性藥物評分(Vaso-Inotrope Score,VIS):多巴胺劑量+多巴酚丁胺劑量+[(去甲腎上腺素劑量+腎上腺素劑量)×100]+(米力農劑量×10),血管活性藥物劑量單位均為μg/(kg·min);(2)床 邊膿毒癥休 克評分:VIS>200 μg/(kg·min)得1分,血乳酸>8 mmol/L得1分,心搏驟停或LVEF<25%或CI<2.2 L/(min·m2)得3分;(3)計算式膿毒癥休克評分:1.001VIS+1.1血乳酸+18(心搏驟停或LVEF<25%或CI<2.2 L/(min·m2),滿足一項及以上均為“1”,否則為“0”);(4)改良計算式膿毒癥休克評分:1.001×VIS+1.1×血乳酸+18×(心搏驟停或LVEF<25%或CI<2.2 L/(min·m2),滿足一項及以上均為“1”,否則為“0”);(5)新生兒休克評分:從皮膚顏色、皮膚循環、四肢溫度、股動脈搏動、收縮壓5個方面評估,每項0~2分。總分3分為輕度休克,4~6分中度休克,7~10分為重度休克。
1.4 資料收集
回顧性查閱病歷,記錄性別、胎齡、出生體重、休克發生日齡、圍生期情況、血培養結果等。記錄膿毒癥休克發病后第一次測得的患兒血pH值、血乳酸、血小板計數、C-反應蛋白與降鈣素原。記錄使用血管活性藥物前的新生兒休克評分、心率、動脈血壓與功能性超聲心動圖參數。
1.5 樣本量計算
本研究設計為診斷性試驗,查閱文獻[7]獲知CI的受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under the curve,AUC)為0.75,令α=0.05,β=0.10,組間比例1∶1,采用PASS 11軟件估算樣本量。結果顯示,至少納入52例患兒。考慮10%的失訪率,研究至少納入患兒58例。
1.6 統計學分析
采用SPSS 22.0進行統計學分析。正態分布計量資料以均數±標準差(±s)表示,組間比較采用兩樣本t檢驗;非正態分布計量資料采用中位數(四分位數間距)[M(P25,P75)]表示,組間比較采用Mann-WhitneyU檢驗;計數資料以頻數和率(%)表示,組間比較采用χ2檢驗。采用ROC曲線分析組間差異有統計學意義的功能性超聲心動圖參數對膿毒癥休克新生兒死亡的預測價值。P<0.05為差異有統計學意義。
2 結果
2.1 一般情況與實驗室檢查結果
72例膿毒癥休克患兒,休克發生日齡的中位數為2 d,其中繼發多器官功能障礙7例(10%)、彌散性血管內凝血9例(12%)、新生兒持續肺動脈高壓15例(21%)、Ⅲ級及以上腦室內出血8例(11%)、肺出血10例(14%)、難治性休克30例(42%)、休克相關死亡(休克未糾正導致的死亡)7例(10%)、28 d內全因死亡(任何病因導致的死亡)14例(19%)。難治性組休克相關死亡7例(23%),28 d內全因死亡10例(33%)。難治性組與非難治性組患兒胎齡、出生體重、性別構成、休克發生日齡和圍生期情況比較差異均無統計學意義(均P>0.05),見表1。2組患兒發生膿毒癥休克后第一次測得的血pH值、血乳酸、血小板計數、C-反應蛋白、降鈣素原、血培養結果比較差異均無統計學意義(均P>0.05),見表2。
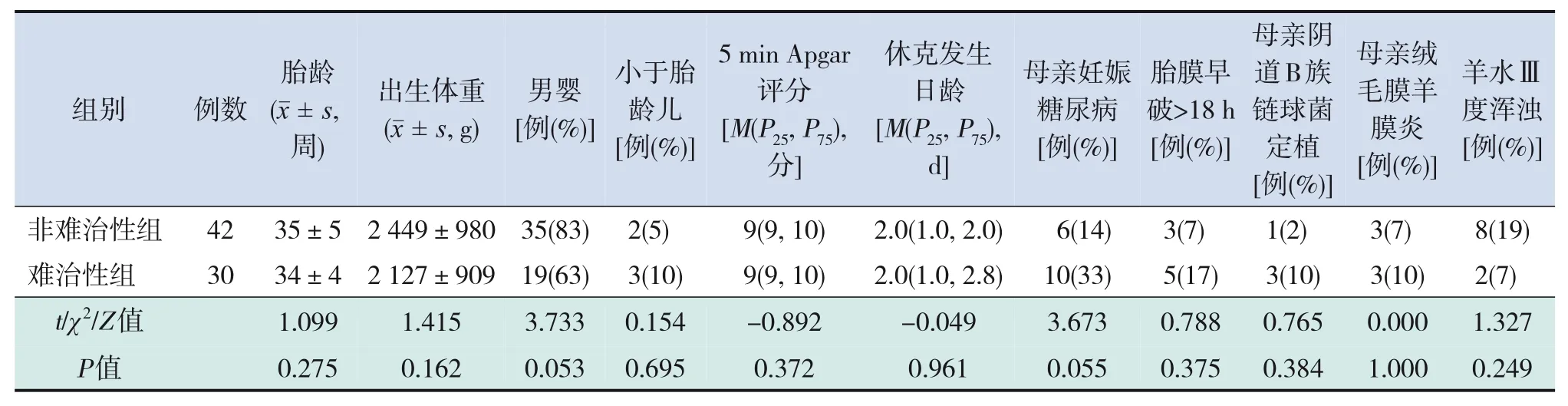
表1 2組膿毒癥休克患兒一般情況比較

表2 2組膿毒癥休克患兒發病后第一次測得的實驗室檢查結果比較
2.2 2組患兒使用血管活性藥物前循環指標比較
難治性組患兒的CO和CI低于非難治性組(P<0.05),MAP/CI高于非難治性組(P<0.05),但2組MAP、SBP、DBP、心率、SV、LVEF、MAP/CO及新生兒休克評分比較差異均無統計學意義(均P>0.05),見表3。
2.3 CO、CI和MAP/CI對膿毒癥休克新生兒死亡的預測價值
ROC曲線分析顯示,預測膿毒癥休克相關死亡AUC具有統計學意義的功能性超聲心動圖參數為CI和MAP/CI(分別P=0.006、0.031),而CO對膿毒癥休克相關死亡無預測價值(P=0.096)。CI最佳截斷值為2.6 L/(min·m2),AUC為0.841(95%CI:0.699~0.984),靈敏度為79%,特異度為83%,陽性預測值為28%,陰性預測值為96%;MAP/CI最佳截斷值為11.4,AUC為0.769(95%CI:0.550~0.987),靈敏度為83%,特異度為73%,陽性預測值為23%,陰性預測值為96%。見圖1A。
CO、MAP/CI對預測膿毒癥休克新生兒28 d內全因死亡無價值(分別P=0.691、0.613);CI對預測膿毒癥休克新生兒28 d內全因死亡有價值(P=0.015),最 佳 截 斷 值 為2.9 L/(min·m2),AUC為0.717(95%CI:0.572~0.863),靈敏度及特異度均為69%,陽性預測值為35%,陰性預測值為89%。見圖1B。
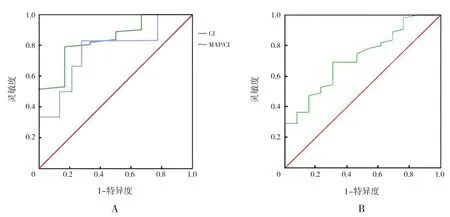
圖1 CI和MAP/CI預測膿毒癥休克新生兒死亡的受試者工作特征曲線 A:CI和MAP/CI預測膿毒癥休克相關死亡的受試者工作特征曲線;B:CI預測膿毒癥休克新生兒28 d內全因死亡的受試者工作特征曲線。
3 討論
膿毒癥休克是新生兒重癥監護病房中患兒死亡的主要原因,尤其是難治性膿毒癥休克。早期甄別與積極精準干預是提高新生兒膿毒癥休克的關鍵舉措。膿毒癥休克的病理生理學是復雜的,血壓正常并不一定能保證重要器官足夠的灌注,僅靠臨床體征和實驗室檢查不足以及時、準確地識別膿毒癥休克。經驗豐富的臨床醫生診斷為冷休克的患者有高達66%經過血流動力學監測后被發現為暖休克[16]。本研究結果顯示,在使用血管活性藥物前,兩組患兒的新生兒休克評分、血壓及心率無明顯差異,與既往成人研究[17]結果相似。
近十年,成人與兒童的研究結果已證實全面和連續的血流動力學評估,可闡明休克的病理生理學機制,有助于選擇最適合病情的藥物,并監測治療反應[18-19]。因此,確定一系列的血流動力學參數對于更好地預測臨床結果及制定出更恰當的治療方案至關重要。本研究發現膿毒癥休克新生兒使用血管活性藥物前的低CO、低CI、高MAP/CI與難治性膿毒癥休克發生相關,且CI與MAP/CI對膿毒癥休克相關死亡具有一定的預測價值。Zhong等[7]研究發現,早期CI<2.9 L/(min·m2)的膿毒癥休克早產兒是發生不良預后的高危人群,但該研究并未對MAP/CI進行評價。最新兒童、新生兒膿毒癥休克血流動力學支持臨床實踐指南[12]推薦的CI目標值為3.3~6.0 L/(min·m2)。本研究結果顯示,與非難治性組患兒相比,難治性組患兒早期表現出更低的CO、CI及更高的SVR,這與既往研究[20]結果相反。低排高阻的血流動力學狀態將進一步加重心肌功能障礙和重要器官灌注受損[21],這可能是導致難治性休克發生的主要原因。歐洲兒科和新生兒重癥監護協會將CI<2.2 L/(min·m2)作為兒童難治性膿毒癥休克評價指標之一[13],由此證明低CI與難治性膿毒癥休克發生及不良預后相關。本研究同樣發現休克早期低CI對休克相關死亡、28 d內全因死亡具有良好的預測能力。
SVR降低是膿毒癥休克低血壓和組織灌注不足的主要機制之一。研究發現,液體復蘇無法逆轉由嚴重SVR降低引起的低血壓,相反,不必要的液體復蘇會引起更大的死亡風險[22]。因此,SVR的評估有助于早期啟動血管活性藥物,避免不必要的液體復蘇,同時迅速恢復組織灌注。在新生兒人群中,特別是早產兒與低出生體重兒,由于有創循環監測要求進行中心靜脈及動脈置管,這限制了其在新生兒中的廣泛應用。目前功能性超聲心動圖可安全、準確地評估前負荷與心肌收縮力,卻無法直接評價SVR。臨床上,MAP/CO常被用于評價SVR,但目前并未發現其與休克新生兒的不良預后有關[23]。本研究也未發現MAP/CO在兩組患兒中存在差異。但本研究結果顯示,難治性組患兒的MAP/CI明顯高于非難治性組,且MAP/CI>11.4時可預測休克相關死亡,具有較高的靈敏度(83%)、特異度(73%)及陰性預測值(96%)。MAP/CI較MAP/CO更能反映新生兒SVR,這可能是由于新生兒身材差異大,CO是指每分鐘射出的血量,而CI是以單位體表面積計算的CO,更適用于評價不同身材個體的心功能。因此,MAP/CI可作為一種能快速評估新生兒SVR的參數。
本研究的局限性主要有:(1)該研究為回顧性研究,可能會對結果造成選擇偏倚;(2)本研究只評估了膿毒癥休克早期的功能性超聲心動圖參數作為預測因素,而沒有考慮到低CI和高MAP/CI的持續時間,可能會對本研究結果造成一定影響。
綜上,功能性超聲心動圖參數CI與MAP/CI可作為早期指標預測膿毒癥休克新生兒死亡的發生。膿毒癥休克初期CI<2.9 L/(min·m2)或MAP/CI>11.4的新生兒是發生死亡的高危人群,為新生兒膿毒癥休克的臨床治療提供客觀依據。
利益沖突聲明:所有作者均聲明不存在利益沖突。

