氧儲備指數:氧療監測的新方法
鄒蕓蘇 綜述 周曉光 審校
(南京醫科大學附屬兒童醫院新生兒醫療中心,江蘇南京 210008)
氧氣是細胞代謝不可缺少的必需物質,是生命的基礎。氧療是指提供適當濃度的氧以提高血氧 分 壓(oxygen tension,PO2)和血氧飽和度(pulse oxygen saturation,SpO2)來保證組織供氧,是重癥監護病房(intensive care unit,ICU)常見且重要的治療方法[1]。氧合狀態根據動脈血氧分壓(arterial oxygen tension,PaO2)水平可分為低氧(0~80 mmHg)、常氧(81~100 mmHg)和高氧(>100 mmHg)[2]。低氧是有害的,機體缺氧時發生呼吸性和代謝性酸中毒,若不及時干預會造成各臟器功能損傷,進而發展為呼吸衰竭、循環衰竭、休克乃至死亡。ICU中大多數患者需要高濃度氧來維持足夠的PaO2。當氧氣用于治療時,就必須被視為一種“藥物”,過多的氧氣會引起高氧血癥。當吸入高濃度氧或人工輔助通氣時吸氣壓力或潮氣量過大,氧大量透過肺泡壁進入靜脈血,使PO2明顯提高,出現高氧血癥,引發氧化應激反應和炎癥反應,產生大量氧自由基,引起一系列組織細胞的損傷,甚至變性壞死,導致功能障礙甚至功能衰竭,最終死亡[3]。研究表明,在常規氧療過程中,15%~50%重癥患者因過度氧療出現高氧血癥。高氧血癥會給重癥患者帶來危害[4]。荷蘭一項對50個ICU的36 000多例重癥患者的研究發現,PaO2與疾病病死率呈U型關系,PaO2在113~150 mmHg之間平均病死率最低[5]。因此,氧療需要界定安全范圍,并進行實時臨床監測。
因此,氧氣并不是絕對有益而無害的,必須精確控制氧氣濃度,并監測PaO2以避免低氧血癥和高氧血癥的發生。臨床上最常用的是脈搏血氧儀,可以無創、實時、連續監測動脈血氧飽和度(arterial oxygen saturation,SaO2),其工作原理是根據傳感器放置部位的搏動性血管中血紅蛋白光吸收值計算SaO2,搏動性血管包括動脈、毛細血管和小靜脈[6]。氧解離曲線為S型,反映了PaO2和SaO2的關系,當PaO2達到80 mmHg或以上時SaO2為100%,若PaO2持續上升,SaO2仍為100%。因此,脈搏血氧儀的限制性在于當SaO2≥97%時不能準確評估PO2,不能發現高氧血癥,在臨床上僅反映低氧和常氧狀態[7]。
目前評估機體氧合狀態的金標準是血氣分析(blood gas analysis,BGA)中的PaO2,其數值是沒有范圍限制的,可反映低氧、常氧和高氧狀態。BGA是一項有創、間斷監測(目前已有連續監測的BGA,未普及)、結果有延遲、費用相對高的技術[8]。每次BGA反映的是即時機體氧合狀態,一般不能連續監測。在臨床上若多次動脈穿刺不僅增加患者痛苦,加重經濟負擔,還可能引起局部感染加重病情。本文就目前一項新型反映PaO2的指標——氧儲備指數(oxygen reserve index,ORI)作一綜述,闡述ORI的原理、在氧療中的應用、不足之處及應用展望,旨在提高臨床醫務人員對該項技術的認識及合理應用ORI以評估患者的氧合狀態。
1 ORI
ORI是一種新型的可實時、無創、連續監測氧合狀態的無量綱參數,數值為0~1,反映的PaO2范圍是100~200 mmHg。該技術最早于2014年美國麻醉醫師協會年會報道,由美國Masimo公司研發[9]。通過多波長脈搏血氧儀分析SaO2達到100%后混合靜脈氧飽和度(venous oxygen saturation,SvO2)的信號變化得到ORI數值。PaO2在100 mmHg左右時ORI數值為0,隨著氧氣的持續吸入,SaO2上升至100%,PaO2逐漸增高,SvO2也會隨之增高直至平穩(80%),此時的PaO2達到200 mmHg左右而ORI數值為1。因此ORI數值可以敏感地反映PaO2在100~200 mmHg的變化[9-11]。氧合血紅蛋白解離圖和ORI敏感范圍見圖1,具體ORI的測量原理和計算方程見參考文獻[9]的附錄部分。ORI與臨床常用的脈搏血氧儀和血氣分析的特點比較見表1。
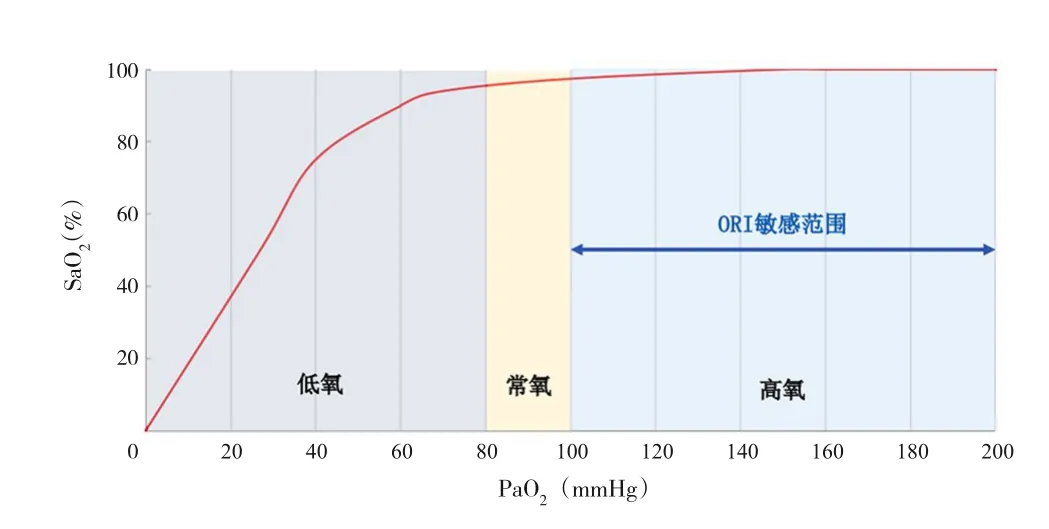
圖1 氧合血紅蛋白解離圖和ORI敏感范圍[11]
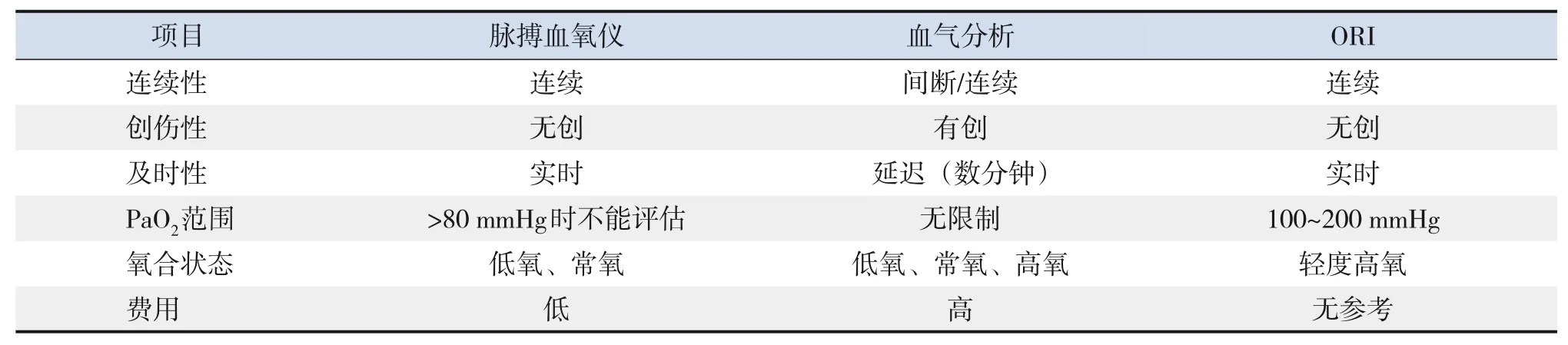
表1 脈搏血氧儀、血氣分析和ORI特點比較
ORI作為一項新型參數,目前相關研究使用的都是美國Masimo公司的多波長脈搏血氧儀。理論上來說ORI在PaO2200 mmHg左右時達到1的平臺期[9],但有研究指出,當吸入氣氧濃度(fraction of inspiration oxygen,FiO2)為1時,每個個體的ORI峰值不同,多在0.60左右達到穩定水平[11]。Applegate等[12]分析了手術過程中ORI和PaO2的關系發現,如果PaO2≤240 mmHg,ORI和PaO2呈正相關(r2=0.536);如果PaO2>240 mmHg,則無相關性(r2=0.002)。此外,當ORI>0.24時,100%的樣本PaO2>100 mmHg;當ORI>0.55時,96.6%的樣本PaO2≥150 mmHg。Vos等[13]使用2個獨立ORI感應器的多波長脈搏血氧儀(分別置于左手的第二和第四手指),研究20名健康志愿者的吸氧過程,發現在ORI敏感范圍內,PaO2和ORI具有很強的正相關性(第二手指:r=0.78,P<0.001;第四手指:r=0.83,P<0.001),PaO2和ORI趨勢的一致率是94%。Yoshida等[14]研 究 表 明 在 麻 醉 期 間 當PaO2<240 mmHg(n=69)時,線性回歸分析顯示PaO2與ORI存在較強的正相關性(r2=0.706)。
2 ORI在氧療中應用
2.1 低氧血癥的早期預警
氧療是臨床上常見且重要的治療,用以防止或治療低氧血癥,減少缺氧引起的損傷。目前臨床上大多數使用脈搏血氧儀監測SpO2以發現低氧血癥,但其診斷依賴BGA。在氧解離曲線中,PaO2和SaO2之間的關系不是線性的。當PaO2>80 mmHg時,SaO2會大 于95%。一旦PaO2下 降70 mmHg以下,SaO2將迅速下降,這種生理現象被稱為“滑坡”。“滑坡”的突然發生對于毫無準備的臨床醫生來說無疑是一個巨大的挑戰[2,15]。
美國得克薩斯大學西南分校和兒童醫學中心的研究人員在對氣管插管后接受全身麻醉兒童(n=25)的初步研究中發現,相比于脈搏血氧儀,ORI可提前31.5(19.0,34.3)s識別即將出現的SpO2明顯下降[9]。日本福島醫科大學的一項研究,在16名氣管插管前接受快速全身麻醉誘導的成人,ORI可以在SpO2下降前約30 s預測到缺氧狀態[16]。Vos等[13]對健康志愿者進行研究,在202組數據中,當PaO2<100 mmHg時,99%的ORI值為0,而5%的SpO2為93%;ORI預測PaO2<100 mmHg的受試者工作特征曲線的曲線下面積是0.91(95%CI:0.89~0.92),靈敏度為99%,特異度為82%,表明ORI的下降早在SpO2的變化之前就已發生,提示ORI可以用于預測低氧血癥的發生。2018年日本另一項研究發現,從單肺通氣開始計時,ORI出現下降的時間明顯早于SpO2下降的時間[17]。2019年西班牙麻醉醫生的研究同樣認為,ORI可以預測單肺通氣期間低氧血癥的發生[18]。一些病例報道也支持ORI對臨床中SpO2下降的早期警報作用[19-20],其中印度報道了1例醫生意外通過ORI發現氧氣供應停止的病例[20]。總的來說,這些研究包括全身麻醉和清醒狀態、雙肺和單肺通氣、成人和兒童。因此,與傳統的脈搏血氧儀相比,ORI可提前30 s左右監測到“滑坡”現象,臨床醫生可及早采取措施,以避免發生低氧血癥。在SpO2正常的情況下,ORI急劇下降應該引起醫生的重視和警惕。
2.2 高氧血癥的預防
氧療是ICU普遍用于挽救危重患者生命的治療措施,常使用高濃度氧來維持足夠的PaO2[10]。麻醉師或普通病房醫生常擔心患者出現低氧血癥,也會使用高濃度氧氣,可能會對一些不需要氧氣的患者進行氧療,或給低氧患者不適當的高濃度氧氣[2,21]。目前越來越多研究顯示了高氧血癥的危害,如循環系統中,高氧血癥會使全身血管收縮,心輸出量和冠狀動脈血流量減少,可能導致心肌梗死;神經系統中則可能出現腦血流量減少,呼吸系統中可能出現肺不張和肺內分流發生率增加等[22-24]。有研究表明重癥患者的病死率增加與高氧血癥顯著相關[25-26]。由于不同人群的氧合標準不一,目前暫無高氧血癥的明確定義,但大部分學者將高氧血癥分為:輕度高氧血癥(PaO2:101~200 mmHg)和重度高氧血癥(PaO2>200 mmHg)[2,15]。然而,高氧并不總是有害的,研究表明,輕度高氧血癥是相對安全的,PaO2在110~160 mmHg內的患者院內病死率最低[27]。
因此,臨床醫生需要更精確的氧療以避免低氧血癥和高氧血癥引起的危害。脈搏血氧儀監測的SpO2范圍為0%~100%但不能準確反映PaO2數值,而ORI監測的PaO2范圍為100~200 mmHg,這2種方法都是無創、連續和實時的。如果將兩者結合使用,可以更準確地監測患者實時氧合狀態。ICU、手術室或普通病房的臨床醫生就可以更準確地評估患者的氧合狀態,適時調整FiO2以控制PaO2范圍,而無需反復行BGA檢驗。印度報道的1例氣管食管瘺的新生兒,手術過程中將FiO2調整在0.4~0.5以保持ORI在0~0.3,且SpO2≥97%,既避免過多氧氣吸入也保證了邊緣氧氣儲備,成功證明ORI的臨床價值[28]。Yoshida等[14]研究也驗證了在全身麻醉過程中通過ORI可避免重度高氧血癥的發生。
2.3 預充氧的評估
預充氧是麻醉醫生在全身麻醉誘導和氣管插管前的通用程序,增加患者的氧氣儲備以延長呼吸暫停時安全氧合狀態的持續時間[29]。在預充氧過程中,僅使用脈搏血氧儀作為監測工具,麻醉醫生不能保證患者的PaO2>100 mmHg或肺內氧氣會像預期地持續增加。特別是在肥胖或危重患者中,常用方法如潮式呼吸3 min、30 s內深呼吸4次或60 s內深呼吸8次可能無法實現高質量預氧合[30]。ORI可幫助我們識別不成功的預氧合。如前所述,ORI>0.24表明PaO2≥100 mmHg,ORI>0.55多表明PaO2≥150 mmHg。預氧合過程中,如果ORI沒有呈現上升趨勢或保持對應的數值,即使SaO2已達到100%,也需要進一步的干預,如正壓通氣、持續氣道正壓通氣、呼氣末正壓通氣等[31]。因此理論上來說,麻醉醫生通過使用ORI可以接近個體化的呼吸管理,但遺憾的是目前還沒有相關臨床研究。
2.4 ORI在新生兒中的應用
氧療作為呼吸支持的一部分,是新生兒病房最普遍的治療手段。氧療的目標是使組織得到充足的氧氣而又不會產生氧毒性和氧化應激反應。新生兒作為一類特殊群體,不論足月兒還是早產兒,高氧血癥都會引起腦血流波動,從而導致腦白質損傷和生發基質出血。對于早產兒來說,胎齡越小,視網膜血管發育越不成熟,高濃度氧氣吸入或氧濃度波動過大時,易刺激新生血管形成,發展為早產兒視網膜病的概率越高,而早產兒視網膜病是世界范圍內兒童致盲的重要原因。此外,高濃度氧在體內產生大量高活性氧代謝產物,這是支氣管發育不良(bronchopulmonary dysplasia,BPD)發展過程中的關鍵性炎癥介質。因此胎齡越小、氧療時間越長,BPD發生率越高,而BPD是嬰幼兒慢性呼吸系統疾病的主要病因。
與成人和兒童不同,新生兒在接受呼吸治療時的PaO2目標值通常處于輕度低氧血癥狀態,如足月兒為50~80 mmHg,早產兒50~70 mmHg,氧療時相對更容易出現高氧血癥。目前國內外臨床上用于監測新生兒氧合狀態的是脈搏血氧儀,因此越來越多研究者提出目標SpO2范圍(SpO2target range)的設定。Askie等[32]對5項隨機臨床研究的受試者數據進行Meta分析,將極早早產兒(胎齡<28周)按照目標SpO2范圍分為低值組(85%~89%)和高值組(91%~95%),結果發現低值組早產兒視網膜病的發生率降低,但病死率和新生兒壞死性小腸結腸炎發生率增高。因此強調采用低氧飽和度策略作為新生兒預防早產兒視網膜病時,隨之而來的病死率和低氧血癥并發癥也需要關注。目前,指南大多數對于近足月兒的SpO2報警上限設置較高,故臨床上出現高氧血癥的風險較高,僅依靠脈搏血氧儀的SpO2不能精準發現高氧血癥[33]。
作為金標準的BGA可反映機體即時的氧合狀態,但對新生兒來說,血管穿刺時啼哭會引起過度通氣,影響PaO2的準確性,而血管穿刺引起的疼痛刺激和頻繁多次穿刺導致的失血更是弊大于利[7-8]。Bachman等[34]在新生兒重癥監護病房基于新生兒不同胎齡和氧合狀態來分析脈搏血氧儀的警報和目標SpO2范圍的觀察性研究中,設定PaO2≥100 mmHg為嚴重高氧血癥,當目標SpO2范圍上限為98%時,糾正胎齡<33周、33~36周和>36周新生兒的PaO2出現嚴重高氧血癥的風險分別為25%、34%和42%;當目標SpO2范圍上限為95%時,糾正胎齡<33周、33~36周和>36周新生兒的PaO2出現嚴重高氧血癥的風險分別為7%、10%和14%,也證明了不能僅依靠設定目標SpO2范圍來避免高氧血癥。
另外,新生兒重癥監護病房中經常遇到新生兒頻繁發紺、呼吸暫停、周期樣呼吸等,會采取給氧、調高FiO2甚至氣管插管等措施。在搶救過程中一般都是依靠脈搏血氧儀的SpO2數值和觀察新生兒膚色、末梢循環等體征來判斷措施是否有效,不能實時、準確地判斷PaO2,可能存在低氧血癥和高氧血癥的交替。Travers等[33]研究表明,新生兒無創或有創呼吸支持治療時、氣管插管時、早產兒呼吸暫停、周期樣呼吸等均會引起PaO2波動,從而引起局部血流波動造成組織損傷。
ORI敏感范圍是PaO2為100~200 mmHg,而新生兒低氧血癥是PaO2<50 mmHg,故ORI不能準確反映新生兒低氧血癥。但相對傳統的脈搏血氧儀,ORI可提前30 s左右檢測到“滑坡”現象,在SpO2正常情況下,ORI下降警示可能發生低氧血癥,臨床醫務人員可盡快采取干預措施。如果將ORI和脈搏血氧儀聯合應用,當SpO2正常范圍時,ORI出現數值的上升或下降,可以提醒醫生及時下調或上調FiO2,避免過度氧療并最大程度減少SpO2波動,在維持新生兒目標血氣值同時,避免發生高氧血癥或低氧血癥。當然這需要新生兒專科醫生開展相關臨床研究來驗證。
3 ORI的不足之處
ORI是一種多波長傳感器,通過無創、連續測量血紅蛋白而計算出ORI值[2,6,9,11]。這種傳感器易受到光線影響,因此使用時必須阻擋任何外部光線,特別是新生兒病房在藍光治療時應注意,監測時可暫時關閉藍光治療。另外如果患者身體扭動或血流灌注率非常低時不易顯示[15]。此外,如果患者使用色素藥物,如可靛胭脂、吲哚菁綠等有可能對ORI值產生影響[35-36]。ORI反映PaO2的范圍相對較窄,臨床用于監測氧合狀態時應結合脈搏血氧儀,才能更加合理、準確地監測氧療。
4 ORI的應用展望
ORI作為氧療時的一項新型監測參數,已被美國、日本、歐洲等麻醉醫生應用于患者手術期、圍手術期氧合狀態的評估。對于ICU和普通病房的氧療患者亦同樣適用,特別是需要調整FiO2、調整吸氧方式、吸痰時均可監測氧合狀態,減少低氧血癥和高氧血癥發生。2019年底以來新型冠狀病毒肺炎已成為全球流行病,使用ORI可代替大部分BGA,不僅減少醫務人員與患者血液接觸以預防感染,同時降低醫療費用,減輕患者和社會經濟負擔。因此ORI作為一項無創、實時監測參數,適用于各種臨床情況,更多相關專業醫務人員應掌握這項參數,合理應用以監測患者的氧合狀態。
利益沖突聲明:所有作者均聲明不存在利益沖突關系。

