食管腫瘤厚度聯合中性粒細胞與淋巴細胞比值在診斷術前食管癌T4分期的臨床價值
李 婷 婷
(福建醫科大學附屬第二醫院 腫瘤放射治療科 泉州 362000)
食管癌發病率高,預后較差。相較于歐美國家,我國食管癌病理類型以鱗癌為主[1]。2017年國際抗癌聯盟-美國癌癥聯合會UICC-AJCC聯合發布第8版食管癌TNM分期對于食管癌T分期是基于腫瘤侵犯深度[2]。對于T4食管癌考慮為初始不可切除,故術前診斷T4分期對于治療方式選擇及預后判斷非常重要。胸部CT掃描、食管超聲鏡(EUS)是食管癌T分期常用的檢查手段[3]。EUS對于食管癌侵犯深度診斷準確率高,但該檢查具有侵入性,部分食管癌患者內鏡無法通過管腔,且需警惕穿孔風險。胸部CT檢查無創、無風險、痛苦少,但該檢查靈敏度低。NLR、PLR是與全身炎癥水平有關的指標。腫瘤患者NLR越高,腫瘤分期越晚、預后越差,可作為分期及預后預測指標[4]。因此,本研究探討術前胸部CT測量食管腫瘤厚度聯合NLR在診斷食管鱗癌患者T4分期的臨床價值,為診斷食管鱗癌術前T4分期提供參考。
1 資料與方法
1.1 一般病人資料
選取2016年1月到2017年12月在規培醫院福建省腫瘤醫院胸部外科收治的361例食管鱗癌患者,研究經單位倫理委員會批準同意,患者或家屬知情同意。性別:男性284例,女性77例;年齡:34-80歲,中位年齡57歲;病變部位:上段63例,中下段:298例;pT1、pT2、pT3、pT4期分別為40例、73例、206例、42例。pN0、pN1、pN2、pN3期分別為145例、90例、76例、50例。病理分期:I期30例,II期134例,III期197例;腫瘤分化程度:G1、G2、G3分別為58例、258例、45例;脈管癌栓侵犯情況:有:39例,無:322例。根據術后T分期,分為T1-3組及T4組。兩組一般資料比較,差異無統計學意義 (P>0.05),具有可比性。
1.2 術前外周血NLR、PLR
術前1周當日清晨,采取所有患者空腹靜脈血5ml,并進行血常規檢測,檢測血液中淋巴細胞、中性粒細胞、血小板計數。NLR為術前外周血中性粒細胞絕對值與淋巴細胞絕對值比值。PLR為術前外周血血小板絕對值與淋巴細胞絕對值比值。
1.3 CT掃描
應用東芝Asteion 螺旋CT進行檢查,患者取仰臥位,雙手抱頭。平掃及增強CT掃描范圍:顱底至第二腰椎。東芝螺旋CT掃描參數設置如下:層間距5mm;全電壓120kVp;管電流230毫安。在Sun Ultra AW 4.0工作站進行圖像重建(MPR),重建層厚為1mm。測量并記錄橫斷面圖像中食管腫瘤壁最厚區域的直徑,并定義為食管腫瘤厚度。
1.4 統計學方法
所有記錄的數據均采用SPSS22.0統計軟件進行計算。受試者操作特征曲線(ROC)檢測本研究中食管腫瘤厚度、NLR、PLR對診斷T4食管鱗癌預測價值,Spearman相關性分析指標相關性,計量資料采用 t 檢驗,單因素采用卡方檢驗,多因素分析采用二元Logistic回歸分析。顯著性檢驗采用雙側檢驗,P值小于0.05被認為有統計學意義。
2 結果
2.1 食管腫瘤厚度、NLR、PLR診斷T4食管鱗癌的靈敏度和特異度
采用ROC曲線得出CT測量食管腫瘤厚度、NLR、PLR在預測診斷食管腫瘤T4分期的最佳界值分別為:1.75cm,3.52,87.78,三者的靈敏度分別為:0.643,0.643,0.976;特異度分別為0.668,0.900,0.250;約登指數分別為0.311,0.543,0.227;AUC分別為0.704,0.811,0.685。
2.2 單因素及多因素分析
單因素分析顯示脈管癌栓、食管腫瘤厚度 、NLR 、PLR對診斷食管鱗癌T4分期影響較大差異具有統計學意義(P<0.005)。多因素分食管腫瘤厚度 、診斷T4食管鱗癌的獨立預測因子,具有統計學差異(P<0.005)。見表1。
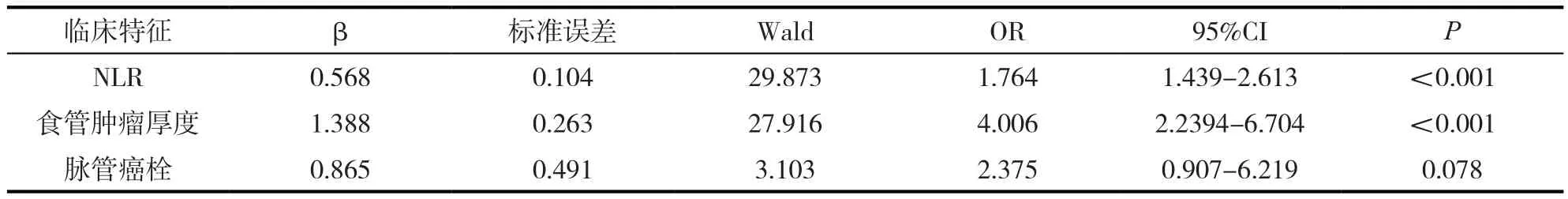
表1 診斷為T4分期的多因素分析結果
2.3 T1-3組及T4組患者食管腫瘤厚度及NLR比較
T4組食管鱗癌患者的食管腫瘤厚度、NLR較T1-3組患者高,具有統計學差異(P<0.005)。見表2。
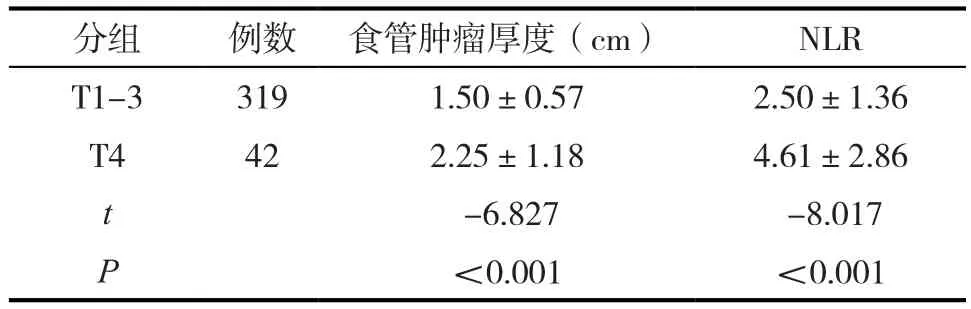
表2 361例患者不同T分期分組食管腫瘤厚度值、NLR比較
2.4 食管腫瘤厚度、NLR與T分期的相關性分析
食管腫瘤厚度、NLR與食管癌T分期呈正相關,具有統計學差異(P<0.005)。
2.5 食管腫瘤厚度、NLR對T4食管癌的預測價值
食管腫瘤厚度及NLR聯合檢測預測T4期食管鱗癌的AUC為0.873,診斷效能較食管腫瘤厚度及NLR單獨檢測T4期食管鱗癌高,差異具有統計學意義 (P<0.005)。見表3。
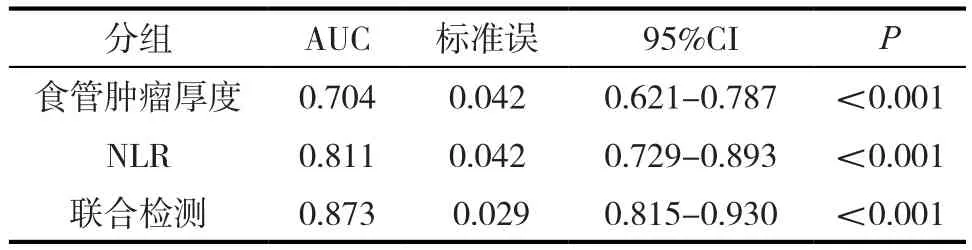
表3 食管腫瘤厚度、NLR對診斷T4分期的預測價值
3 討論
食管癌發病率高,近年來隨著手術、化療、放療、免疫治療的不斷進展,患者生存稍有提高,但預后仍較差,5年總生存僅維持30%左右[5]。對于早期食管癌,手術是首選治療方式。對于局部晚期的食管癌,主要采取手術及化放療聯合的綜合治療。故術前準確臨床分期對于食管癌診療方案選擇非常重要[6]。
參照第8版食管癌NCCN指南,T分期主要參考腫瘤侵犯深度。對于術前T分期,目前常用的檢查方法有胸部CT以及EUS檢查。龐雄等[7]對比EUS、CT對于食管癌病理分期研究發現,EUS與CT對于食管T分期準確度分別為71.74%、75%; EUS和CT應該聯合應用于食管鱗癌的分期。但EUS檢查主觀性強,穿透性差,尤其對于食管病灶范圍較廣過度狹窄,無法行內鏡檢查時存在較多局限性,且具有潛在穿孔風險,對于局部晚期食管癌的診斷存在較大的困難。
20 世紀 70 年代CT 逐漸應用于臨床,使食管癌分期有了新的診斷依據標準。1981 年,Moss 首先提出以CT 所測食管壁厚作為分期標準。隨后提出了具體的食管腫瘤厚度標準,以5mm,10mm,15mm為界及有無侵犯周圍組織將T分期分為4期。而我國2009 年提出了非手術食管癌臨床分期標準草案[8],分期草案依據腫瘤鋇透長度、CT顯示食管壁厚以及有無外侵進行T分期分級。大多數研究[9]表明CT測量食管腫瘤厚度對診斷T4食管鱗癌的預測準確率僅波動于66.27-75%之間,食管周圍解剖結構的受侵診斷可能進一步提高T4分期的準確性。我們的研究表明CT測量的食管腫瘤厚度對T4食管癌患者診斷的靈敏度亦較低,故在安全、方便、痛苦小的檢查基礎上提高T4食管鱗癌診斷的準確性,是臨床亟需解決的問題。
許多體內外研究表明全身炎癥反應通過增加原發腫瘤侵襲范圍,促進腫瘤遠處轉移及調整機體免疫系統,顯著影響胃癌、結直腸癌、食管癌、腎癌、乳腺患者預后。具體機制為中性粒細胞升高時,抑制淋巴細胞介導的免疫反應,引起NLR顯著升高,促進腫瘤細胞的生長及轉移[10]。腫瘤細胞在分泌相關細胞因子,促進血小板激活,引起PLR升高,聚集成瘤栓,逃逸免疫系統的監察,促進腫瘤及侵犯及轉移。本研究主要探討術前食管腫瘤厚度、NLR及兩者聯合對食管鱗癌術前T4分期的預測價值,為術前T4分期診斷提供依據。外周血抽取簡單、安全、經濟性高,可重復性高,可靠,故外周血NLR、PLR作為檢測指標,廣泛應用于癌癥患者全身炎癥反應判斷。吳風華等人[11]研究發現NLR與臨床分期呈現正相關性,NLR越高,臨床分期越晚,差值具有統計學意義。我們的研究也獲得類似結果,同時NLR預測T4食管鱗癌的ROC曲線下面積 (AUC)為0.811,亦具有較高的預測價值。考慮食管腫瘤厚度及NLR單獨用于T4食管鱗癌預測價值均有限,故本研究將食管腫瘤厚度及NLR進行聯合,結果顯示,聯合指標的AUC為0.873,較CT厚度及NLR單獨檢測T4食管癌高,具有較高的預測價值(P<0.001)。食管腫瘤厚度聯合NLR可作為T4食管鱗癌預測指標,為食管鱗癌術前T分期提供一定理論支持。本研究存在的不足之處在于研究樣本量較小。同時作為回顧性分析,選擇偏倚不可避免,后續仍需要加大樣本量或是設計前瞻性實驗進行進一步驗證。
綜上所述,食管腫瘤厚度聯合NLR可有效提高T4食管鱗癌的診斷準確性,對術前診斷食管鱗癌T4分期有較高預測價值,但仍需更大樣本量試驗進一步證實該結果。

