基于生物信息學方法篩選精原細胞瘤進展中的脂代謝關鍵基因
閆墨,劉帥兵,王楷斌,陳銘哲,楊闊
(天津醫科大學第二醫院泌尿外科,天津市泌尿外科研究所,天津 300211)
睪丸生殖細胞瘤雖然只占男性腫瘤總數的1%~2%,但是卻在15~35歲男性中有著較高的發病率,是該年齡段男性最常見的惡性實體腫瘤[1]。睪丸生殖細胞瘤可分為精原細胞瘤和非精原細胞瘤。精原細胞瘤和非精原細胞瘤分別占總病例數的60%和40%。Ⅰ期精原細胞瘤患者的5年特異性生存率可高達99.6%,且放化療對其有極佳的治療效果,但是Ⅱ期、Ⅲ期患者的總生存率則低至50%,同時伴隨著相對較大比例的復發[2-3]。
腫瘤細胞為了自身增殖和適應環境的需要,細胞內部的生物合成和代謝途徑均會發生適應性的變化[4]。脂代謝作為諸多代謝途徑的一種,在腫瘤細胞膜生物合成、細胞信號轉導、脂化反應以及細胞代謝供能等方面發揮重要作用,通常在轉變為惡性表型的腫瘤中,會發生較大的變化[5]。脂肪酸結合蛋白1(fatty acid binding protein,FABP1)分子量為14 kD,是一種可溶性蛋白,由127個氨基酸構成,主要在脂肪酸的攝取、運輸、代謝和細胞內轉運等方面發揮功能,同時在調節脂代謝以及細胞信號通路中也起到非常重要的作用。Wu等[6]發現FABP1在腎透明細胞癌中與轉化生長因子-β1(TGF-β1)、過氧化物酶體增殖物激活受體α(PPAR α)和脂蛋白脂肪酶(LPL)共表達,且可以作為重要的腎透明細胞癌腫瘤標志物;Liu等[7]發現,FABP1表達隨胃癌的進展逐漸降低,同時伴隨著不良的預后,而這種不良的預后可能與其調節胃癌發展過程中的免疫微環境的作用相關。
筆者通過分析精原細胞瘤相關表達譜數據,發現FABP1在Ⅱ期、Ⅲ期精原細胞瘤中有明顯的表達升高,這能顯著影響患者的無進展生存。另外,FABP1與脂代謝相關基因顯著相關,不同表達的樣本中的免疫浸潤也有明顯差異,這將有助于理解精原細胞瘤進展過程中FABP1的作用機制。
1 材料與方法
1.1 數據資料下載與組織標本獲取 從TCGA(The C ancer Genome Atlas,https://portal.gdc.cancer.gov/)和GTEx(Genotype-Tissue Expression Program,https://commonfund.nih.gov/gtex)下載精原細胞瘤(n=156)及睪丸正常組織(n=165)RNA-seq、臨床生存及甲基化數據,以上為剔除缺失RNA與臨床數據后最終納入分析的數量。從GSEA(Gene Set Enrichment Analysis,http://www.gsea-msigdb.org/gsea/index.jsp)獲取的代謝相關基因集分別為甘油酯代謝(GLYCEROLIPID_METABOLIC_PROCESS)、脂蛋白生物合成(LIPOPROTEIN_BIOSYNTHETIC_PROCESS)、脂蛋白代謝(LIPOPROTEIN_METABOLIC_PROCESS)、膜脂質代謝(MEMBRANE_LIPID_METABOLIC_PRO CESS)、磷脂生物合成(PHOSPHOLIPID_BIOSYN THETIC_PROCESS)以及磷脂代謝(PHOSPHOLIPID_METABOLIC_PROCESS),ISBN:0198506732。收 集病理科石蠟包埋的不同級別精原細胞瘤組織,每組3例。醫院倫理委員會(NO.KY2014K112)批準這項研究并且所有患者均簽署了知情同意書。
1.2 脂代謝相關差異基因篩選DESeq2包(v1.26.0)用來對Ⅰ期(n=80)以及Ⅱ、Ⅲ期(n=58)精原細胞瘤樣本RNA-seq數據進行差異分析,篩選標準為|log2(FC)|≥1且P.adj<0.05,同時對差異分析得到的基因用Ensembl101(http://ftp.ensembl.org/pub/release-101/gtf/homo_sapiens/)進行分子類型的注釋。將獲取的差異表達基因(DEGs)與GSEA中6組代謝相關基因集中的基因取交集,得到在精原細胞瘤進展過程中與脂代謝相關的差異表達基因(MRGs)。
1.3 免疫組織化學法檢測 按照通用型二步法免疫組化試劑盒(PV-9000)說明書中操作對FABP1(1∶500,Anti-Rabbit,Proteintech Group)進行染色。由3名經驗豐富的病理科醫師分別在相同條件下各自閱片,每張片子隨機選取5個高倍鏡視野觀察,目標細胞胞漿出現淡黃色至棕黃色為陽性染色。根據染色強度對切片進行評價:陰性或未染色(無著色);弱陽性(淺黃色);中等陽性(黃色或者黃褐色);強陽性(棕色)。
1.4 MRGs的相關性、共表達、甲基化以及免疫浸潤分析 將1.2分析得到的MRGs進行相關性分析,共表達分析及甲基化分析。GSVA包[8](v1.34.0)和estimate包[9](v1.0.13)用來分析精原細胞瘤RNA-Seq數據,評估精原細胞瘤患者TME中基質細胞比例和免疫細胞的浸潤情況。相關系數的絕對值范圍0~1,絕對值小于0.3為弱相關或不相關;絕對值介于0.3~0.5為一般相關程度;絕對值介于0.5~0.8為中等程度相關;絕對值大于0.8為強相關。
1.5 生存分析Survival包(v3.2-10)用來進行生存資料的統計分析,survminer包(v0.4.9)用于生存數據的可視化。
1.6 統計學處理R(v3.6.3)用于數據整理、統計分析與可視化。由Pearson秩和檢驗進行相關性分析。生存數據的統計方法為Cox回歸。P<0.05表示差異有統計學意義。
2 結果
2.1 DEGs與MRGs分析結果 對精原細胞瘤RNA-seq數據分析后,共注釋出56 493個基因,其中編碼mRNA 19 577個,lnRNA 14 077個,miRNA 1 448個。滿足差異基因篩選條件的mRNA編碼基因共有1 865個,其中上調基因1 462個,下調基因403個(圖1A)。去除GSEA下載的6組脂代謝相關基因集中的重復基因后獲得691個脂代謝相關基因,與DEGs取交集后共有65個MRGs,見圖1B。MRGs FABP1的log2(FC)=5.96,P.adj=1.63E-27,差異倍數與P值極為顯著;FABP1在Ⅱ/Ⅲ期精原細胞瘤中有著明顯的表達差異(P<0.001,圖1C);免疫組化結果顯示FABP1在高級別精原細胞瘤中有著更高的表達水平(圖1D)。
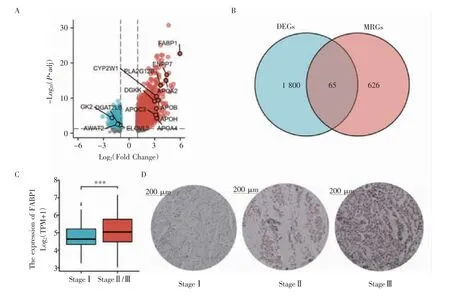
圖1 DRGs和MRGs的差異表達基因篩選Fig 1 Differential expression genes screening in DRGs and MRGs
2.2 FABP1與MRGs的相關性、共表達及甲基化分析 從MRGs中篩選出差異顯著上調基因堿性鞘磷脂酶(ENPP7)、載脂蛋白A2(APOA2)、磷脂酶A2 XII B(PLA2G12B)、載脂蛋白B(APOB)、載脂蛋白A4(APOA4)、細胞色素P450 2W1(CYP2W1)、載脂蛋白H(APOH)、載脂蛋白C3(APOC3)、二酰基甘油激酶κ(DGKK)和下調基因超長鏈脂肪酸延伸酶3(ELOVL3)、二酰基甘油O-酰基轉移酶2樣蛋白6(DGAT2L6)、二酰基甘油O-酰基轉移酶2樣蛋白4(DGAT2L4、AWAT2)、甘油激酶2(GK2),相關性分析結果顯示FABP1與各基因均有顯著的相關關系(P<0.01,圖2A)。精原細胞瘤樣本中FABP1與上調MRGs共表達分析結果按照相關性強弱進行排序,FABP1與各基因均有顯著的共表達關系(P<0.001,圖2B);除APOB和APOA4和FABP1有強相關關系外,其余各指標均與FABP1有中等相關強度;熱圖顯示在低表達FABP1的精原細胞瘤樣本中,各指標的表達低,高表達FABP1樣本中各指標的表達高,顯示出表達的一致性。下調MRGs的DNA甲 基 化 分 析 表 明 除 了GK2,ELOVL3、DGAT2L6、AWAT2在不同的甲基化探針中均存在較高程度的DNA甲基化(P<0.001,圖3)。
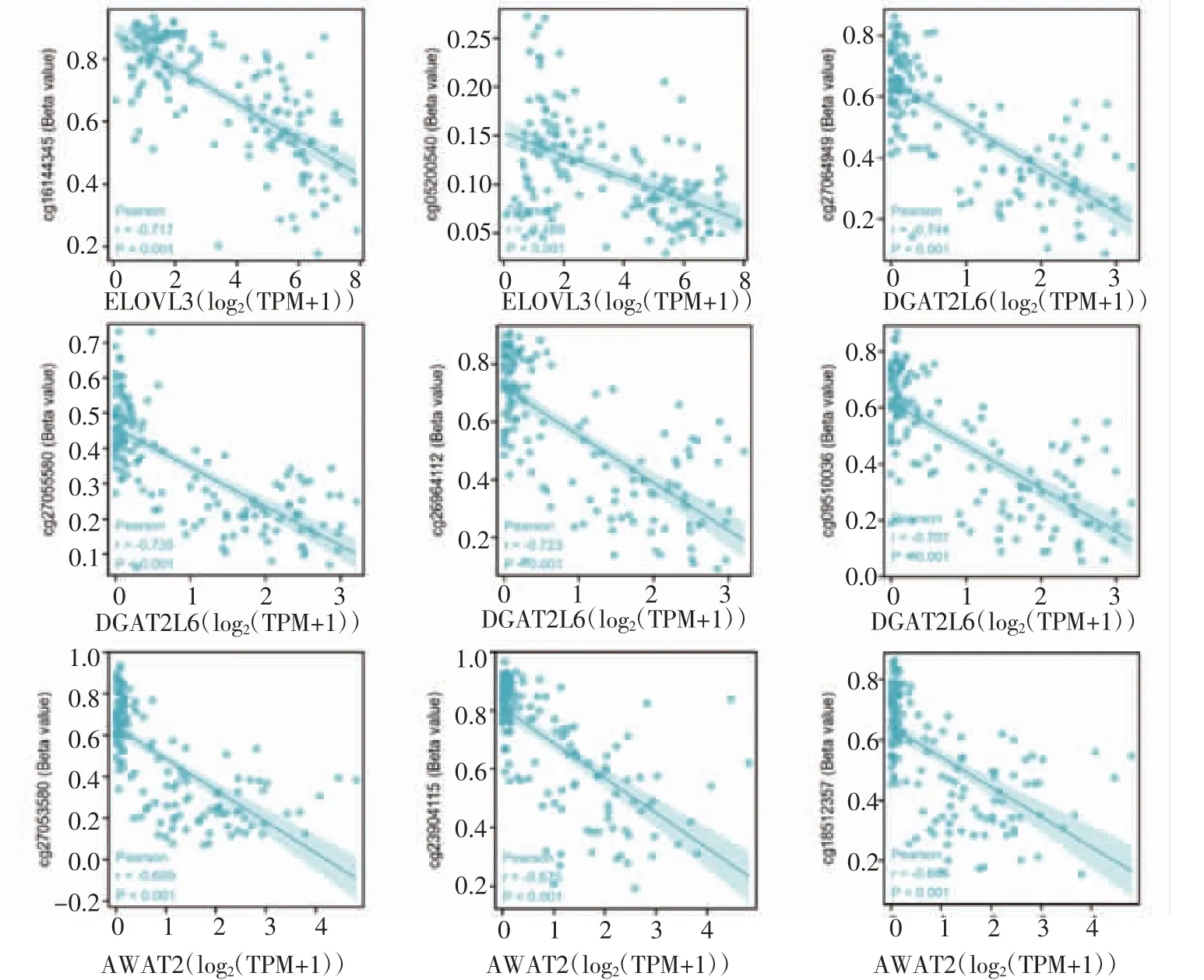
圖3 表達下調的MRGs在不同甲基化探針中的甲基化水平Fig 3 Methylation levels of down-regulated MRGs in different methylation probes
2.3 FABP1的免疫浸潤分析24種免疫細胞的免疫浸潤分析結果表明,FABP1的表達與自然殺傷(NK)細胞、NK CD56 bright細胞、肥大細胞、γδ(gamma-delta,Tgd)T細胞、未成熟樹突狀(iDC)細胞、巨噬細胞和樹突狀(DC)細胞存在顯著正相關(P<0.01,圖2C),其中與NK細胞,NK CD56 bright細胞存在中等強度以上相關;FABP1和NK CD56dim bright細胞、活化樹突狀(aDC)細胞、輔助性T細胞17(Th17)、調節性T細胞(Treg)、細胞毒性細胞、B細胞、T細胞、中央記憶型T細胞和輔助性T細胞存在顯著負相關(P<0.01,圖2C),其中與中央記憶型T細胞和輔助性T細胞的相關性強度較強。精原細胞瘤中與腫瘤微環境相關的基質細胞與免疫細胞浸潤的結果顯示高表達FABP1較低表達的腫瘤樣本,基質得分高,而免疫浸潤得分與估計得分低(圖2D)。
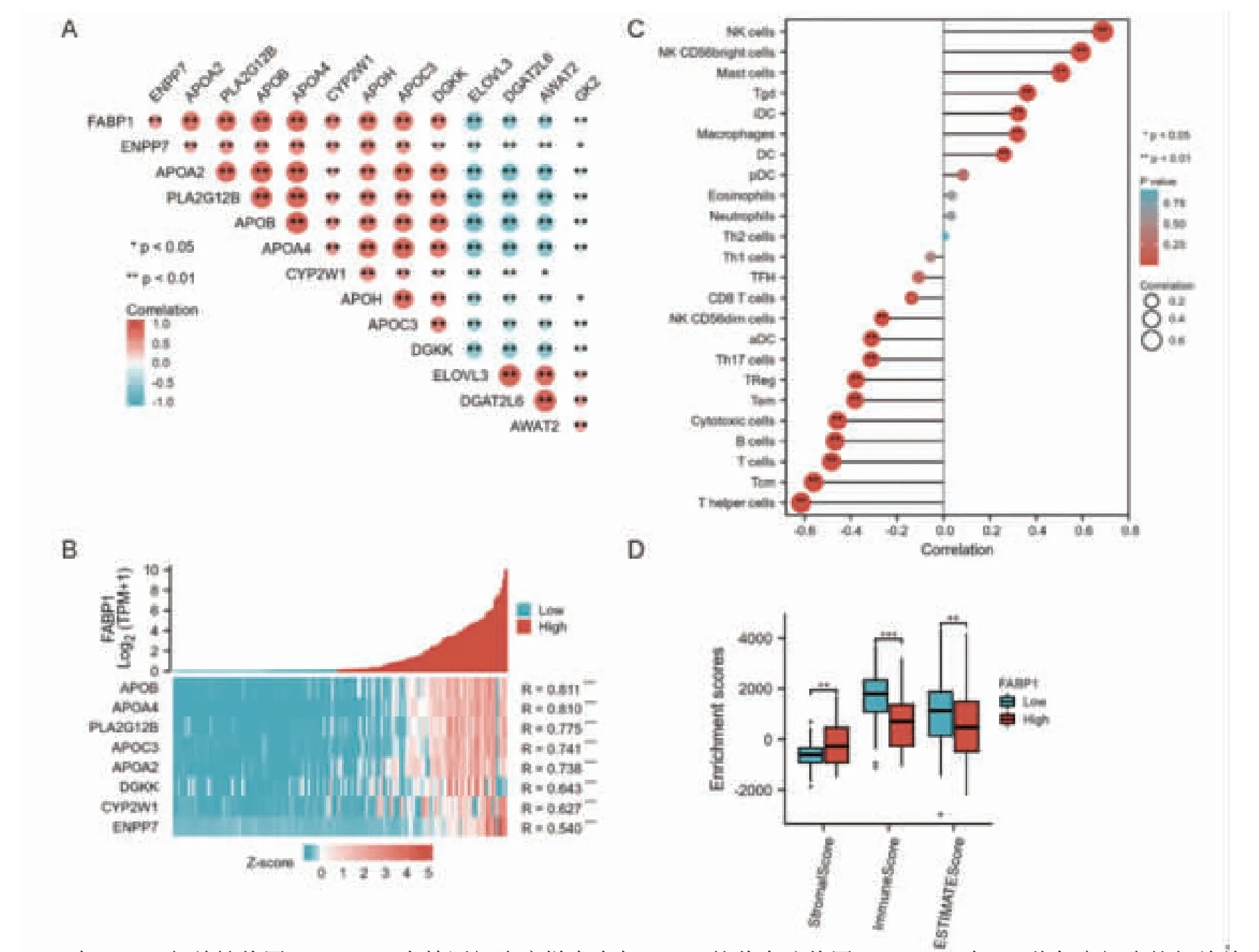
圖2 FABP1與MRGs的相關性、共表達以及免疫浸潤分析Fig 2 Correlation,co-expression and immune infiltration analysis between FABP1 and MRGs
2.4 生存分析結果 高FABP1表達患者的無進展生存期較短。FABP1共表達脂代謝基因PLA2G12B、APOB、APOA2、APOC3、APOA4和CYP2W1的 生 存 結果與FABP1一致;而在精原細胞瘤中低表達的MRGs如DGAT2L6與AWAT2則顯示相反的生存結果(P<0.01,圖4)。

圖4 FABP1與各指標高低表達組無進展生存期比較的生存曲線Fig 4 Survival curve of comparison of progression-free survival time in FABP1 and other genes high-low expression group
3 討論
睪丸生殖細胞瘤作為15~35歲年輕男性中發病率較高的實體惡性腫瘤,因其發病的特殊性,往往對該年齡段男性的正常生活造成較大影響,除導致不育外,甚至會使患者產生不良預后而死亡,精原細胞瘤作為其中重要的類型更應給予足夠的關注[10]。因為Ⅰ期精原細胞瘤患者具有極佳的生存率,所以為了在精原細胞瘤進展過程中鑒別其有無向高級別腫瘤進展的傾向,將TCGA數據庫中Ⅱ期、Ⅲ期與Ⅰ期精原細胞瘤作差異表達分析篩選出FABP1及相關脂代謝相關差異基因。同時分析了FABP1與MRGs的相關性與共表達關系,MRGs在不同甲基化探針中甲基化的情況,不同表達的FABP1與腫瘤中免疫細胞的免疫浸潤關系以及表達FABP1與MRGs患者的生存差異。筆者認為,FABP1可能通過調節腫瘤細胞與腫瘤微環境中免疫細胞的脂代謝途徑,增強腫瘤細胞的增殖與轉移能力,減弱免疫細胞對腫瘤細胞的殺傷作用,從而介導精原細胞瘤的進展。FABP1具有成為鑒別精原細胞瘤進展以及潛在治療靶點的標志物的潛力。
細胞增殖是腫瘤的共性,而腫瘤的轉移往往意味著預后不良,在此過程中,腫瘤細胞通常具有特征性的脂代謝變化,需要脂肪酸來合成細胞膜和細胞活動所需的信號分子[11-12]。Nieman等[13]發現,FABP4在卵巢癌網膜轉移灶中較原發性卵巢癌中表達增多,作為腫瘤細胞中脂質運輸的介質,在腫瘤生長和轉移過程中起到關鍵作用。FABP1在Ⅱ期、Ⅲ期精原細胞瘤中差異表達升高極為明顯,通過分析FABP1與其MRGs之間的共表達與相關關系,發現FABP1與APOB、APOA4、PLA2G12B、APOC3、APOA2、DGKK、CYP2W1、ENPP7共表達,這些基因編碼蛋白參與脂質運輸和細胞內細胞信號的傳遞;FABP1與ELOVL3、DGAT2L6、DGAT2L4、AWAT2和GK2呈負相關,對下調的MRGs進行甲基化分析,其中ELOVL3、DGAT2L6、AWAT2有較高的甲基化水平。DAGT可通過增加脂質的存儲來減少可用脂質[11]。Bagnato等[14]發現DGAT1在人成纖維細胞中過表達可降低其增殖與侵襲性;而ELOVL3則能夠參與形成脂滴、調控脂類合成以及增強脂肪細胞脂肪酸氧化能力[12]。綜上所述,FABP1可能通過與脂代謝相關基因共同作用,增強精原細胞瘤細胞對脂肪酸攝入的同時,增加可用脂質以及減少脂肪酸氧化,進而提高腫瘤細胞的增殖與遷移能力。
腫瘤免疫微環境是腫瘤細胞周圍存在的免疫細胞以及具有免疫調節功能的物質的總稱,是腫瘤微環境的重要組成部分[15]。腫瘤免疫微環境在腫瘤發生、發展中發揮重要的調節作用,如促進腫瘤細胞免疫耐受以及腫瘤免疫逃逸等[16]。在調控過程中,腫瘤細胞不是簡單地增長,而是在積極主動的調整自身,與免疫細胞相互影響,采取各種策略如限制免疫細胞獲取營養物質來使腫瘤免疫延后、改變乃至完全停止,在晚期腫瘤中,這種機制會變得尤其精妙且復雜[4,17]。同樣,免疫細胞也會發生改變來適應腫瘤發展,例如惡性腫瘤細胞和調節性T細胞可以驅動T細胞發生衰老。衰老的T細胞表現出不平衡的脂代謝。這種不平衡的脂代謝會改變脂質種類和T細胞中脂滴的積累[18]。通過生物信息學分析發現,脂代謝基因FABP1在精原細胞瘤中具有較高的差異表達,并可能通過調節脂代謝來發揮特定的作用。這一過程同樣可能發生在其腫瘤免疫微環境中。筆者首先通過ssGSEA算法評估了FABP1與24種免疫細胞的浸潤,發現在高表達FABP1樣本中存在更高比例的NK細胞及NK CD56 bright細胞浸潤;在低表達FABP1樣本中存在更高比例的輔助性T細胞與中央記憶型T細胞浸潤。接著利用estimate算法評估精原細胞瘤中各成分情況,發現高表達FABP1的腫瘤中基質成分升高,這與基質細胞能夠支持腫瘤生長是一致的;免疫浸潤及腫瘤細胞比例均降低,說明免疫微環境在精原細胞瘤不同階段中產生了較大的變化,在Ⅰ期主要以適應性免疫細胞為主,而在Ⅱ、Ⅲ期以固有免疫細胞為主,且免疫浸潤程度顯著降低,FABP1可能在這一過程中通過調節脂肪酸代謝發揮關鍵作用,高表達FABP1的腫瘤細胞與免疫細胞競爭性攝取脂肪酸,從而改變精原細胞瘤的免疫微環境。
FABP1與相關MRGs的Kaplan-Meier生存曲線差異顯著,這意味著可以通過針對相關靶點來改善患者預后,延長生存時間。綜上所述,本研究認為精原細胞瘤在進展過程中可能發生脂肪酸代謝重編程,腫瘤細胞以FABP1為代表與MRGs相互作用,通過調控腫瘤細胞的脂質運輸與細胞內轉導信號的合成來增強腫瘤的增殖與遷移能力,在此過程中,腫瘤細胞競爭性攝取脂肪酸,改變腫瘤免疫微環境,進而降低患者預后,這為理解FABP1在腫瘤進展中發揮的作用具有一定的啟發。脂代謝在精原細胞瘤細胞中的具體機制,還需要進一步實驗研究,探索FABP1作為潛在的診斷標志物與治療靶點在其中發揮的具體作用以及其與免疫調節的關系,為精原細胞瘤的發生進展提供理論依據。

