還原響應性聚氨酯三嵌段共聚物的合成及應用
彭澤林, 譚佳佳, 張國穎
(中國科學技術大學高分子科學與工程系, 中科院軟物質化學重點實驗室, 合肥 230026)
近年來癌癥發病率逐年上升,作為癌癥治療的主要手段之一,化療在臨床上廣泛應用,而利用納米載體輸運化療藥物可以有效優化常規小分子藥物的藥代動力學和藥效學行為,顯示出更好的治療效果,因此受到廣泛關注。具有良好生物惰性和生物相容性的聚乙二醇 (PEG) 是藥物載體設計中常用的聚合物,經與蛋白質、多肽、寡核苷酸、藥物和脂類等共價偶聯后,可以提高體系穩定性,延長體內循環壽命,優化藥代動力學并降低全身毒性[1-3]。迄今為止,已有超過20種聚乙二醇化蛋白和多肽獲得FDA和歐盟的批準上市。此外,基于PEG合成得到的兩親性嵌段共聚物也越來越多地通過自組裝構筑納米藥物載體,以延長藥物在體內血液中的循環時間,減少被網狀內皮系統 (RES) 的吸收,并通過增強的滲透和滯留 (EPR) 效應在腫瘤中富集[4-7]。而在另一方面,如果能在藥物載體達到腫瘤組織后實現藥物的可控釋放,則可進一步降低其對正常組織的毒性,增強治療效果。
近20年來,刺激響應性聚合物在藥物載體方面的應用研究取得了長足的進展[8-13]。其中,基于腫瘤微環境的特殊性而制備的刺激響應性聚合物納米載體備受青睞。值得注意的是,作為腫瘤發展的生物標志性物質之一,谷胱甘肽 (GSH) 在血液和其他體液中的濃度僅為2~10 μmoL/L,而在胞漿中的濃度約為1~10 mmol/L。更重要的是,與正常組織和正常細胞相比,腫瘤組織和腫瘤細胞內GSH的濃度更高。因此,含二硫鍵結構的納米藥物載體有望在靜脈注射后,在血液循環中保持其結構完整性并抑制治療藥物的釋放,但在達到腫瘤組織被腫瘤細胞攝取后,在高濃度GSH等巰基化合物作用下可發生斷鍵解離而實現藥物的可控釋放[14-17]。
另一方面,聚氨酯由于其結構和性能的可調控性及易于合成等優勢在日常生活中廣泛應用;生物相容性,尤其是生物可降解聚氨酯近年來逐漸引起人們的興趣,在生物材料領域顯示出極大的發展前景[18-22],但在藥物載體領域的研究相對較少。本文設計并合成了一類具有還原環境響應性的兩親性聚氨酯三嵌段共聚物-聚乙二醇-聚氨基甲酸酯-聚乙二醇 (PEG-PU(SS)-PEG),由該共聚物在水溶液中自組裝形成的膠束結構納米粒子可作為藥物載體在其疏水內核中負載疏水性藥物。由于聚氨基甲酸酯PU(SS) 嵌段中二硫鍵結構的存在,這些納米膠束在還原性微環境 (如GSH) 觸發下可發生解離而釋放所負載的藥物 (圖1)。

圖 1 兩親性三嵌段共聚物PEG-PU(SS)-PEG的自組裝及其還原響應性降解及藥物釋放過程示意圖Fig. 1 Schematic illustrations for the self-assembly, redox-responsive disintegration and resulted drug release of the amphiphilic PEG-PU(SS)-PEG triblock copolymer
1 實驗部分
1.1 主要原料
聚乙二醇單甲醚 (mPEG45-OH,Mn= 2.0×103,Mw/Mn= 1.06,聚合度DP = 45)、尼羅紅 (NR)、GSH、姜黃素、雙(2-羥乙基)二硫化物:阿拉丁試劑有限公司;2-硝基芐溴、咪唑、六甲基二異氰酸酯 (HDI)、對甲苯磺酸(TsOH)、碳酸鉀 (K2CO3)、二月桂酸二丁基錫 (DBTL)、硫酸鈉 (Na2SO4)、對甲苯磺酰氯 (TsCl)、甲苯、乙腈(MeCN)、二氯甲烷 (DCM)、甲醇、乙醇、石油醚 (PE)、四氫呋喃 (THF)、乙酸乙酯 (EA)、N,N-二甲基甲酰胺(DMF)、二甲基亞砜 (DMSO)、乙醚 (Et2O) :國藥試劑有限公司;無水THF、MeCN、DCM和甲苯從Pure-Solv 400溶劑處理系統中收集得到;用Milli-Q SP超純水儀 (Millipore) 對水進行去離子化,其比電阻率為18.4 MΩ·cm;其他試劑均購自國藥化學試劑有限公司。
1.2 儀器與表征
核磁共振 (NMR) 譜圖使用Bruker AVANCE III NMR 400 MHz核磁共振波譜儀測試得到,以四甲基硅烷(TMS) 為內標,以氘代二甲亞砜 (DMSO-d6) 為溶劑;聚合物的分子量和分子量分布采用配備有Water 1515泵和Water 2414 微分折射率檢測器 (溫度設置為35 ℃) 的凝膠滲透色譜儀 (GPC) 測定,該儀器以串聯的方式使用兩根Styragel色譜柱 (HR2和HR4),柱溫箱溫度為35 ℃,并以一系列窄分布的聚乙烯 (PS) 為標樣,以THF為洗脫液,流速設定為1.0 mL/min;采用動態光散射儀(DLS) 測定組裝體的流體動力學直徑和尺寸分布,在ALV/DLS/SLS-5022 F上進行,光源為圓柱形22 mW UNIPHASE He-Ne激光器 (632 nm),收集173°散射光;采用Hitachi H-80 透射電子顯微鏡 (TEM) 觀察組裝體形貌;熒光光譜采用Horiba熒光分光光度計測試得到。
1.3 PEG-PU(SS)-PEG的合成
PEG-PU(SS)-PEG的合成路線如圖2所示。氮氣氛圍下,將雙(2-羥乙基)二硫化物 (212.3 mg, 1.38 mmol)溶于無水THF中,然后加入HDI (243.9 mg, 1.45 mmol) 和 DBTL (50 μL),將溶液加熱至40 ℃,攪拌反應5 h后,再加入mPEG45-OH (420 mg, 0.21 mmol),繼續攪拌反應24 h。反應結束后將反應混合物在Et2O-DCM (體積比4∶1,下文同)混合液中進行沉淀,過濾收集沉淀后再在THF中溶解,然后再用Et2O-DCM混合液進行沉淀,上述溶解-沉淀重復3次后,將得到的沉淀在真空干燥箱中干燥24 h,得到淡黃色固體狀產物,即PEG-PU(SS)-PEG,產率81%。
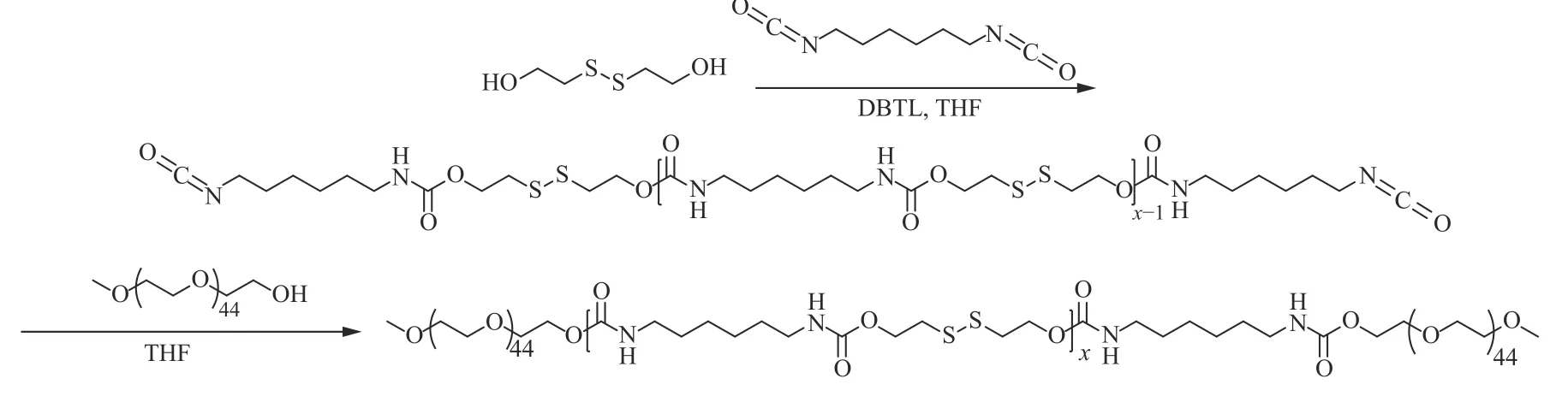
圖 2 PEG-PU(SS)-PEG三嵌段共聚物的合成路線Fig. 2 Synthetic route of PEG-PU(SS)-PEG triblock copolymer
1.4 PEG-PU(SS)-PEG的自組裝
PEG-PU(SS)-PEG納米膠束的制備:采用納米閃沉法使PEG-PU(SS)-PEG聚合物進行自組裝制備納米膠束。首先稱取10 mg PEG-PU(SS)-PEG溶于0.5 mL THF中,然后在劇烈的磁力攪拌下將溶液快速注射入9.5 mL去離子水中,再將其轉移到截留分子量 (MWCO) 為3×103的透析袋中,置于去離子水中透析6 h除去THF。
負載NR的納米膠束的制備:將NR和PEG-PU(SS)-PEG共同溶解于1 mL THF中,最終質量濃度分別為0.1 g/L和10 g/L,然后在劇烈的磁力攪拌下將溶液快速注射入9 mL去離子水中,再將其轉移到透析袋 (MWCO =3×103) 中,用去離子水中透析6 h。
負載姜黃素的納米膠束的制備:首先稱取10 mg PEG-PU(SS)-PEG和4 mg 姜黃素共同溶于1 mL THF中,然后在劇烈的磁力攪拌下將溶液快速注射入9 mL去離子水中,再將其轉移到透析袋 (MWCO = 3×103)中,置于去離子水中透析6 h。根據由不同濃度的姜黃素溶液 (DMSO-H2O混合溶劑,體積比 9∶1) 測試得到的熒光光譜所繪制的標準曲線計算相應的載藥量和載藥效率。
1.5 膠束的還原響應性解離過程跟蹤
通過GPC跟蹤檢測PEG-PU(SS)-PEG膠束在GSH觸發下由于聚合物的降解所發生的解離過程。具體操作如下:磁力攪拌 (600 r/min) 下,在50 mL PEG-PU(SS)-PEG膠束分散液 (1.0 g/L) 中加入50 mg GSH(3.25 mmol/L),在不同時刻取等量樣品,經氮氣吹掃除去溶劑后再溶解于THF中,溶液經220 nm有機濾膜過濾后進行GPC測試。
通過DLS跟蹤檢測PEG-PU(SS)-PEG膠束的還原響應性解離過程。具體操作如下:磁力攪拌 (600 r/min)下,在10 mL PEG-PU(SS)-PEG膠束分散液 (1.0 g/L) 中加入10 mg的GSH (3.25 mmol/L),在不同時刻透過450 nm濾膜分別進行DLS測試,收集173°散射光,每次測試持續5 min,連續測試3次取平均值,使用累積量分析和CONTIN程序計算組裝體的流體動力學直徑和尺寸分布。
通過熒光光譜儀跟蹤檢測負載有NR的PEG-PU(SS)-PEG膠束的還原響應性解離過程。具體操作如下:在50 mL負載有NR的PEG-PU(SS)-PEG膠束分散液 (1.0 g/L) 中加入50 mg GSH (3.25 mmol/L),在不同時刻分別進行熒光測試,激發波長設置為540 nm,發射波長設置為560~750 nm。
1.6 膠束中姜黃素的釋放
將負載有姜黃素的PEG-PU(SS)-PEG膠束分散在磷酸鹽緩沖鹽溶液(PBS) (pH=7.4,10 mmol/L) 中配制成30 mL質量濃度為1.0 g/L的分散液,在其中加入30 mg GSH (3.25 mmol/L) 再等體積分為6等份,分別在37 ℃下放置不同時間后,各取100 μL轉移至微量透析管 (MWCO = 2×103) 中,在37 ℃下浸泡在PBS 緩沖液中透析6 h。然后收集透析管外的PBS 緩沖液凍干,將得到的樣品溶解于DMSO-H2O (體積比9∶1)混合溶劑中測試其熒光光譜,根據前述測試得到的標準曲線計算姜黃素在不同時刻的累積釋放量。
2 結果與討論
2.1 PEG-PU(SS)-PEG共聚物的表征
PEG-PU(SS)-PEG的化學結構和鏈結構采用1H-NMR進行表征,結果如圖3(a)所示。譜圖中各信號峰的歸屬如下:δ(i)=7.18 (-NH-),δ(a)=3.24 (-OCH3),δ(b)=3.51 (-OCH2CH2O-),δ(c)=4.41 (-CH2OCONH-),δ(d)=2.95 (-CH2CH2NHCOO-),δ(e)=1.37 (-CH2CH2NHCOO-),δ(f)=1.22 (-NH(CH2)2CH2(CH2)2NH-),δ(g)=4.18 (-SCH2CH2OCO-),δ(h)=2.95 (-SCH2CH2OCO-),δ(DMSO)=2.50。根據1H-NMR的表征結果,以鏈末端甲基H原子數目為基準,由積分可計算出氨基H原子數目為24,因此PEG-PU(SS)-PEG分子鏈中聚氨基甲酸酯嵌段的重復單元數為11,數均分子量為8 053.63。GPC表征結果表明,其數均分子量Mn=8.20×103,與1H-NMR結果相一致;Mw=1.16×104,分散指數PDI=1.42 (圖3(b))。
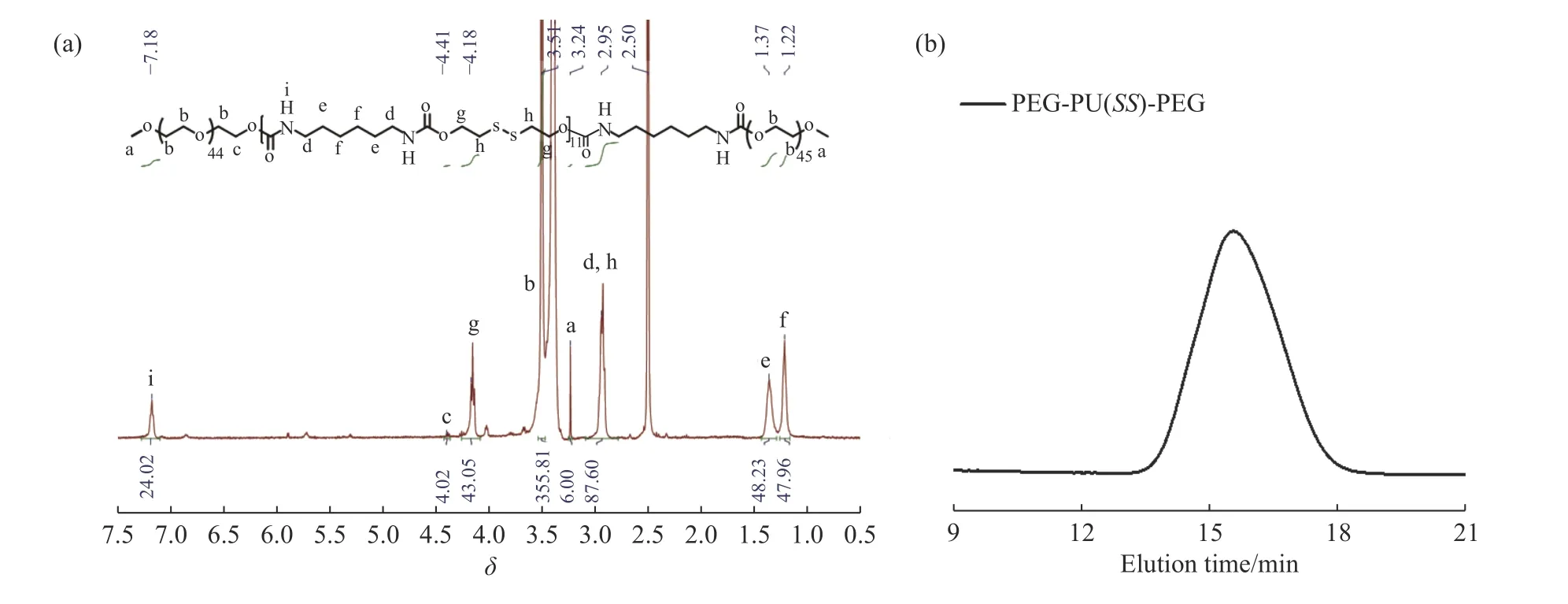
圖 3 PEG-PU(SS)-PEG三嵌段共聚物的 (a) 1H-NMR譜圖和 (b) GPC曲線Fig. 3 (a) 1H-NMR spectrum and (b) GPC curve of PEG-PU(SS)-PEG triblock copolymer
2.2 PEG-PU(SS)-PEG的自組裝及組裝體形貌
分子鏈中同時具有親水性嵌段和疏水性嵌段的兩親性嵌段共聚物在水溶液中可以經自組裝形成不同形貌的超分子組裝體。PEG-PU(SS)-PEG經閃沉法制備得到的組裝體形貌如圖4(a,b)所示,為明顯的球狀膠束粒子,平均粒徑在100 nm左右 (圖4(a)),因此有利于通過EPR效應在腫瘤組織富集。

圖 4 PEG-PU(SS)-PEG組裝體在 (a) 經GSH處理前和 (b) 加入GSH處理8 h后的TEM照片Fig. 4 TEM images obtained for PEG-PU(SS)-PEG self-assemblies (a) without GSH and (b) after being treated with GSH for 8 h
2.3 PEG-PU(SS)-PEG及其組裝體的還原環境響應性
首先,從分子水平上驗證PEG-PU(SS)-PEG的還原響應性,采用GPC跟蹤測量PEG-PU(SS)-PEG的分子量在加入GSH處理后的變化。如圖5所示,在組裝體分散液中加入GSH處理1 h后,PEGPU(SS)-PEG嵌段共聚物洗脫峰即發生明顯右移,隨處理時間延長逐漸向低分子量范圍移動;在經GSH處理6 h后,聚合物已基本完全降解,GPC曲線上17 min左右的洗脫峰對應于親水段PEG,共聚物分子鏈中的疏水段已降解成小分子物質 (圖1)。這些結果表明,由于疏水性PU(SS) 嵌段中二硫鍵結構的存在,使PEG-PU(SS)-PEG具有還原環境響應性,在GSH等巰基化合物作用下可以通過二硫鍵的斷裂觸發降解。

圖 5 mPEG45-OH和PEG-PU(SS)-PEG經GSH處理不同時間后的GPC曲線Fig. 5 GPC traces recorded for mPEG45-OH and PEG-PU(SS)-PEG after being treated with GSH for different time

圖 6 (a) PEG-PU(SS)-PEG膠束分散液的歸一化散射光強(I/I0)和<Dh>隨GSH處理時間的變化;(b) PEG-PU(SS)-PEG膠束在加入GSH前和經GSH處理6 h后的<Dh>分布Fig. 6 (a) Evolution of the normalized scattering intensity (I/I0) and <Dh>, recorded for PEG-PU(SS)-PEG micellar dispersion in the presence of GSH; (b) The hydrodynamic diameter distributions of PEG-PU(SS)-PEG micellar dispersions before and after 6 h of incubation with GSH
為了進一步探究PEG-PU(SS)-PEG的還原環境響應性,采用DLS跟蹤監測了由PEG-PU(SS)-PEG組裝形成的納米膠束分散液的散射光強和膠束尺寸在加入GSH處理不同時刻的變化,結果如圖6所示。在加入GSH之前,PEG-PU(SS)-PEG膠束的流體力學直徑(<Dh>)約為120 nm。考慮到DLS是在溶液狀態下進行測試,此結果與圖4(a) 中組裝體粒徑的TEM表征結果 (約100 nm) 基本一致。而在組裝體分散液中加入GSH之后,體系的散射光強隨處理時間的延長而逐漸下降,組裝體的<Dh>也逐漸減小,在6 h后基本達到平衡,<Dh> 減小至25 nm。這表明還原響應性的PEG-PU(SS)-PEG共聚物在經GSH觸發下發生降解后,可導致膠束逐漸發生解離。此外,膠束在GSH作用下的解離由TEM觀察結果也可以得到證明,由圖4(b) 可見,在PEG-PU(SS)-PEG組裝體分散液中加入GSH處理8 h后,在TEM照片中已基本上觀察不到膠束粒子的存在。
疏水性的熒光探針尼羅紅對環境極性極其敏感,在弱極性疏水環境中可以發出強烈熒光,而在極性較強的親水環境中的熒光強度則很弱。因此通過疏水相互作用將NR負載于膠束組裝體的疏水性內核中,利用其熒光發射性質的變化可以檢測PEG-PU(SS)-PEG納米膠束的響應性解離過程。如圖7所示,在540 nm的激發光照射下,負載有NR的PEG-PU(SS)-PEG膠束分散液在560~750 nm顯示出強烈的熒光發射,表明NR被負載于PEG-PU(SS)-PEG膠束內核而處于極性較弱的疏水性環境中。然而,當體系中加入GSH后,隨著時間的延長,膠束分散液體系的熒光發射強度逐漸下降,表明NR分子所處的微環境由疏水性逐漸轉變為親水性,這顯然是由于PEG-PU(SS)-PEG膠束組裝體在GSH作用下發生了解離,使NR從組裝體中被釋放出來進入極性水分散液中,從而導致其熒光發射強度減弱。

圖 7 負載有NR的PEG-PU(SS)-PEG組裝體分散液在加入GSH后 (a) 熒光光譜隨時間的變化以及 (b)在614 nm處的歸一化熒光強度隨時間的變化Fig. 7 (a) Evolution of the fluorescence emission spectra and (b) evolution of the normalized fluorescence intensity at 614 nm recorded for NR-loaded PEG-PU(SS)-PEG micellar dispersions upon addition of GSH
2.4 姜黃素的負載及響應性釋放
綜上所述,疏水性聚氨基甲酸酯嵌段中二硫鍵結構的存在,賦予了PEG-PU(SS)-PEG兩親性三嵌段共聚物對還原性環境的響應性,由其自組裝形成的膠束粒子在GSH的存在下可因共聚物鏈中二硫鍵的斷裂而發生解離,因此有望將PEG-PU(SS)-PEG組裝體用作藥物載體,在富含GSH 的腫瘤組織和腫瘤細胞內實現負載藥物的響應性釋放。而在另一方面,姜黃素是從姜黃中提取出來的一種天然多酚藥物,在抗炎、抗癌、抗菌和抗氧化等方面具有良好的應用前景,但因水溶解性差、生物利用率低而使其實際應用受到限制,將其負載于納米載體中則可改善以上缺陷[23]。因此,本文通過納米閃沉法制備得到在疏水內核中負載有姜黃素的PEGPU(SS)-PEG膠束組裝體,進一步研究了以PEG-PU(SS)-PEG膠束作為藥物載體的可行性。
姜黃素溶液熒光光譜見圖8(a),選取530 nm處的熒光強度對溶液濃度進行線性擬合得到標準曲線圖8(b)。然后取負載姜黃素的PEG-PU(SS)-PEG膠束分散液凍干后稱重,再將其溶解于DMSO-H2O (體積比9∶1) 中制成500 mL的稀釋溶液進行熒光光譜測試 (圖8(c)),測得530 nm處的熒光強度后根據標準曲線計算樣品中姜黃素的含量,由此可計算得到膠束中姜黃素的載藥量為22.2%,載藥效率為71.3%,表明PEG-PU(SS)-PEG膠束對姜黃素的負載效果良好,這可能是因為姜黃素的分子結構中含有羥基 (圖1),可以和PEG-PU(SS)-PEG聚合物分子鏈中的氨基甲酸酯結構之間形成較強的氫鍵相互作用[24-26],從而提高對姜黃素的負載量。
為了模擬生理環境下藥物的釋放,在含有GSH的PBS 緩沖液 (pH=7.4) 中進行了載藥膠束的藥物釋放實驗,并設置空白對照組,根據上述建立的標準曲線計算藥物在不同時刻的累積釋放量,結果如圖8(d)所示。在體系中加入GSH之后,隨著PEG-PU(SS)-PEG的降解和膠束結構的解離,負載于膠束中的姜黃素被釋放,在6 h后基本達到平衡,累計釋放量約為90%;而在不加GSH的情況下,在相同時間內并無明顯的藥物釋放,這表明膠束載藥體系的結構穩定性較高,在GSH濃度較低的人體血液和細胞外液中能夠穩定存在,從而可以減少藥物的提前釋放,避免暴釋,降低藥物的全身毒性;而在納米載藥體系經EPR效應進入腫瘤組織、被腫瘤細胞攝取后,可在高濃度GSH等巰基化合物的觸發下發生解離,釋放所負載的化療藥物,達到治療效果。
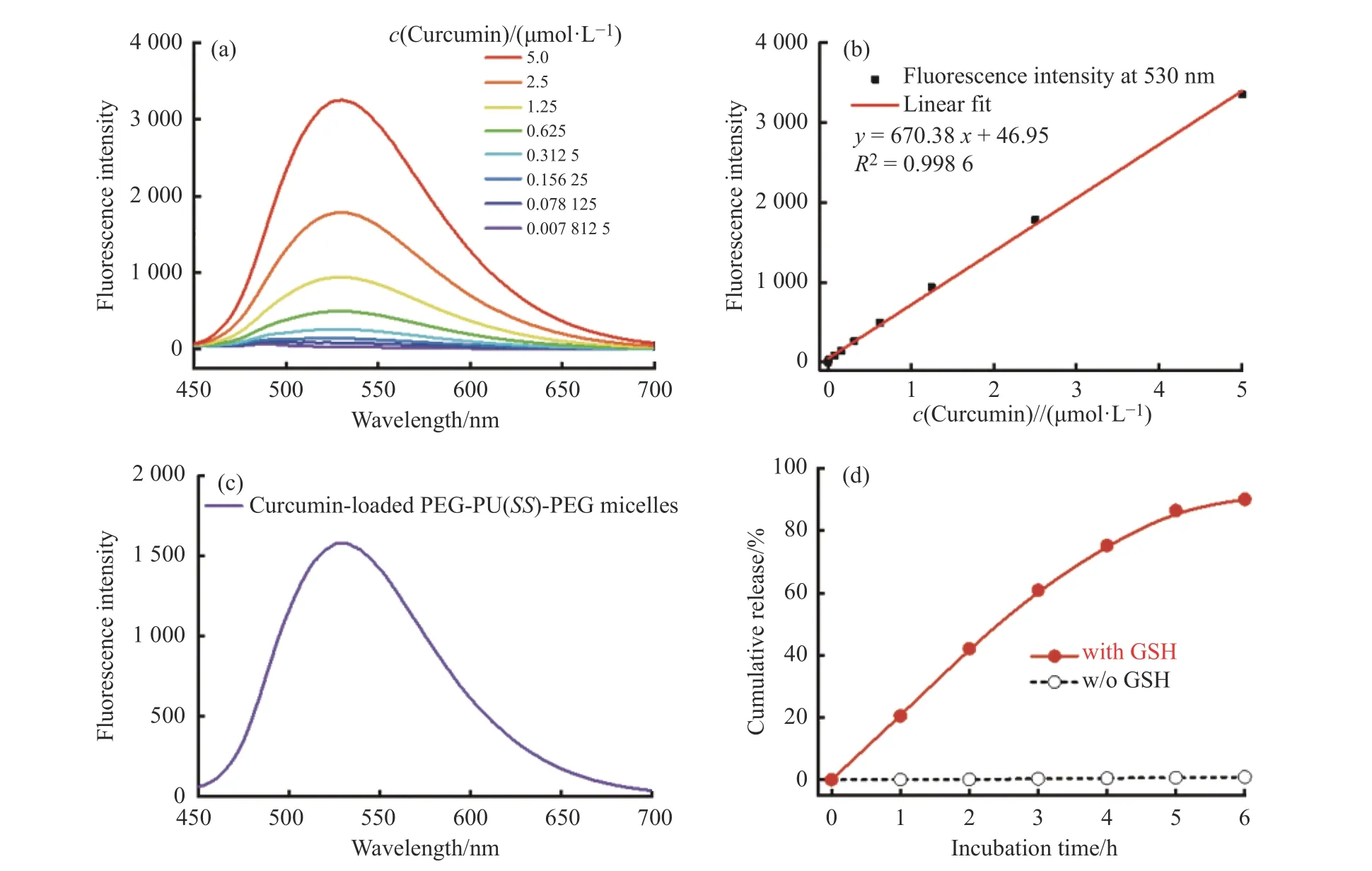
圖 8 姜黃素溶液的(a)熒光光譜和(b)熒光強度-濃度標準曲線;負載姜黃素的PEG-PU(SS)-PEG組裝體的(c)熒光發射光譜和(d)在有GSH或無GSH存在情況下的藥物釋放曲線Fig. 8 (a) Fluorescence emission spectra and (b) fluorescence intensity-concentration standard calibration curves of curcumin solution;(c) Fluorescence emission spectrum and (d) release profile of curcumin from curcumin-loaded PEG-PU(SS)-PEG nanocarriers in the absence and presence of GSH, respectively
3 結 論
(1) 采用逐步聚合法合成了一類具有還原環境響應性的兩親性聚氨酯三嵌段聚合物-聚乙二醇-聚氨基甲酸酯-聚乙二醇。
(2) PEG-PU(SS)-PEG在水溶液中組裝形成的納米膠束可在其疏水內核中負載疏水性化療藥物姜黃素,制備得到納米載藥體系。
(3) 由于共聚物分子鏈上PU(SS) 中間嵌段的還原環境響應性,PEG-PU(SS)-PEG在GSH觸發下可發生降解,從而導致膠束結構的解離并釋放所負載的姜黃素。
(4) 通過改變刺激響應性基元的結構,以此類兩親性三嵌段共聚物為平臺,有望構筑得到多種具有不同刺激響應性的納米載藥體系。

