大鼠三叉神經(jīng)痛模型中小膠質(zhì)細(xì)胞激活情況及經(jīng)時(shí)變化
盧妍竹 張婧琦 賴文莉
口腔疾病研究國(guó)家重點(diǎn)實(shí)驗(yàn)室 國(guó)家口腔疾病臨床醫(yī)學(xué)研究中心四川大學(xué)華西口腔醫(yī)院正畸科,成都 610041
三叉神經(jīng)痛是在三叉神經(jīng)分布區(qū)域內(nèi)突然發(fā)作的、持續(xù)數(shù)秒至數(shù)分鐘的劇烈疼痛,其發(fā)作具有周期性、陣發(fā)性等特點(diǎn),發(fā)作間歇無(wú)癥狀[1-2]。疼痛由三叉神經(jīng)末梢以神經(jīng)沖動(dòng)的形式傳遞至三叉神經(jīng)節(jié),之后進(jìn)一步傳遞至延髓的三叉神經(jīng)核復(fù)合體,通過(guò)丘腦經(jīng)由眾多腦區(qū)調(diào)節(jié)后傳遞至大腦皮層而被感知[3]。疼痛發(fā)作時(shí),傳入三叉神經(jīng)核的痛覺(jué)信息主要由三叉神經(jīng)脊束核尾側(cè)亞核(spi‐nal trigeminal nucleus caudal part,Sp5C) 處 理[4],該區(qū)小膠質(zhì)細(xì)胞可能出現(xiàn)激活。小膠質(zhì)細(xì)胞是神經(jīng)系統(tǒng)內(nèi)固有的重要免疫細(xì)胞,對(duì)外界刺激反應(yīng)靈敏,激活后形態(tài)發(fā)生明顯變化以獲得更強(qiáng)的吞噬及運(yùn)動(dòng)能力,且可以進(jìn)一步釋放促炎因子參與疼痛的發(fā)生和維持[5]。周圍神經(jīng)損傷引起的炎性反應(yīng)以及脊髓背角神經(jīng)元的過(guò)度興奮性,均為小膠質(zhì)細(xì)胞激活的促進(jìn)因素[6]。小膠質(zhì)細(xì)胞的激活在神經(jīng)病理性疼痛中起著關(guān)鍵作用,具體機(jī)制仍有待進(jìn)一步研究[6]。
本研究的目的是通過(guò)經(jīng)口內(nèi)開(kāi)口結(jié)扎大鼠三叉神經(jīng)的眶下神經(jīng)(infraorbital nerve,IoN)分支,引起三叉神經(jīng)慢性壓迫性損傷(chronic con‐striction injury,CCI),構(gòu)建大鼠三叉神經(jīng)痛動(dòng)物模型(IoN-CCI)后,探索Sp5C中小膠質(zhì)細(xì)胞激活情況及其隨時(shí)間的變化,同時(shí)研究該變化與大鼠頜面部的疼痛是否具有一致性,以期為進(jìn)一步探索三叉神經(jīng)痛發(fā)病機(jī)制提供思路。
1 材料和方法
1.1 實(shí)驗(yàn)動(dòng)物及分組
本實(shí)驗(yàn)自四川大學(xué)動(dòng)物實(shí)驗(yàn)中心購(gòu)買8~10周齡的雄性Sprague-Dawley大鼠,體重230 g±20 g,無(wú)疾患。大鼠在室內(nèi)溫度25℃±2℃的空調(diào)房?jī)?nèi)飼養(yǎng),食物及水源充足。所有大鼠均符合國(guó)際動(dòng)物實(shí)驗(yàn)要求,在正常晝夜節(jié)律下飼養(yǎng)3 d,待適應(yīng)環(huán)境后進(jìn)入實(shí)驗(yàn)。
本實(shí)驗(yàn)共使用了48只大鼠,隨機(jī)抽取8只作為空白對(duì)照組,再隨機(jī)將剩余40只分為IoN-CCI組及假手術(shù)組(各20只),2組中各8只用于行為學(xué)觀察、機(jī)械痛閾測(cè)試及體重測(cè)量,至第30天處死取材,其余12只分別在術(shù)后第1、5、10、15天處死取材。
1.2 眶下神經(jīng)部分結(jié)扎動(dòng)物模型的建立
按照體重50 mg·kg-1體重的劑量經(jīng)由腹腔注射1%戊巴比妥鈉溶液麻醉大鼠,將大鼠仰面固定在手術(shù)臺(tái)上,使用開(kāi)口器打開(kāi)大鼠上下頜,碘伏消毒后,經(jīng)上腭第二橫皺襞與右側(cè)頰黏膜轉(zhuǎn)折處切開(kāi)3~5 mm切口,用自制圓頭探針經(jīng)切口探入,緊貼大鼠上頜骨向眶下緣滑動(dòng),向內(nèi)向上勾拉,可見(jiàn)眶下神經(jīng)(圖1A)。IoN-CCI組采用5-0絲線結(jié)扎眶下神經(jīng),松緊以使其略小于該神經(jīng)的直徑、稍微減緩神經(jīng)表面的血流通過(guò)但不至完全阻滯為宜。兩結(jié)之間間隔約2 mm。假手術(shù)組稍稍勾拉神經(jīng)組織,不予結(jié)扎。隨后4-0絲線縫合傷口1針。手術(shù)過(guò)程如圖1所示。
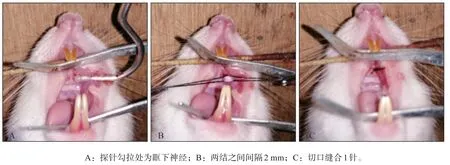
圖1 眶下神經(jīng)結(jié)扎實(shí)驗(yàn)過(guò)程Fig 1 Experimental process of infraorbital nerve ligation
1.3 體重變化測(cè)量
在相同的環(huán)境、采用相同的飼料喂養(yǎng)大鼠。在手術(shù)當(dāng)天(術(shù)前)及術(shù)后第1、5、10、15、30天測(cè)量大鼠體重,以空白對(duì)照組作為對(duì)比,觀察口內(nèi)開(kāi)口對(duì)大鼠體重的影響,輔助判斷手術(shù)對(duì)進(jìn)食的影響。
1.4 行為學(xué)變化觀察
將大鼠放置在下方通氣的透明玻璃盒(26 cm×14 cm×16 cm)中,保證大鼠可以在其內(nèi)自由活動(dòng),待其適應(yīng)至少5 min后,開(kāi)始觀察大鼠。每只大鼠觀察10 min,采用計(jì)時(shí)器計(jì)算大鼠搔抓面部(face-grooming)累積時(shí)間。搔抓面部時(shí)間計(jì)入標(biāo)準(zhǔn)為:1)大鼠用前肢觸碰手術(shù)側(cè)觸須墊及鼻尖部分;2)觸碰頭頂或身體其他部分不計(jì)入;3)僅觸碰非手術(shù)側(cè)不計(jì)入。觀察人員預(yù)先不知道大鼠分組情況。
1.5 機(jī)械痛閾測(cè)試
大鼠在進(jìn)行機(jī)械痛閾測(cè)試之前5 d適應(yīng)環(huán)境,并在正式測(cè)試前3 d進(jìn)行適應(yīng)性測(cè)驗(yàn)。機(jī)械痛閾通過(guò)電子Von Frey測(cè)痛儀測(cè)量。將大鼠放入塑料錐形限制器(長(zhǎng)度25 cm)中,于前開(kāi)口完整露出頭部及前肢,保證其頭部可以自由擺動(dòng)(圖2)。待大鼠平靜5 min后,將纖維絲靠近大鼠眶下神經(jīng)感受區(qū)(觸須墊及其附近皮膚),以非常緩慢的速度加力。電腦端顯示出隨力值逐漸增高的坡形曲線,當(dāng)大鼠出現(xiàn)頭部回縮、偏向?qū)?cè)或用前肢攻擊探針時(shí),加力被動(dòng)停止,以該曲線的最大力值為痛閾。待大鼠休息3 min后,再次重復(fù)上述操作。操作中避免反復(fù)戳同一個(gè)點(diǎn)造成組織損傷導(dǎo)致測(cè)量偏差。每只大鼠進(jìn)行3次,以最大值為其痛閾。在術(shù)前(0 d)和術(shù)后第1、5、10、15和30天分別測(cè)量IoN-CCI組及假手術(shù)組手術(shù)同側(cè)及對(duì)側(cè)的痛閾,衡量大鼠痛閾變化。
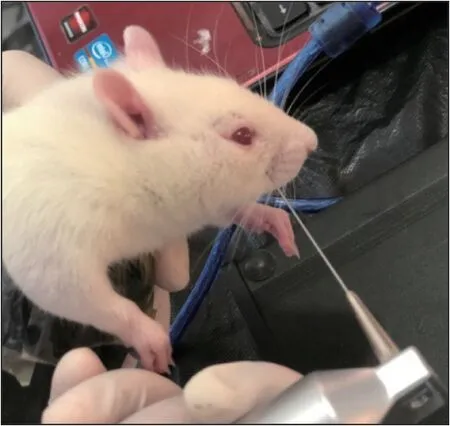
圖2 電子Von Frey纖維絲測(cè)試痛閾Fig 2 Pain threshold detection using electronic Von Frey fila‐ment
1.6 實(shí)驗(yàn)動(dòng)物取材
將大鼠按照50 mg·kg?1體重的劑量經(jīng)由腹腔注射1%戊巴比妥鈉溶液麻醉,待麻醉后開(kāi)胸,灌注針從心間插入左心室,用止血鉗固定,再用剪刀剪開(kāi)右心耳,開(kāi)始灌注生理鹽水,待肝臟變白后繼續(xù)灌注4%多聚甲醛。灌注完成后,用剪刀剪開(kāi)顱頂皮層,暴露顱骨,止血鉗沿枕骨大孔處將顱骨剝開(kāi),去除大腦組織,再輕輕地將小腦剝?nèi)ィ┞堆铀杞M織,將延髓鈍性分離后,切取Sp5C組織(圖3)。

圖3 三叉神經(jīng)核脊束尾側(cè)核取材位置Fig 3 Location of spinal trigeminal nucleus caudal part
1.7 免疫組織化學(xué)染色
組織在4%多聚甲醛中固定24~48 h,脫水、透明、浸蠟、石蠟包埋。石蠟標(biāo)本連續(xù)切片(厚5 μm),經(jīng)脫蠟、水化、抗原修復(fù),冷卻至室溫后行大鼠小膠質(zhì)細(xì)胞標(biāo)志物鈣離子結(jié)合銜接分子1(ionized calcium binding adaptor molecule-1,Iba-1)抗體(1∶1 000,Cell Signaling Technologie公司,美國(guó))免疫組織化學(xué)常規(guī)染色。光鏡下觀察Iba-1在Sp5C中的表達(dá)和分布情況并拍照。使用Image-J軟件進(jìn)行定量分析。
1.8 統(tǒng)計(jì)分析
采用SPSS 21.0軟件進(jìn)行統(tǒng)計(jì)分析。數(shù)據(jù)符合正態(tài)分布則采用均數(shù)±標(biāo)準(zhǔn)差表示,組別與時(shí)間的影響采用重復(fù)測(cè)量的雙因素方差分析。2組間同時(shí)間點(diǎn)比較采用獨(dú)立樣本t檢驗(yàn),3組以上則采用單因素方差分析(one-way ANOVA)對(duì)差異進(jìn)行評(píng)估,并采用LSD進(jìn)行事后比較。P<0.05被認(rèn)為差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 大鼠體重變化
空白對(duì)照組、假手術(shù)組、IoN-CCI組大鼠體重隨時(shí)間變化見(jiàn)表1。術(shù)前及術(shù)后第1天3組間體重差異無(wú)統(tǒng)計(jì)學(xué)意義,術(shù)后第5天IoN-CCI組體重開(kāi)始低于空白組,并持續(xù)到第30天,差異有統(tǒng)計(jì)學(xué)意義(均P<0.05)。IoN-CCI組術(shù)后第30天的體重為360.50 g±10.06 g,比空白對(duì)照組 (381.62 g±8.66 g)低5.51%。
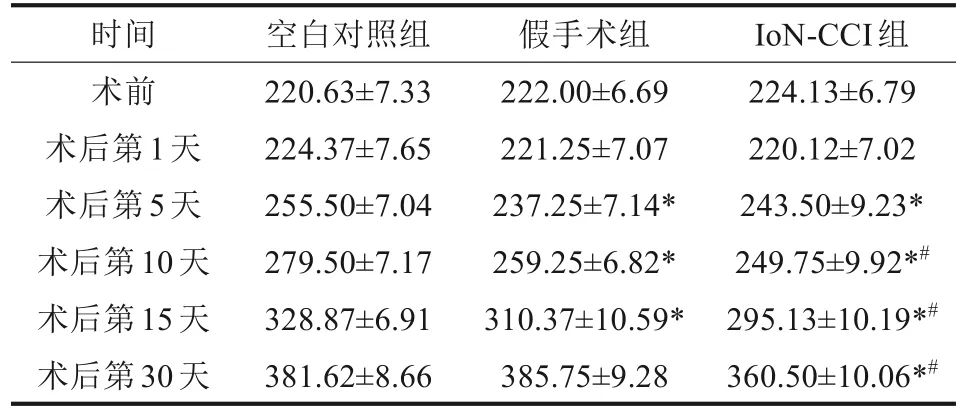
表1 各組大鼠體重變化Tab 1 Changes in body weight of rats of every group g,n=8
2.2 行為學(xué)變化
眶下神經(jīng)部分結(jié)扎對(duì)大鼠搔抓面部行為的影響見(jiàn)圖4。大鼠搔抓面部時(shí)間的變化受術(shù)后時(shí)間(P<0.01)和組別的影響(P<0.01)。對(duì)同時(shí)間點(diǎn)的搔抓面部時(shí)間進(jìn)行t檢驗(yàn)分析,結(jié)果顯示,IoNCCI組在術(shù)后第1天(P<0.05)、第5天(P<0.01)、第10天 (P<0.01)、第15天 (P<0.05)、第30天(P<0.05)的搔抓面部時(shí)間高于假手術(shù)組。

圖4 各組大鼠搔抓面部時(shí)間的變化Fig 4 Changes in face-grooming time of rats of every group
2.3 機(jī)械痛閾變化
IoN-CCI組與假手術(shù)組機(jī)械痛閾的變化見(jiàn)圖5。按照眶下神經(jīng)結(jié)扎與否、手術(shù)同側(cè)與對(duì)側(cè),總共分為4組,重復(fù)測(cè)量的雙向方差分析表明,機(jī)械痛閾受到組別和手術(shù)后時(shí)間的影響(P<0.01)。術(shù)前及術(shù)后第5天,各組間差異均無(wú)統(tǒng)計(jì)學(xué)意義,而術(shù)后第1、10、15、30天,IoN-CCI組手術(shù)同側(cè)痛閾低于假手術(shù)組同側(cè)(均P<0.05),尤其第10天最為明顯。IoN-CCI組同側(cè)、假手術(shù)組同側(cè)及假手術(shù)組對(duì)側(cè)3組間術(shù)后痛閾差異均無(wú)統(tǒng)計(jì)學(xué)意義。
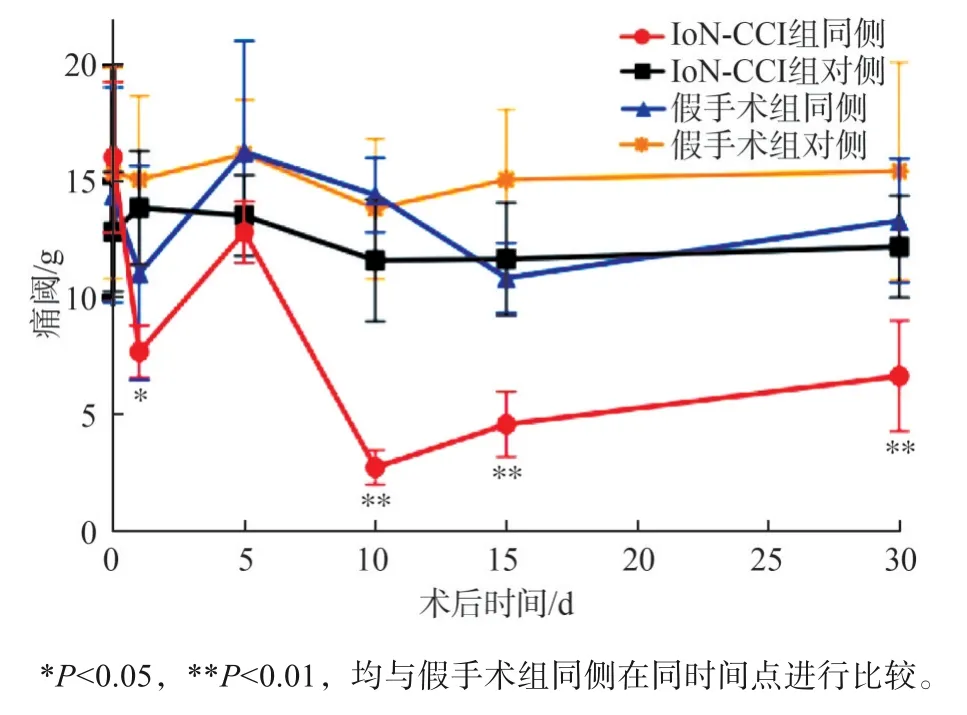
圖5各組大鼠頜面部機(jī)械痛閾變化Fig 5 Changes of maxillofacial mechanical pain threshold of rats of every group
2.4 Sp5C中Iba-1表達(dá)變化
圖6 示通過(guò)免疫組織化學(xué)標(biāo)記Iba-1的染色情況。圖6A可見(jiàn),與假手術(shù)組相比,IoN-CCI組手術(shù)側(cè)Iba-1表達(dá)在術(shù)后第5~15天增加且集中分布在Sp5C。圖6B為IoN-CCI組手術(shù)同側(cè)及對(duì)側(cè)Iba-1表達(dá)比較情況,可見(jiàn)同側(cè)Sp5C區(qū)小膠質(zhì)細(xì)胞數(shù)量增加且明顯激活,對(duì)側(cè)則呈零星分布且激活不明顯。圖6C為假手術(shù)組同側(cè)、IoN-CCI組對(duì)側(cè)、IoN-CCI組同側(cè)的小膠質(zhì)細(xì)胞激活情況定量分析。重復(fù)測(cè)量的雙因素方差分析表明,Iba-1的表達(dá)受組別和時(shí)間的影響(均P<0.01)。IoN-CCI同側(cè)的Iba-1表達(dá)水平在術(shù)后第1天至術(shù)后第15天與自身對(duì)側(cè)相比差異均有統(tǒng)計(jì)學(xué)意義(P<0.01),IoN-CCI同側(cè)Iba-1表達(dá)水平在術(shù)后第10天達(dá)到峰值,至第30天與假手術(shù)組相比差異無(wú)統(tǒng)計(jì)學(xué)意義。
由于小膠質(zhì)細(xì)胞的變化是動(dòng)態(tài)且可循環(huán)的,因此根據(jù)文獻(xiàn)資料[7-8]將其大致分為3種:1)分支狀:未激活狀態(tài),小膠質(zhì)細(xì)胞胞體卵圓,分出細(xì)小分支;2)中間狀:小膠質(zhì)細(xì)胞胞體狹長(zhǎng),分支變少;3)變形蟲(chóng)樣:激活狀態(tài),基本不可見(jiàn)細(xì)小分支,胞體形狀不規(guī)則,染色更深。圖6D為各組小膠質(zhì)細(xì)胞形態(tài)圖,黑色箭頭示意分支狀,藍(lán)色箭頭示意中間狀,紅色箭頭示意變形蟲(chóng)狀。
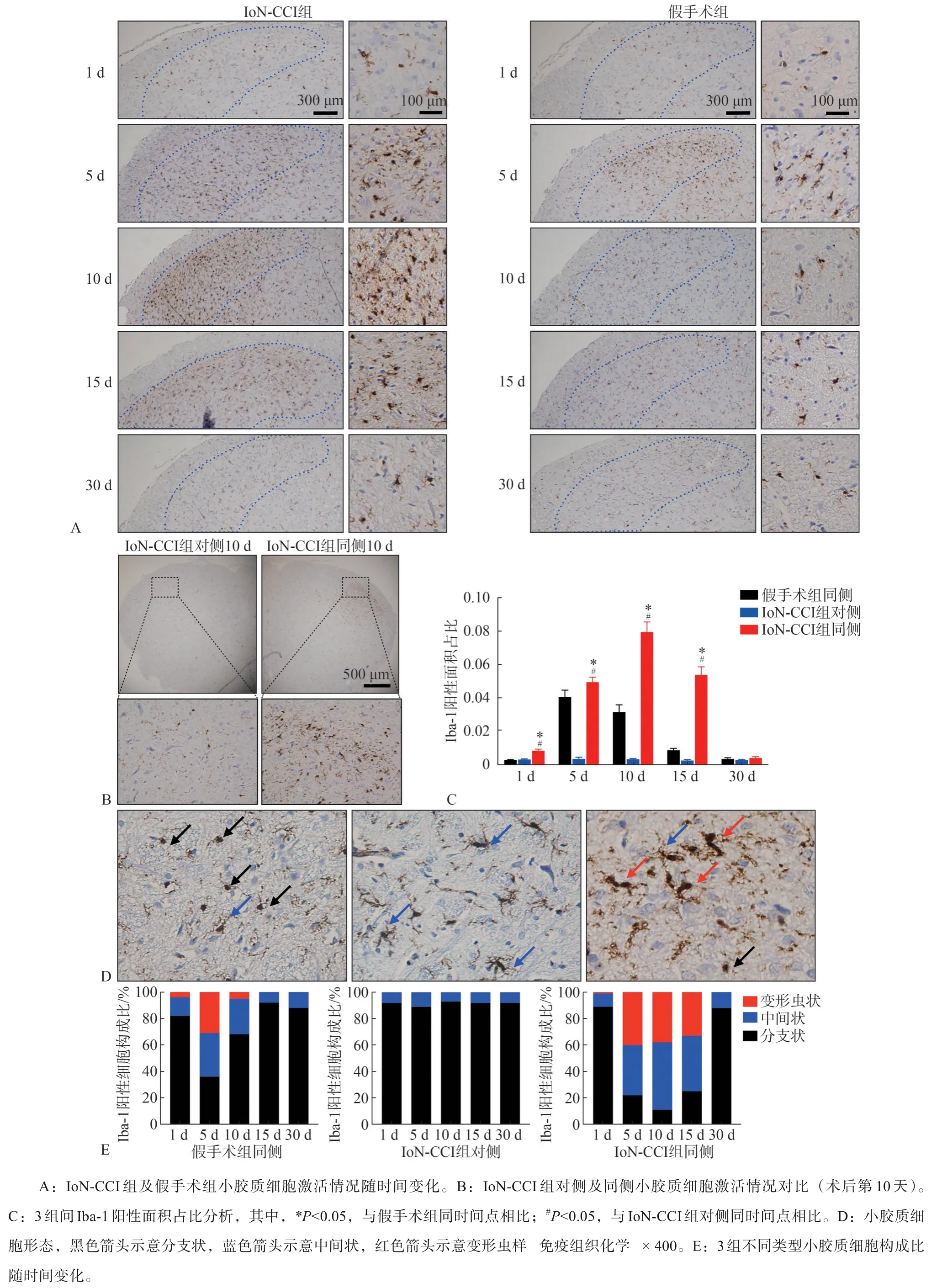
圖6 各組小膠質(zhì)細(xì)胞激活情況隨時(shí)間的變化Fig 6 Changes in microglia activation over time of every group
圖6E 為各組小膠質(zhì)細(xì)胞構(gòu)成比分析結(jié)果。IoN-CCI 組同側(cè)分支狀小膠質(zhì)細(xì)胞占比在術(shù)后第5天至第15 天低于同時(shí)間點(diǎn)IoN-CCI 組對(duì)側(cè)(均P<0.01),術(shù)后第10天、第15天低于同時(shí)間點(diǎn)假手術(shù)組同側(cè)(均P<0.05),與之對(duì)應(yīng)的是變形蟲(chóng)樣小膠質(zhì)細(xì)胞占比增加。IoN-CCI組對(duì)側(cè)從始至終并未觀察到變形蟲(chóng)樣細(xì)胞。IoN-CCI組同側(cè)變形蟲(chóng)樣細(xì)胞在術(shù)后第5 天至第15 天占比在30%~40%之間,術(shù)后第30天未見(jiàn)。
3 討論
三叉神經(jīng)的三大分支分別為眼神經(jīng)、上頜神經(jīng)以及下頜神經(jīng),這三條神經(jīng)的末端分支分別為眶上神經(jīng)、眶下神經(jīng)和下牙槽神經(jīng)[9]。眶下神經(jīng)是感覺(jué)神經(jīng),支配口頜面區(qū)的感覺(jué)功能,其損傷會(huì)引起頜面部的疼痛但不會(huì)造成功能障礙[10],且由于解剖學(xué)位置的關(guān)系,眶下神經(jīng)結(jié)扎更為方便,因此三叉神經(jīng)痛模型的建立首選對(duì)眶下神經(jīng)進(jìn)行慢性壓迫損傷[11]。而即便是對(duì)相對(duì)容易的眶下神經(jīng)進(jìn)行結(jié)扎,操作仍較為復(fù)雜[12],過(guò)程中可能對(duì)眼球造成損傷,建模難度較大。近年來(lái)研究[13-14]報(bào)道了更為簡(jiǎn)便的建模方式,但手術(shù)切口在眶下神經(jīng)分布區(qū)域,對(duì)疼痛的評(píng)估造成一定的干擾。經(jīng)口內(nèi)開(kāi)口建立眶下神經(jīng)慢性壓迫性損傷的大鼠三叉神經(jīng)痛動(dòng)物模型在1997 年由Imamura 等[15]提出,由于開(kāi)口在口內(nèi),對(duì)大鼠的進(jìn)食造成影響。本研究通過(guò)體重輔助判斷大鼠營(yíng)養(yǎng)狀況,雖然IoN-CCI組與假手術(shù)組、空白對(duì)照組有差異,但I(xiàn)oN-CCI組體重自手術(shù)后至第30 天均在大鼠體重的正常參考值內(nèi)[16],未出現(xiàn)營(yíng)養(yǎng)不良。
進(jìn)行眶下神經(jīng)部分結(jié)扎后,本研究以搔抓面部的持續(xù)時(shí)間作為自發(fā)性疼痛的觀察指標(biāo),觀察到IoN-CCI 組與假手術(shù)組大鼠在術(shù)后第1 天搔抓面部持續(xù)時(shí)間均有升高,但假手術(shù)組在術(shù)后第5天搔抓面部時(shí)間即有下降,第10 天基本回到基線,筆者猜測(cè)術(shù)后搔抓面部時(shí)間的短暫增高可能是由于手術(shù)的創(chuàng)傷或者術(shù)中對(duì)眶下神經(jīng)輕微的勾拉導(dǎo)致的;而IoN-CCI 組搔抓面部時(shí)間在術(shù)后持續(xù)升高,至第30 天仍高于假手術(shù)組。結(jié)合大鼠頜面部痛閾變化的檢測(cè)發(fā)現(xiàn),進(jìn)行眶下神經(jīng)部分結(jié)扎后,大鼠結(jié)扎側(cè)機(jī)械痛閾在術(shù)后第10 天降至最低,后逐漸升高,且在第10 天后均明顯低于非手術(shù)側(cè)以及假手術(shù)組。而在術(shù)后第1 天及第5天,IoN-CCI 組及假手術(shù)組的同側(cè)痛閾變化趨勢(shì)基本一致,均為術(shù)后第1 天降低,術(shù)后第5 天基本恢復(fù)至基線水平,而直到術(shù)后第10 天組間出現(xiàn)明顯差異。筆者推測(cè)假手術(shù)組術(shù)后第1天痛閾降低可能是由于手術(shù)創(chuàng)傷引起的炎性反應(yīng),而手術(shù)組同側(cè)術(shù)后第5天出現(xiàn)短暫的痛閾上升可能因?yàn)槭中g(shù)創(chuàng)傷導(dǎo)致的局部神經(jīng)水腫反應(yīng)[17]。
小膠質(zhì)細(xì)胞激活情況與行為學(xué)變化和機(jī)械痛閾的變化基本一致。同時(shí),IoN-CCI組同側(cè)小膠質(zhì)細(xì)胞占比也出現(xiàn)了變化:分支狀小膠質(zhì)細(xì)胞占比先降低后回升,變形蟲(chóng)樣小膠質(zhì)細(xì)胞占比先增高后降低。當(dāng)神經(jīng)發(fā)生損傷后,受損的神經(jīng)元及中樞神經(jīng)系統(tǒng)的疼痛調(diào)節(jié)通路發(fā)生變化,通過(guò)大量神經(jīng)遞質(zhì)及其他物質(zhì)的作用,導(dǎo)致神經(jīng)性疼痛的發(fā)生和維持[18]。損傷導(dǎo)致痛覺(jué)傳入神經(jīng)出現(xiàn)明顯的自發(fā)性沖動(dòng),同時(shí)伴隨電壓門(mén)控鈉通道m(xù)RNA水平增加[19],降低動(dòng)作電位閾值,二者的共同作用下,引起異位沖動(dòng)發(fā)生并沿著痛覺(jué)傳遞通路到達(dá)感覺(jué)皮層,引起自發(fā)性疼痛[20-21]。同時(shí),受損神經(jīng)支配區(qū)域附近的痛覺(jué)傳入纖維中發(fā)生異位神經(jīng)活動(dòng),導(dǎo)致脊髓背角內(nèi)的興奮性氨基酸及神經(jīng)肽釋放,引起第二級(jí)痛覺(jué)神經(jīng)元突觸后變化,誘導(dǎo)神經(jīng)元過(guò)度興奮,導(dǎo)致原本不足以引起疼痛的觸覺(jué)刺激均可導(dǎo)致疼痛信號(hào)的傳遞,即痛閾降低。同時(shí),神經(jīng)損傷可導(dǎo)致小膠質(zhì)細(xì)胞激活,激活后的小膠質(zhì)細(xì)胞形態(tài)發(fā)生變化,且能分泌大量炎癥因子及神經(jīng)毒性分子,如腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、一氧化氮合酶及活性氧等,通過(guò)擴(kuò)大炎癥反應(yīng)參與神經(jīng)病理性疼痛的發(fā)展與維持[22]。小膠質(zhì)細(xì)胞的激活參與疼痛發(fā)生和維持的同時(shí),小膠質(zhì)細(xì)胞吞噬能力的提升對(duì)機(jī)體內(nèi)環(huán)境的穩(wěn)態(tài)的維持和修復(fù)也有著重要意義。
本研究通過(guò)Iba-1 免疫組織化學(xué)染色觀察到眶下神經(jīng)結(jié)扎引起大鼠同側(cè)Sp5C 中小膠質(zhì)細(xì)胞激活,同時(shí)探索到激活水平隨時(shí)間的變化趨勢(shì),該趨勢(shì)與眶下神經(jīng)結(jié)扎引起的頜面部疼痛變化相似,說(shuō)明通過(guò)眶下神經(jīng)結(jié)扎建立的三叉神經(jīng)痛動(dòng)物模型可引起三叉神經(jīng)核小膠質(zhì)細(xì)胞激活,且頜面部疼痛變化趨勢(shì)與小膠質(zhì)細(xì)胞激活具有一致性。
本研究也有一些不足之處。本實(shí)驗(yàn)參考相關(guān)文獻(xiàn)報(bào)道選擇8~10 周齡大鼠建立IoN-CCI 模型,而臨床上三叉神經(jīng)痛患者年齡偏大,若采用中年大鼠(約20個(gè)月)會(huì)更加貼近臨床三叉神經(jīng)痛的患病人群。同時(shí),本研究缺乏對(duì)于小膠質(zhì)細(xì)胞激活機(jī)制的研究,后續(xù)將會(huì)以IoN-CCI 為模型探究Sp5C 中小膠質(zhì)細(xì)胞的激活模式的相關(guān)信號(hào)通路,期望找到關(guān)鍵靶點(diǎn),為安全有效地治療三叉神經(jīng)痛提供新的可能。
利益沖突聲明:作者聲明本文無(wú)利益沖突。

