宏觀辨識與微觀探析在鹽類水解教學中的實踐研究
閆佳琪
(吉林師范大學 化學學院,吉林四平 136000)
化學核心素養的研究近幾年來熱度越來越高,如何將化學核心素養真正落實到課堂實踐是一線教師亟待解決的問題。化學核心素養中宏觀辨識與微觀探析旨在從宏觀和微觀相結合的角度認識物理和化學變化[1]。在學習目標描述上,學生能從學科觀念進階到能夠掌握分析解決問題的方法,這種學習目標的進階會不斷促進學生學科問題解決的思維視角養成[2]。在鹽類的水解教學中,比較離子大小一直是學生的難點問題。通過基于宏觀辨識與微觀探析教學設計幫助學生真正解決這一難題。
1 教材與學情分析
1.1 教材分析
本節內容選自人教版選修四第三章第三節。首先學生在之前的化學平衡知識的學習中已經掌握了平衡移動的知識,由此知識遷移到水溶液中離子平衡問題就會比較輕松地理解這些知識點。通過建立宏觀和微觀的化學核心素養讓學生在理解鹽類水解過程中存在鹽先電離再水解的過程。通過具體的教學過程探究,讓學生構建出易溶于水且易電離的鹽的電離是宏觀過程,產生的離子是宏觀離子。弱酸根和弱堿根的水解是微觀的過程,產生的離子是微觀離子。由此真正理解離子濃度大小比較的依據是什么。本節課內容是在學生已經學習了鹽類水解的基本概念和規律,以及水解的離子方程式的基礎上進一步對水解的本質進行探究,通過對離子濃度大小的比較可以進一步深化化學核心素養的認知和加深對鹽類水解本質的理解。
1.2 學情分析
(1)學習了鹽類水解的基本概念、水解規律、水解平衡移動、鹽類水解離子方程式。
(2)通過宏觀辨識與微觀探析的構建解決離子濃度大小比較的問題。
1.3 存在的問題
對于較復雜的電解質溶液粒子種類的判斷、比較離子濃度大小存在知識障礙。
2 設計思路
以宏觀辨識與微觀探析核心素養的培養為主線,讓學生理解在水溶液中哪些離子是宏觀離子,哪些離子是微觀離子。通過學生活動探究,讓學生自己總結出,易溶于水且易電離的強電解質電離出的離子在水溶液中可以歸納為宏觀離子。難溶于水或者難電離的弱電解質電離出的離子可以歸納為微觀離子。弱酸根和弱堿根的水解產生的離子是微觀離子。由此在比較時歸納為宏觀離子遠遠大于微觀離子,先對電離水解過程進行排序,一般過程為:易溶于水且易電離的強電解質電離>弱電解質電離>鹽類的水解>水的電離,將濃度大小比較總結為“細判斷”“先宏觀”“再微觀”的三步比較法。即通過活動探究培養學生的核心素養,讓學生真正理解濃度大小比較的核心素養內涵,也通過三部比較法解決學生做題的難點問題。
3 教學設計
3.1 情境導入
【提問】前面我們學了電解質的電離,強電解質的電離是完全電離,一步電離。弱電解質的電離是部分電離,因此弱酸根和弱堿根有結合氫離子和氫氧根生成弱酸和弱堿的能力。由此知道鹽的水解本質是鹽類物質電離產生的弱酸根和弱堿根結合水產生的氫離子和氫氧根生成弱酸和弱堿。因此我們學會了書寫鹽類的水解方程式,進一步會判斷溶液中存在哪些離子,那么這些離子濃度大小的判斷成為我們這節課研究的主要問題。
3.2 活動一:單一溶液中離子濃度的大小比較
【討論】在氯化銨溶液和碳酸鈉溶液中,離子濃度大小如何比較?有何規律?
(1)氯化銨溶液。
【交流】NH4Cl在水溶液中是先電離再水解的過程。
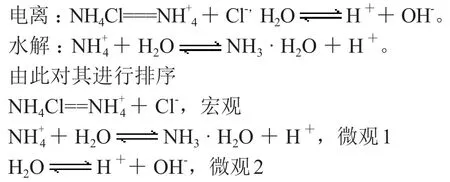
由此先排序是宏觀>微觀1>微觀2(逐漸培養學生的宏觀微觀構建意識)
NH4Cl是強電解質且易溶于水,由此電離出的Cl-是宏觀離子,而H2O是弱電解質,電離出的H+,OH-是微觀離子。由此可知鹽類的水解電離平衡常數是大于水的電離平衡常數的,因此微觀1大于微觀2(微觀的比較是根據平衡常數大小來進行排序比較的)。先比較宏觀離子濃度大小關系,其中會水解導致濃度降低,由此微觀離子中,本來H+、OH-濃度相等,但是水解產生 H+,導致c(H+)>c(OH-)。
【交流】根據其電離和水解程度的相對大小,確定氯化銨溶液中離子濃度由大到小的順序是c(Cl-)>c(H+)>c(NH3·H2O)>c(OH-)[3]。
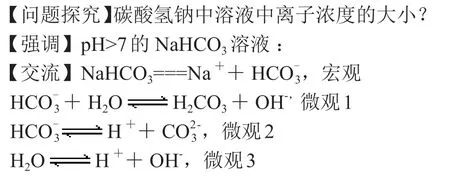
(2)碳酸鈉溶液
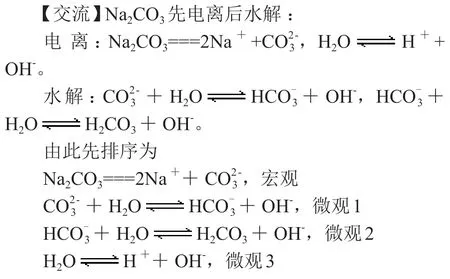
由此排序為宏觀>微觀1>微觀2>微觀3(微觀的排序也是通過平衡常數的大小來排序)。
其中Na+和是宏觀離子,二者本來是二倍關系,但是由于水解導致濃度變小,所以H+是微觀3產生的離子,所以排在最后。

【強調】先排序再比較,宏觀產生的離子大于微觀,微觀1產生的離子大于微觀2。
(3)醋酸溶液
【交流】醋酸溶液離子濃度大小比較
弱酸弱堿溶液中,弱酸弱堿的電離是大于水的電離的,由此先排序:
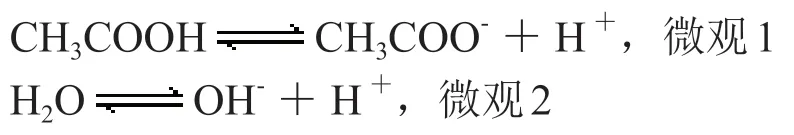
首先明確CH3COOH是宏觀粒子,因為它的電離是微量的,而它電離產生的微觀離子中,微觀1大于微觀2,因此在溶液中產生的離子中微觀1產生的CH3COO-和H+是大于微觀2產生的OH-的,而H+和CH3COO-本應相等,但是微觀2又增加了一部分導致c(H+)>c(CH3COO-)。
在溶液中微粒濃度由大到小的順序:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。
醋酸鈉溶液
【交流】CH3COONa溶液中:
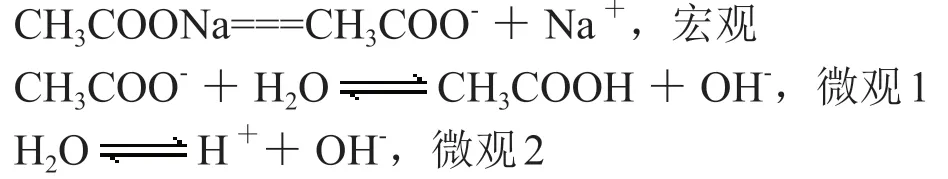
所以 CH3COONa溶液中:CH3COO-,Na+是宏觀離子,CH3COOH,OH-是微觀1產生的離子,H+,OH-是微觀2產生的離子。c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
對于這種多元弱酸根既電離也水解的,我們需要明確是電離大于水解還是水解大于電離,根據題意,溶液顯堿性,因此水解大于電離。所以微觀1是多元弱酸根的水解,微觀2是多元弱酸根的電離。
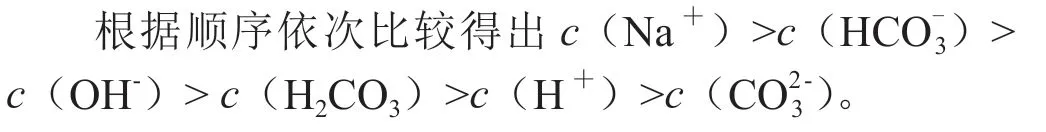
【例題】常溫下pH<7的NaHSO3中濃度最小的離子是( )

【答案】B
【解析】NaHSO3是強電解質,因此電離產生的Na+和是宏觀離子,在溶液中既會水解也會電離,水解溶液顯酸性,電離顯酸性,由于pH<7所以電離大于水解,由此排序如下:
由此濃度最小的是微觀3產生的OH-,由于H+在微觀2產生,c(H+)>c(OH-)。
3.3 活動二:混合溶液中離子濃度的大小比較
【討論】0.1mol/L的NaOH溶液和0.1mol/L NH4Cl 溶液等體積混合,混合溶液中各離子濃度大小關系如何?
【交流】二者混合發生如下反應,NH4Cl+NaOH===NH3·H2O + NaCl,由此生成了0.1mol/L的NH3·H2O和NaCl溶液(先判斷溶液發生哪些反應,再判斷那些電離和水解過程),在混合溶液中有Na+、Cl-、NH+4、OH-、H+,NaCl強電解質,NH3·H2O 弱電解質,在溶液中發生如下反應:

【討論】0.1mol/L的NH4Cl溶液和氨水等體積混合后,pH>7,溶液中離子濃度大小比較。
【交流】二者混合后,首先NH4Cl電離出和Cl-,氨水電離出和OH-,然后水解產生NH3·H2O和H+。由于pH>7,所以電離大于水解,電離排在水解之前,由此先排序:

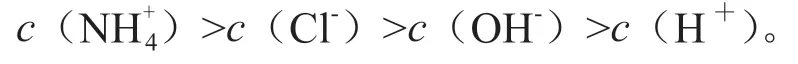
【問題探究】等體積等物質的量濃度的CH3COONa溶液和NaClO溶液混合后,溶液中離子濃度大小關系是什么?{已知常溫:Ka(CH3COOH)>Ka(HClO)}
【討論】弱酸弱堿的電離和鹽類的水解是大于水的電離的,由此排序如下:
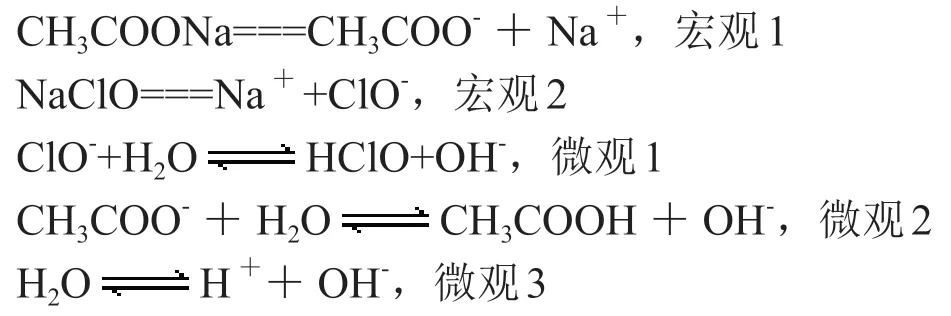
由此排序為宏觀1=宏觀2>微觀1>微觀2>微觀3。
由此得出:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)[4]。
【歸納小結】最終小組討論總結出鹽類水解中溶液離子濃度大小比較規律如下:
(1)先排序,易溶于水的強電解質的電離是宏觀過程,弱電解質的電離是微觀過程,弱酸根和弱堿根的水解是微觀過程,水的電離是微觀過程,由此一般排序為:
強電解質(易溶于水)的電離>弱電解質的電離>弱酸根和弱堿根的水解>水的電離.
其中多元弱酸根分步水解Kh1>Kh2,排序根據水解平衡常數判斷。
(2)再比較,宏觀產生的離子濃度>微觀1產生的離子濃度>微觀2產生的離子濃度,由此可以排出順序。
3.4 課堂總結
學生在分析離子濃度大小時,通過讓學生真正理解電解質在水中是先溶解再電離的過程。由此產生的離子是有宏觀,微觀的區分的。通過真正掌握如何判斷宏觀微觀離子,通過三步法解決大小比較的問題,并且在這一過程中提升了對從微觀水平又進階到宏微結合水平,既解決了問題也提升了綜合素養。
3.5 板書設計—鹽類的水解
3.5.1 單一溶液中離子濃度的大小比較
(1)先電離后水解,強電解質電離是宏觀過程,產生的離子是宏觀離子,弱電解質電離是微觀過程,所以產生的離子是微觀離子。
(2)弱酸根和弱堿根的水解是微觀過程,產生的離子是微觀粒子。
(3)水的電離是微觀過程,產生的粒子是微觀離子。
3.5.2 混合溶液中離子濃度的大小比較
(1)先判斷溶液混合以后發生那些變化,有些溶質會反應,有些是先電離再水解。
(2)根據題目有效信息包括酸堿性等信息判斷宏觀過程有哪些,微觀過程有哪些,然后將過程排序,一般順序為:
強電解質電離(易溶于水)>弱電解質電離>弱酸根或弱堿根的水解>水的電離
(3)根據順序依次比較
4 結語
核心素養的提出,是教育對人的全面回歸。核心素養指人適應信息時代和知識社會的需要,解決復雜問題和適應不可預測情境的高級能力和人性能力。核心素養體系的構建,成為順應國際教育改革趨勢,增強國家核心競爭力,提升我國人才培養質量的關鍵環節。化學核心素養是學生核心素養中的一部分,本次教學設計基于宏觀辨識與微觀探析在學生活動探究的基礎上總結出三步法,先宏觀再微觀幫助學生理解如何比較離子濃度,并提升了學生的核心素養。

