基于液相色譜-質譜聯用技術的社區獲得性肺炎合并膿毒癥患者血清脂質組學分析
田紅軍 徐喜媛 呂娜 楊敬平
膿毒癥(Sepsis)是重癥監護室(ICU)病人最常見的死亡原因之一[1-2],因其是感染、燒傷、休克等多種危重癥的并發癥而難以診斷。目前臨床上采用SOFA[Sequential (Sepsis-Related) Organ Failure Assessment]評分法,相比SOFA帶有的主觀性,生物標志物是在實驗室測得,結果更具客觀性。社區獲得性肺炎(Community-Acquired Pneumonia, CAP)指在醫療機構外罹患的肺炎,屬呼吸系統常見疾病,發病率及病死率均較高。膿毒癥(Sepsis)是由宿主對感染的免疫反應失調而引起一種危及生命的器官功能障礙,是CAP嚴重并發癥之一,與其不良預后密切相關。成人CAP 醫院外因感染引起的肺實質炎性疾病在全球各年齡組都有較高的發病率和死亡率。因此,尋找特異性的生物標志物對于膿毒癥的早診斷、早治療以及降低患者死亡率,提高生存率具有重要意義。本研究將我院收集到的社區獲得性肺炎合并膿毒癥患者與正常人血液樣本,非靶向地鑒定出與社區獲得性肺炎合并膿毒癥相關的脂質分子;對其進行多維統計分析,篩選出具有代表性的脂質分子和相關代謝物,探索將血液中的脂質分子與其代謝相關基因作為診斷社區獲得性肺炎合并膿毒癥的生物學標志物的價值。
資料與方法
一、 研究對象
選取2018 年 09 月至2020 年09月期間,于內蒙古包鋼醫院呼吸與危重癥醫學科確診的30例社區獲得性肺炎合并膿毒癥患者(CAP+sepsis組)和16例健康體檢志愿者(NC組)的外周血液標本3mL。納入標準如下[3]:(1)臨床資料齊全;(2)患者符合美國重癥醫學會制定的膿毒癥和社區獲得性肺炎診斷標準;(3)無其他系統性疾病;(4)患者及其家屬簽訂知情同意書。排除肝腎功能不全、血液系統疾病以及免疫系統受損者。根據社區獲得性肺炎合并膿毒癥患者感染指征和重癥患者SOFA評分(SOFA評分≥2分者認定為膿毒癥患者)為CAP+sepsis組。本研究經院倫理委員會批準通過(編號2019MER-053)。
二、主要儀器與試劑
采用UHPLC Nexera LC-30A液相色譜儀(日本島津)與UPLC-Q-TOF/MS質譜儀(美國Waters)聯用進行脂質組學分析。分別使用正負離子掃描模式對樣本進行檢測,色譜柱為ACQUITY UPLCC柱(10 mm x 2.1 mm,1.7m,美國Waters公司)。甲醇、乙腈(HPLC級,Merck公司);乙酸銨(HPLC級)、內標脂肪酸FFA16.d3和FFA18.d3(Sigma公司);磷脂酰膽堿PC38:0、磷脂酰乙醇胺PE34:0、溶血性磷脂酰膽堿LPC19:0、鞘脂SM12:0、甘油三酯TAG45:0和神經酰胺Cer17:0(美國Avanti Polar Lipids公司)。血液總RNA提取試劑盒、反轉錄試劑盒、實時熒光定量PCR試劑盒購自美國Promega公司,引物由生工生物工程(上海)股份有限公司合成,序列(見表1)。
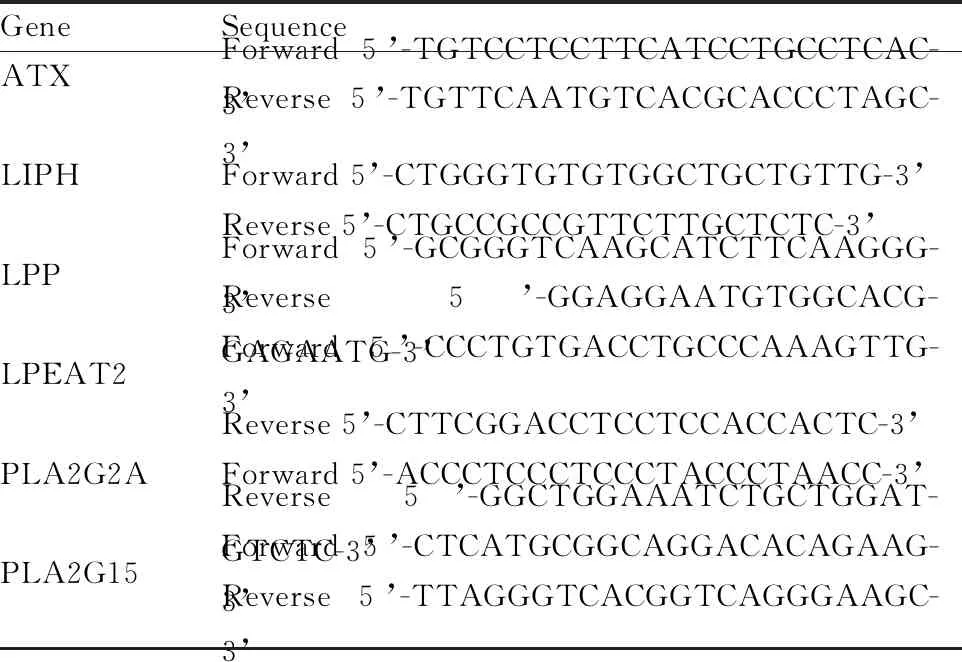
表1 實時熒光定量PCR引物列表
三、方法
1. 樣品制備 將EDTA抗凝血3mL室溫下放置25分鐘,在低溫(4℃)下1000g離心15min,上層的血漿移至離心管中,-80℃凍存備用;NC組留取的標本同樣方法處理。兩組所得血清在液相色譜儀下行分析,檢測其脂質分子及其相關代謝產物含量。
2. 質譜分析條件 電噴霧電離樣本,利用正離子和負離子模式進行檢測,電噴霧電子源質譜正離子模式檢測:lysophosphatidylcholine(LPC)、lysophosphatidylethanolamine (LPE)及Ceramide(Cer);負離子模式檢測:lysophosphatidic acid(LPA)、lysophosphotidylserine(LPS)及sphingsine-1-phosphate(S1P)。質譜ESI源參數設置:離子源氣1(Gas1)為45,氣簾氣(Cur)為25,離子源氣2(Gas2)為50,電噴霧電壓5500V(正離子模式)/-4500V(負離子模式),離子源溫度500℃。對其優化的每個脂質相對應的母離子、特征子離子、去簇電壓(DP)和碰撞能量(CE),建立質譜mutipul reactions monitor(MRM)模式,并進行定量檢測。
3. PCR 通過PCR檢驗樣本RNA表達量。
四、統計學分析
采用SPSS 23.0 軟件進行統計分析,t檢驗進行組間分析,檢驗水平P<0.05為差異具有統計學意義。通過Spearman相關性分析、主成分分析及其神經網分析,得到影響明顯的脂質代謝物組成成分。社區獲得性肺炎合并膿毒癥診斷中脂質分子相關變化,通過曲線分析評估其準確性。
結 果
一、社區獲得性肺炎合并膿毒癥患者與健康者年齡及性別的比較
兩組患者性別、年齡上的比較,無統計學差異(見表2)。

表2 CAP+sepsis組與NC組年齡及性別的比較
二、社區獲得性肺炎合并膿毒癥患者與健康者血清中脂質含量差異
通過對CAP+sepsis組與NC組血清中脂質各組分進行液相-氣相分析發現,脂質成分含量有明顯差異的有14種,除棕櫚酰神經酰胺(Cer16:0)、硬脂酰神經酰胺(Cer18:0)和花生酸神經酰胺(Cer20:0)在CAP+sepsis組中含量明顯升高(P<0.003),其余組分NC組均明顯低于病例組(P<0.001),差異具有統計學意義,其中,LPE18:1、LPE16:0及LPA18:2差異最明顯(見表3)。
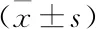
表3 CAP+sepsis組與NC組脂質含量差異比較
三、CAP+sepsis組各脂質組分的等級相關性分析
CAP+sepsis組各脂質組分含量與社區獲得性肺炎合并膿毒癥分別進行等級相關分析(Spearman),Cer16:0、Cer18:0、Cer20:0與社區獲得性肺炎合并膿毒癥為正相關,且具有明顯的統計學差異(P<0.01)。其余脂質組分均呈現負相關,其中LPA18:2、LPA20:4、LPC16:0、LPC18:2、LPE16:0、LPE18:2、LPE18:1負相關系數均大于0.6,所有14組數據Spearman相關均有統計學差異(均P<0.01,見表4)。
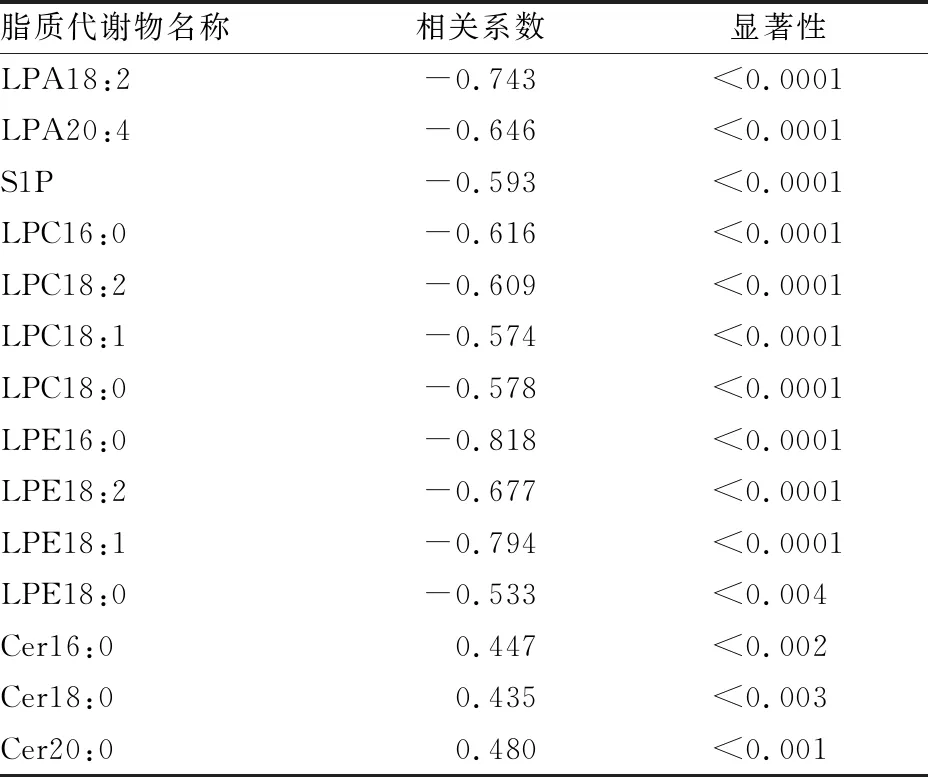
表4 CAP+sepsis組各脂質組分的等級相關性分析(n=30)
四、CAP+sepsis組各脂質組分主成分分析
對CAP+sepsis組各脂質14個組分進行主成分分析(PCA),KMO檢驗系數0.61,Bartlett檢驗P<0.001,提示可以進行主成分分析。結合碎石圖(見圖1),取特征值>1的前4位主成分,分別解釋24.1%、15.9%、11.4%及9.8%的總數據變異,解釋了61.1%的數據變異(累積貢獻率為61.1%,見表5)。應用旋轉成份矩陣分析顯示:LPA 18:2、LPE 18:0及S1P反應第1主成分變化,LPA20:4、LPE18:1及LPC18:1反應第二主成分變化,LPC18:2反應第3主成分、CER16:0反應第4主成分變化。

表5 CAP+sepsis組變量相關矩陣的特征根值
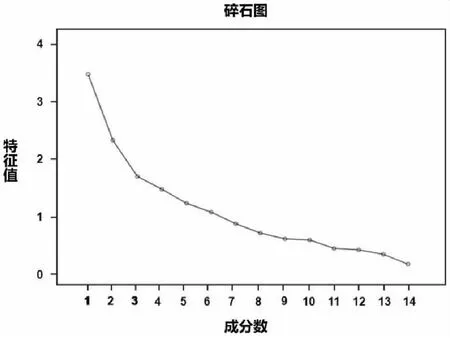
圖1 CAP+sepsis組14個脂質組分主成分分析碎石圖
五、神經網絡多層感知器網絡分析
各個因子變量網絡分析結果在網絡中變量重要性排名(見圖2)。重要性標準化百分比分別為:LPE18:2(100.0%)、LPE16:0(91.2%)、LPA20:4(84.3%)、LPE18:1(73.3%)對膿毒血癥非常重要。
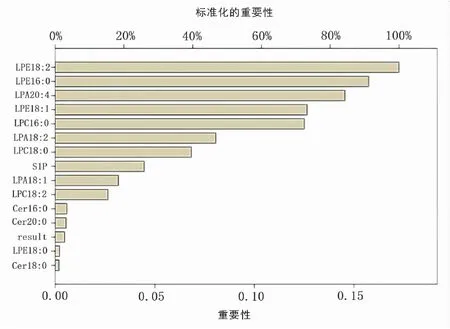
圖2 CAP+sepsis組神經網絡分析各因子重要性排名
六、脂質代謝相關基因定量分析
脂質代謝由復雜的調控通路構成,不同的組織、細胞參與脂質代謝的基因也不同。通過上述脂質代謝分析表明,LPA、LPE在膿毒癥患者中有較大意義。所以,采用實時熒光定量PCR(qRT-PCR)檢測血液中參與LPA、LPE代謝相關的基因的mRNA表達量,其中,合成LPA的ATX、LIPH基因,分解LPA的LPP基因,合成LPE的PLA2G2A、PLA2G15基因,分解LPE的LPEAT2基因,明確LPA、LPE相關代謝通路關鍵酶學的基因變化。結果顯示:合成LPA的ATX和LIPH基因在NC組及CAP+sepsis組分別為1.011 ± 0.057和1.010 ± 0.053及0.352 ± 0.033和0.357 ± 0.018,NC組明顯高于CAP+sepsis組(t=9.99和11.75,均P<0.0001)。分解LPA的LPP基因在NC組及CAP+sepsis組分別為0.366 ± 0.050及1.013 ± 0.060,NC組明顯低于CAP+sepsis組(t=8.299,P<0.0001)。合成LPE的PLA2G2A和PLA2G15基因在NC組及CAP+sepsis組分別為1.031 ± 0.094和1.018 ± 0.070及0.032±0.003和0.390±0.021,NC組明顯高于CAP+sepsis組(t=10.56和8.645,均P<0.0001)。分解LPE的LPEAT2(t=9.077,P<0.0001)基因在NC組及CAP+sepsis組分別為0.870±0.080及0.128±0.015,NC組也明顯高于CAP+sepsis組。
七、膿毒癥相關的脂質組分對膿毒癥的診斷價值分析
過主成分分析篩選出與膿毒癥相關性較強的4種脂質代謝組分LPA 18:2、LPA 18:0(與第1主成分)、LPE 18:1、LPE16:0 (神經網絡前2名)及其代謝通路關鍵酶:合成LPA的ATX、LIPH基因,分解LPA的LPP基因,合成LPE的PLA2G2A、PLA2G15基因,分解LPE的LPEAT2基因,采用ROC曲線對這些指標進行了膿毒癥診斷的靈敏度和特異分析,結果LPA 18:2、LPA 18:0、LPE 18:1及LPE16:0曲線下面積分別為:0.95、0.89、0.87及0.86,LPA18:2的診斷準確性較高(見圖3)。

圖3 CAP+sepsis組LPA 18:2、LPA 18:0、LPE 18:1及LPE16:0 ROC曲線
討 論
膿毒癥具有極高的發病率和死亡率[3],很難早期發現和快速確診,當出現了明顯的癥狀,往往很快惡化為多臟器功能衰竭,增加死亡風險。因此,找到具有高敏感性、高特異性的生物標志物,是實現對社區獲得性肺炎合并膿毒癥的早診斷、早治療、提高其生存率及改善其預后的關鍵措施。目前報道的膿毒癥相關生物標志物已經超過了170種,包括細胞因子類、細胞表面分子、補體、凝血因子、急性時相反應蛋白等,但沒有可以被認定為社區獲得性肺炎合并膿毒癥特異性的診斷標記物[1-4]。雖然C反應蛋白和血清降鈣素原二者均為感染、炎癥相關因子,且較為常用,但也不具備特異性的診斷價值。
有研究表明,脂質的代謝變化與膿毒癥存在相關性[5-6],提示其可能成為潛在診斷社區獲得性肺炎合并膿毒癥的生物標志物。血液樣本是一個復雜的基質,包含一大群甘油脂 (GPs)、糖脂 (SLs)、膽固醇酯 (CEs) 和三酰基甘油 (TGs)。由于血流與生物體中的大多數器官及其單個細胞有關。在比較血漿和血清時,據報道,在血清中可以表征比血漿中更穩定的脂質譜[5-6]。因此,更可靠分析的潛在替代方法是在血清中進行脂質研究和方法開發。結合上述研究背景,本研究通過脂質代謝組學分析,發現了11種在社區獲得性肺炎合并膿毒癥患者血漿中含量明顯降低的脂質(見表3),其中LPA 18:2、LPE 18:1及LPE16:0 是與社區獲得性肺炎合并膿毒癥關聯最緊密的脂質分子,對社區獲得性肺炎合并膿毒癥的預測準確率也高于LPC。同時還存在3種在社區獲得性肺炎合并膿毒癥患者血漿中含量明顯升高的脂質,即Cer16:0、Cer18:0、Cer20:0,與Drobnik等的結果一致[7],其可能與炎癥因子誘發的鞘磷脂代謝增強相關[8];
最近的研究表明,LPA 能夠減輕膿毒癥狀態下的器官損傷,在膿毒血癥中具有抗炎作用[9]。血液中的LPA主要通過兩種途徑合成,ATX與LIPH分別以LPC與PA為底物合成LPA[12]。與此同時,LPP可參與降解LPA,來維持LPA動態平衡。本研究通過RT-qPCR檢測發現膿毒癥患者血液中ATX與LIPH表達量明顯降低,而LPP表達量升高,LPA合成減少并被大量降解,與血液中LPA測定含量降低呈一致性,提示膿毒癥狀態下LPA動態平衡被打破,不能有效維持其代謝水平,促進疾病的發生發展。
溶血磷脂酰乙醇胺 (LPE, Lys phosphatidylethanolamine) 是一種脂質代謝物,由多種細胞產生,參與各種免疫調節反應。研究結果表明LPE對LPS誘導的細胞炎癥和氧化應激具有顯著的保護作用。細胞內的LPE可通過磷脂酶A2(PLA2)合成[10-11],并經乙酰化酶降解[12-13]。PLA2家族有多個成員,其中的PLA2G2A與PLA2G15參與了細胞LPE合成,而參與LPE分解酶卻只有LPEAT2[14-15]。本研究通過RT-qPCR檢測發現膿毒癥患者血液中PLA2G2A與PLA2G15表達量均降低,而LPEAT2表達量也顯著降低,提示膿毒癥患者血液中的LPE可能存在其他代謝途徑參與疾病發生發展。
本研究經液相色譜-質譜聯用分析[8],發現了社區獲得性肺炎合并膿毒癥患者的外周血中,脂質分子的含量與脂質代謝相關基因表達發生了顯著的變化,膿毒癥患者中LPA 18:2、LPA 20:4、S1P、LPC 16:0、LPC 18:2、LPC 18:1、LPC 18:0、LPE 16:0、LPE 18:2、LPE 18:1、LPE 18:0低表達,而Cer16:0、Cer18:0、Cer20:0呈高表達;這種多種脂質小分子的含量變化提示膿毒癥過程中脂質代謝差異可能與炎癥反應中不同的脂質代謝過程相關。而其中LPA 18:2、LPA 18:0、LPE 18:1及LPE16:0 四種脂質代謝組分參與了膿毒癥的瀑布式炎癥反應,經統計分析LPA 18:2、LPA 18:0、LPE 18:1及LPE16:0曲線下面積分別為:0.95、0.89、0.87及0.86,LPA18:2具有極高的膿毒癥診斷敏感性,提示其可以作為社區獲得性肺炎合并膿毒癥診斷的候選生物標志物。但其特異性與敏感性還需要進一步進行大規模驗證,才能為臨床診斷社區獲得性肺炎合并膿毒癥提供準確、新型的生物標志物。
本研究局限性:納入病例的數量較少,因此研究可能存在局限性,后續實驗可以增加病例數量。

