胸部局灶型Castleman病CT影像特征分析(附8例報告)
楊柳青 白奇之 張啟川 張磊
Castleman病(Castleman disease,CD)又被稱為巨大淋巴結增生癥、血管濾泡性淋巴組織增生癥等,是一種病因不明的、少見慢性淋巴組織增生疾病,1956年被Castleman等首次報道[1],可發生在全身任何有淋巴結存在的部位,多發于胸部縱隔(60%~70%),其次頸部、腹腔、腋窩淋巴組織等[2-3], 病理上分為透明血管型、漿細胞型、混合型3種組織學類型,臨床上分為局灶型和多中心型,局灶型中最常見為透明血管型(90%以上)[4],在CT影像上具有一定特征性,通過分析總結其影像特點,有助于認識該病,提高術前影像診斷率,為臨床的治療及手術提供幫助。
資料與方法
一、一般資料
回顧性分析我院2013年2月~2020年4月,經臨床、病理證實為胸部局灶型Castleman病的患者8例,術前進行CT平掃及增強掃描;其中女性患者5例,男性3例,年齡15~52歲,2例患者無臨床癥狀和體征、于體檢時發現,3例因咳嗽咯痰就診、3例因胸悶就診。本研究經過我院醫學倫理委員會批準,倫理審查編號2022-研第042-01。
二、檢查方法
采用GE公司64層螺旋CT掃描儀行檢查,患者采用仰臥、雙手高舉過頭、頭先進體位,吸氣后屏住呼吸,自胸廓入口區連續掃描至雙側肋膈角下方;參數設為管電壓120mV,管電流250mA,層厚5mm、層距5mm,螺距1mm;經肘正中靜脈高壓槍注入非離子型對比劑(碘海醇)60~80mL,注入對比劑25~30s后行動脈期掃描,60~70s后進行靜脈期掃描;獲取數據后行圖像薄層重建(層厚為0.625mm),并傳輸至后處理工作臺,利用多平面重建(Multiplanar reconstruction,MPR)、容積再現技術(Volume reproduction technology,VR)、最大密度投影(Maximum density projection,MIP)后處理圖像。
三、影像分析
由兩名醫師(主治或以上職稱)獨立對圖像行評估分析,得出結論后再進行整合;分析、評估內容包含:1.病灶部位(肺門、縱隔、肺內)、形狀、大小、邊界邊緣、密度、鈣化與否等一般情況;2.觀察增強掃描強化方式,觀察強化均勻與否,強化持續情況,對病灶平掃、兩期增強CT值進行測量,根據病變的強化程度將其分為輕度、中度、明顯強化(最大強化CT值與平掃CT值差值小于20HU即輕度強化,20~40HU間為中度強化,若差值大于40HU即明顯強化);3.分析特征影像表現,1)衛星灶:為病灶周圍環繞的結節狀軟組織密度影,邊界清楚、密度均勻,強化方式與腫塊接近,多為周邊反應增生的淋巴結、滋養血管構成[5];2)裂隙征:增強掃描病灶內條片狀或星芒狀相對較低密度影,但其并非壞死,靜脈期可見延遲強化、條片影范圍則縮小[6];3)供血血管:病灶周圍來自體循環的較粗大的血管,可為一條或多條,增強掃描動脈期病灶即較明顯強化。
結 果
本組8例患者中,女性5例(62.5%),男性3例(37.5%);年齡15~52歲,平均年齡(37.2±11.3)歲;其中2例無癥狀、于體檢發現(25.0%),咳嗽咯痰就診者3例(37.5%)、胸悶就診者3例(37.5%);8例病灶臨床分型均為局灶型,呈單發軟組織結節或腫塊,病理分型均為透明血管型;3例為肺門型(1例位于右下肺門旁、2例右肺門區),3例為縱隔型(1例位于左中上縱隔,1例左后上縱隔、1例右前上縱隔),2例為肺內型(2例位于右肺尖區胸膜下);病灶測值2.5cm×1.6cm~6.2cm×3.7cm,其中7個病灶長徑大于3cm(87.5%)(1例大于5cm);5個病灶呈類圓形(62.5%),3個呈類橢圓外形(37.5%);病灶邊界均清楚光整;7例病灶CT平掃密度均勻,1例欠均,CT值28~58HU,平均CT值40.9±9.1HU,1例病灶內結節狀鈣化。
病灶行增強后測量CT值75~131HU,平均(95.6±17.9)HU,中度強化者2例(25.0%),明顯強化6例(75.0%),最大強化凈增值95HU,其中2例病灶動脈期強化欠均(25.0%)、6例強化均勻(75.0%),8例病灶靜脈期均持續強化(100%)(圖a~c);其中3例病灶周圍多發小結節狀“衛星灶”(37.5%)(圖d),2例見條片、小條狀“裂隙征”(25.0%)(圖e、f),5例見一條或者多條來自胸主動脈分支的供血血管(62.5%)(圖g、h);具體情況(見表1)。
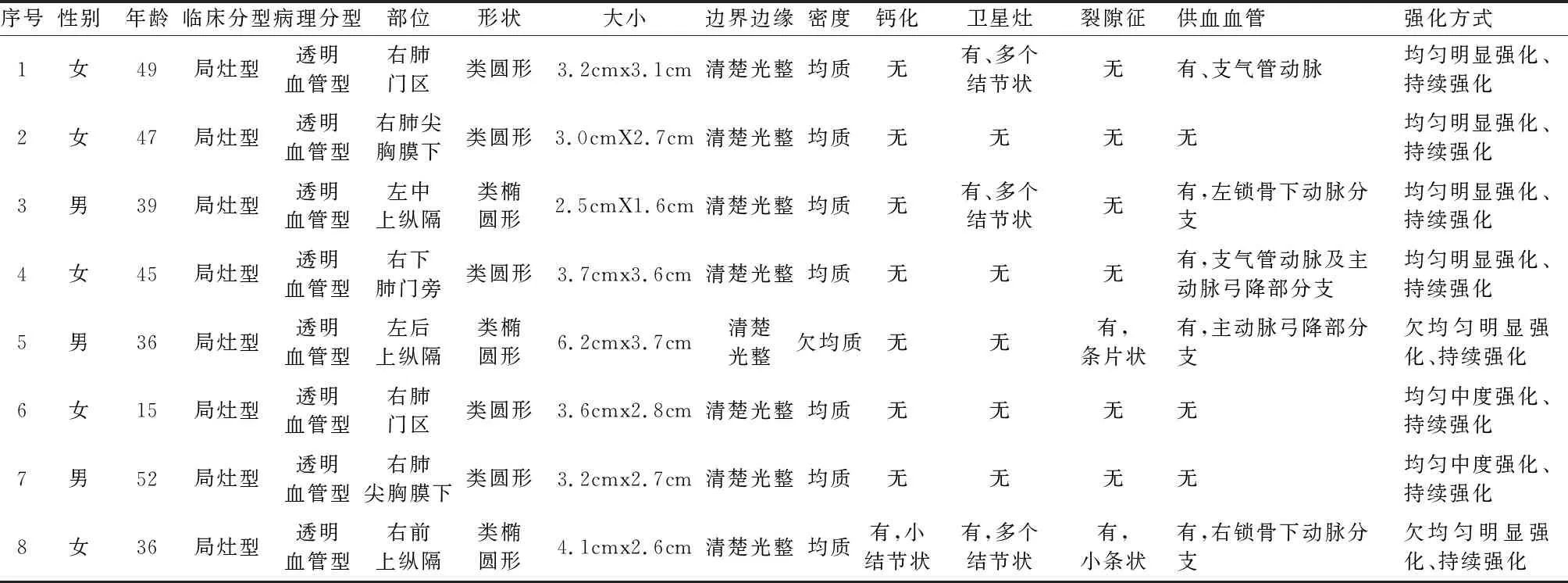
表1 8例胸部局限型Casteman病患者CT影像表現
討 論
Castleman病是一種少見的淋巴組織增生性病變,白細胞介素-6、人類皰疹病毒-8為其發病密切相關因子,也有研究表明炎癥、免疫功能異常、EB病毒感染、巨細胞病毒感染與之相關[7];局灶型Castleman病臨床上多無明顯癥狀、體檢發現,或以單個無痛性腫大淋巴結就診,發病高峰為20~40歲,女性多于男性,常僅累及單個淋巴結區域,以縱隔、頸部及腋下多見[8];胸部局灶型Castelman病按發病部位分為縱隔型(最多見):向一側肺內突起,肺門型:肺門區、支氣管分叉處,肺內型(很少見):可與肺門淋巴結增大共存。
Castleman病的病理特征為淋巴濾泡、血管及漿細胞不同程度的增生,呈增生-異常增殖-腫瘤樣淋巴結增生的過程,為非腫瘤性病變[9];Castleman病分3種組織學類型,包括透明血管型、漿細胞型、混合型,其中80%~90%為透明血管型,其以淋巴濾泡、小血管增生扭曲、透明樣變為主;臨床上分為多中心型與局灶型,其中局灶型以透明血管型最為多見,多中心型則常為漿細胞型[10-11];本文8例胸部局灶型Castleman病患者均為透明血管型,與文獻相符。

圖1 胸部局灶型Castleman病CT影像特征
胸部局灶型Castleman病具備一定的CT影像特點,CT平掃病灶多呈邊界清楚光整、密度均勻的軟組織腫塊,呈類圓形/橢圓形,幾乎不見液化壞死及囊變、出血,本組中8例患者邊界邊緣均清楚光整,形態規則,7例密度均勻,1例欠均,但也并非囊變、出血,這可能與病灶血供豐富、增生的淋巴濾泡不易壞死的原因相關[4,12]。增強掃描動脈期多呈較明顯強化,靜脈期持續強化,強化常均勻(腫塊較大時可不均勻),強化特點與病灶內異常大量扭曲增生、透明變性的毛細小血管有關,小血管雖豐富但管腔較小、血流速度較慢,呈快進慢出的強化方式[13];本組5例病灶早期即顯著強化,這與滋養血管密切相關,該5例病灶可見一條或者多條來自體循環的較粗大供血血管,而且即便病灶較小,也可見較粗大滋養血管,這對診斷具有重大價值[14],通過容積再現技術(VR)、最大密度投影(MIP)對圖像進行后處理,能夠充分顯示供血血管的數量、形態、走行、分布等情況。本組3例病灶周圍多發“衛星灶”形成,這些小結節為反應性增生的淋巴結,在病灶周圍環繞、形如衛星,故得名,強化方式及程度也與主病灶接近,為同一淋巴鏈區,邊界清楚、邊緣光整,是診斷Castleman病較特征的影像表現,利用多平面重建(MPR)可全面觀察周圍情況。約10%胸部病灶伴有分支狀、斑點狀鈣化、結節狀鈣化,并且病灶越大幾率越高,分支狀鈣化形態反應了組織病理學上病灶內鈣化沿增生小血管主干及分支走行,具有一定特征性[15],本組中僅1例患者見結節狀鈣化,并且不是最具特征性的分支狀鈣化,可能與病例樣本數量較少有關,鈣化原因則是由于增生毛細血管管壁增厚,并透明樣、纖維化變性等,鈣鹽沿增生、退變的小血管壁沉著[10,16]。本組2例病灶內可見“裂隙征”,此為增強掃描動脈期病灶內條狀或星芒狀相對密度降低影,乃因增生小血管發生了透明樣變和纖維化,管壁增厚、管腔變窄,造影劑進入緩慢,延遲期逐漸進入從而低密度影范圍縮小,具備一定CT影像特征性[9,17]。
胸部局灶型Castleman病需與其它發生在縱隔、肺內及肺門區的軟組織腫塊相鑒別,1)胸腺瘤:多位于前上縱隔,臨床常出現重癥肌無力,較大者形態、邊界不及Castleman病光滑規則、可有淺分葉,并有囊變壞死及鈣化;2)神經源性腫瘤:多位于后縱隔脊柱旁,呈啞鈴狀沿神經根走行,相應椎間孔擴大,常發生囊變壞死、密度不均勻,強化不均,而局灶型Castleman病密度多均勻;3)硬化性肺泡細胞瘤:好發于中年女性,多無明顯臨床癥狀,表現為邊界清楚、密度均勻的單發軟組織結節、腫塊,增強早期強化即較明顯,可見血管貼邊征、暈征、空氣新月征等影像特點,局灶型Castleman病則可有粗大供血血管、衛星灶等特點;4)結節病:多分布于雙側肺門及縱隔,表現為肺門區淋巴結明顯腫大,鈣化灶及壞死較少見,增強掃描呈中度、均勻強化方式,需與肺門型Castleman病相鑒別,但結節病一般為雙側;5)縱隔淋巴瘤:病灶密度多均勻,易融合成塊、并包繞鄰近血管,強化不及局灶型Castleman病、呈輕中度強化;6)風濕免疫疾病相關性淋巴結腫大:與局灶型Castleman病不同,患者常伴全身癥狀,呈多發腫大淋巴結。
局限型Castleman病首選治療方式為手術切除,外科治療效果較好、預后良好、復發少,有手術禁忌癥的患者可選用小劑量放射治療[14,18];我們通過對該病影像特征的認識和分析,提高術前診斷準確率,可減少病人心理負擔,為臨床治療方案的制定提供幫助。
總之,胸部局灶型Castleman病多無明顯癥狀于體檢發現,CT表現為孤立類圓形軟組織腫塊,常位于肺門、縱隔區,邊界清楚、邊緣光整,密度一般均勻、幾乎無囊變壞死及出血;病灶周圍可見一條或多條較粗大、迂曲的供血血管及多發結節狀“衛星灶”,部分病灶內可出現分支狀、結節狀鈣化,CT增強動脈期較明顯強化、靜脈期持續性強化,部分可見延遲期范圍縮小或消失的低密度“裂隙征”,這些征象都是對局灶型Castleman病的重要提示;熟練掌握了這些影像特點,有助于認識該病、提高診斷水平。

