蒙古冰草ERF轉錄因子生物信息學及其表達分析
吳 婧,范菠菠,張學峰,宋金微, 房永雨,于 卓,閆秀秀,趙 彥,馬艷紅*
(1.內蒙古農業(yè)大學農學院,內蒙古 呼和浩特 010019;2.內蒙古自治區(qū)農牧業(yè)科學院,內蒙古 呼和浩特 010031;3.內蒙古農業(yè)大學草原與資源環(huán)境學院,內蒙古 呼和浩特 010018)
轉錄因子(Transcription Factors,TFs)在植物中是一種最重要的一類調節(jié)基因,可與真核生物基因的啟動子區(qū)域中順式作用元件發(fā)生特異性結合的DNA結合蛋白,通過與其他蛋白相互作用,激活或抑制基因轉錄[1]。根據(jù)DNA結構域的特點,將轉錄因子分為若干個家族,如WRKY,AP2/EREBP,NAC,MYB,BZIP,其中AP2/EREBP是植物中分布廣泛的一類轉錄因子[2]。根據(jù)AP2/EREBP轉錄因子保守結構域的不同,AP2/ERFBP家族被進一步分為AP2,RAV,DREB,ERF和Soloist五個亞族[3]。ERF是AP2/ERFBP家族中最大的一類亞族[4]。ERF轉錄因子參與植物多種生物學過程,與非生物脅迫密切相關,如干旱[5-6]、低溫[7]、高鹽[8]、病害[9]。ERF轉錄因子通過參與乙烯、脫落酸、茉莉酸和水楊酸等信號轉導途徑,調控下游基因的表達,從而綜合提高植物的抗逆性[10]。到目前為止,在PlantTFDB數(shù)據(jù)庫中,共收錄了166種作物的ERF轉錄因子,共有21 129個。
干旱是限制植物生長的重要因素,會誘導植物發(fā)生滲透失衡等不良反應,妨礙植物各階段的生長發(fā)育和代謝,進而影響農作物的產量[11]。大量研究表明,ERF轉錄因子參與干旱脅迫,如擬南芥(Arabidopsisthaliana)DREB2A基因的表達受脫水誘導引起植株矮化[12]。大豆(Glycinemax)在模擬干旱條件下,轉基因煙草GmERF3[13]過表達,導致游離脯氨酸含量多于野生型煙草,可提高煙草的抗旱性,大豆GmERFb對干旱產生響應[14]。小麥野生近緣植物纖毛鵝觀草(Roegneriaciliaris(Trin.)Nevski)中的RcDREB1基因對干旱、高鹽和重金屬非生物脅迫產生應答[15]。小麥(Triticumaestivum)TaERF1在干旱脅迫和外源ABA、乙烯和水楊酸的誘導條件下,TaERF1過表達可激活與逆境相關的基因[16]。粳稻(Oryzasativa)中第Ⅶ亞族的ERF轉錄因子OsLG3通過誘導活性氧可提高旱稻的抗旱能力[17],OsERF3基因其含有EAR抑制結構域基序,對干旱脅迫起負調控作用[18]。
蒙古冰草(AgropyronmongolicumKeng)原名沙蘆草,抗逆性強,是優(yōu)質的多年生二倍體禾本科牧草[19]。迄今,體內的多種抗逆基因尚未被發(fā)現(xiàn),作為小麥族牧草,研究蒙古冰草的抗逆基因對牧草及麥類的遺傳改良具有重要意義。ERF參與植物生長和逆境脅迫響應,但蒙古冰草ERF轉錄因子的研究尚屬空白。本研究基于干旱脅迫下蒙古冰草的RNA-Seq,旨在篩選可能與抗旱相關的ERF轉錄因子,為下一步開展蒙古冰草抗旱基因功能解析奠定理論基礎。
1 材料與方法
1.1 試驗材料與處理
本試驗材料為蒙古冰草(A.mongolicumKeng),種子采自于內蒙古農業(yè)大學薩拉齊牧草繁種基地。挑選顆粒飽滿的種子于室內培養(yǎng)箱(BIC-300)水培生長,溫度為(24±1)℃、光周期為16 h,在三葉一心時期用含25%的PEG-6000的1/5 Hoagland’s營養(yǎng)液進行模擬干旱處理,同時設置對照處理(CK),之后在干旱12 h,24 h,48 h,3 d,5 d,7 d及復水24 h取樣,每個處理時期3次重復,提取total RNA,委托杭州聯(lián)川生物技術股份有限公司進行轉錄組測序[20]。
1.2 蒙古冰草ERF轉錄因子篩選
從干旱脅迫下蒙古冰草轉錄組測序數(shù)據(jù)中(NCBI Bioproject accession number PRJNA742257,SRA accession number SUB9924544 and SUB9990857),根據(jù)功能注釋初步篩選出41個ERF轉錄因子,利用notepad++軟件找到核苷酸序列,用NCBI中的ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder)閱讀框將核苷酸序列翻譯成氨基酸序列,使用PlantTFDB中的Prediction(http://planttfdb.gao-lab.org/prediction.php)進行分析,篩選出具有ERF結構域的氨基酸序列,然后用該網(wǎng)站中的BLAST(http://planttfdb.gao-lab.org/blast.php)與所有的物種進行同源比對,除去與其他物種無同源性的ERF蛋白序列。
1.3 蒙古冰草ERF轉錄因子理化性質分析及亞細胞結構定位
利用在線分析軟件Expasy中的ProtParam(https://web.expasy.org/protparam/)[21]對篩選出的蒙古冰草ERF轉錄因子的氨基酸數(shù)目、相對分子質量、PI值、脂肪指數(shù)、親疏水性的理化性質進行分析;用Cell-PLOC 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)[22]對蒙古冰草ERF轉錄因子進行亞細胞結構定位預測。
1.4 蒙古冰草ERF轉錄因子保守基序及序列比對
用在線分析軟件The MEME Suite中的MEME(https://meme-suite.org/meme/tools/meme)[23]對篩選出來的蒙古冰草ERF轉錄因子的保守基序進行分析;使用DNAMAN軟件進行多序列比對,然后用WebLogo 3(http://weblogo.threeplusone.com/)[24]對蒙古冰草ERF保守結構域進行預測。
1.5 蒙古冰草ERF進化關系分析
通過NCBI(https://www.ncbi.nlm.nih.gov/)和UniProt(https://www.uniprot.org/)數(shù)據(jù)庫、PlantTFDB(http://planttfdb.gao-lab.org/index.php)的ERF數(shù)據(jù)庫,篩選出具有抗旱功能的13條擬南芥(Arabidopsisthaliana)、6條山羊草(Aegilopstauschii)、9條二穗短柄草(Brachypodiumdistachyon)、4條大麥(Humuluslupulus)、5條秈稻(Oryzasativasubsp.indica)、8條粳稻(Oryzasativasubsp.japonica)、4條小麥(Triticumaestivum)的ERF氨基酸序列,并與蒙古冰草的ERF轉錄因子的氨基酸序列用MEGA7.0[25]的Muscle進行多序列比對,用相鄰連接法(neighbor-joining)構建系統(tǒng)進化樹。設置校驗參數(shù)Boostrap為1000,其他參數(shù)均設為默認值。用EvolView(https://evolgenius.info//evolview-v2/#mytrees/1/2)[26]將進化樹進行美化。

表1 已報道抗旱相關ERF轉錄因子
1.6 蒙古冰草ERF轉錄因子二、三級結構預測
利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page= npsa_ sopma.html)對蒙古冰草ERF轉錄因子二級結構預測分析,并用SWISS-MODEL(https://swissmodel.expasy.org/)在線軟件的同源建模法對其三級結構進行預測分析。
1.7 不同干旱處理蒙古冰草ERF轉錄因子基因差異表達分析
蒙古冰草轉錄組數(shù)據(jù)庫使用TPM(Transcripts per million)對樣本表達量進行歸一化處理,利用DESeq2軟件分析不同處理間的差異基因。用軟件Heml對蒙古冰草ERF轉錄因子的共表達模塊與性狀矩陣進行關聯(lián)分析,并用Color Dialog對其進行顏色處理,分析其在不同干旱處理下的差異表達情況。
1.8 蒙古冰草ERF轉錄因子qRT-PCR
使用primer premier 5將篩選出的可能具有抗旱功能的蒙古冰草ERF轉錄因子(AmERF053,AmERF1B,AmERF4-1,AmERF4-2)進行引物設計,以U6作為內參基因,(引物序列見表2),然后將引物委托上海生工(Sangon,上海)進行序列合成。

表2 蒙古冰草抗旱相關ERF基因qRT-PCR引物序列
使用Trizol法提取蒙古冰草CK,干旱處理1 d,3 d,5 d,7 d及復水24 h的總RNA,使用FastKing RT Kit(with gDNase)試劑盒將蒙古冰草處理組及對照組的Total RNA反轉錄為cDNA,用MonAmp SYBR Green qPCR Mix試劑盒(MQ10201S)進行qRT-PCR試驗,每個處理4次生物學重復。qRT-PCR總反應體系為20.0 μL,其中上下游引物(10 μM)各0.4 μL,cDNA模板1.2 μL,Nuclease-Free Water 8 μL,MonAmp SYBR Green qPCR Mix試劑10 μL。反應程序為預變性95℃,30 s,變性95℃,10 s,退火61℃,10 s,延伸72℃,30 s,循環(huán)數(shù)為40,在FTC-3000P上運行程序。按照2-ΔΔCT法[35]計算基因的相對表達量,并使用SPSS 26.0軟件對其差異顯著性分析。
2 結果與分析
2.1 蒙古冰草ERF基因篩選
從蒙古冰草轉錄組數(shù)據(jù)庫中的41 793條Unigenes中篩選出41個ERF基因,通過ORF和結構域預測分析,獲得具有ERF結構域的25個基因。BLAST序列比對發(fā)現(xiàn),有18個與其他物種具有親緣關系,其中DN17657_c2_g1,DN22794_c0_g6,DN22189_c0_g1與山羊草(Aegilopstauschii)親緣關系最近,相似度在66%~84%之間;DN20439_c0_g14,DN22390_c0_g1,DN25557_c0_g6,DN23100_c2_g10,DN22189_c1_g2,DN19595_c1_g1與小麥(Triticumaestivum)親緣關系最近,相似度在61%~78%;DN26859_c0_g2,DN25557_c0_g4,DN25557_c0_g1,DN26859_c0_g7,DN22794_c0_g2與大麥(Hordeumvulgare)親緣關系最近,相似度在55%~70%之間;DN19955_c0_g1與二穗短柄草(Brachypodiumdistachyon)親緣關系最近,相似度為50%;DN26921_c0_g2與擬南芥(Arabidopsisthaliana)親緣關系最近,相似度為79%,表明從蒙古冰草的ERF轉錄因子基因結構具有保守性,與山羊草(A.tauschii)、小麥(T.aestivum)、大麥(H.vulgare)同源性較高。
2.2 蒙古冰草ERF轉錄因子理化性質及亞細胞定位分析
18個蒙古冰草的ERF轉錄因子氨基酸數(shù)目在70 aa~404 aa之間,相對分子質量介于7 447.54~43 654.9之間;理論等電點(PI)在4.53~11.10之間,有11個ERF轉錄因子理論等電點小于7、呈現(xiàn)酸性,有7個ERF轉錄因子大于7、呈現(xiàn)堿性;脂肪族指數(shù)最小為47.61,最大為75.71;有16個ERF轉錄因子總平均親水性小于0,為親水性蛋白,僅有兩個總平均親水性大于零,為疏水性蛋白(表3)。
蒙古冰草ERF轉錄因子基因亞細胞定位分析,有13個ERF轉錄因子定位在細胞核中,AmERF071,AmERF014定位在細胞質中,AmERF008存在于細胞核和細胞質中,AmERF3-2定位在細胞膜上,AmERF110-2定位在細胞外,表明ERF轉錄因子基因主要在細胞核中發(fā)揮功能(表3),少數(shù)在細胞質、細胞膜、細胞外發(fā)揮功能。
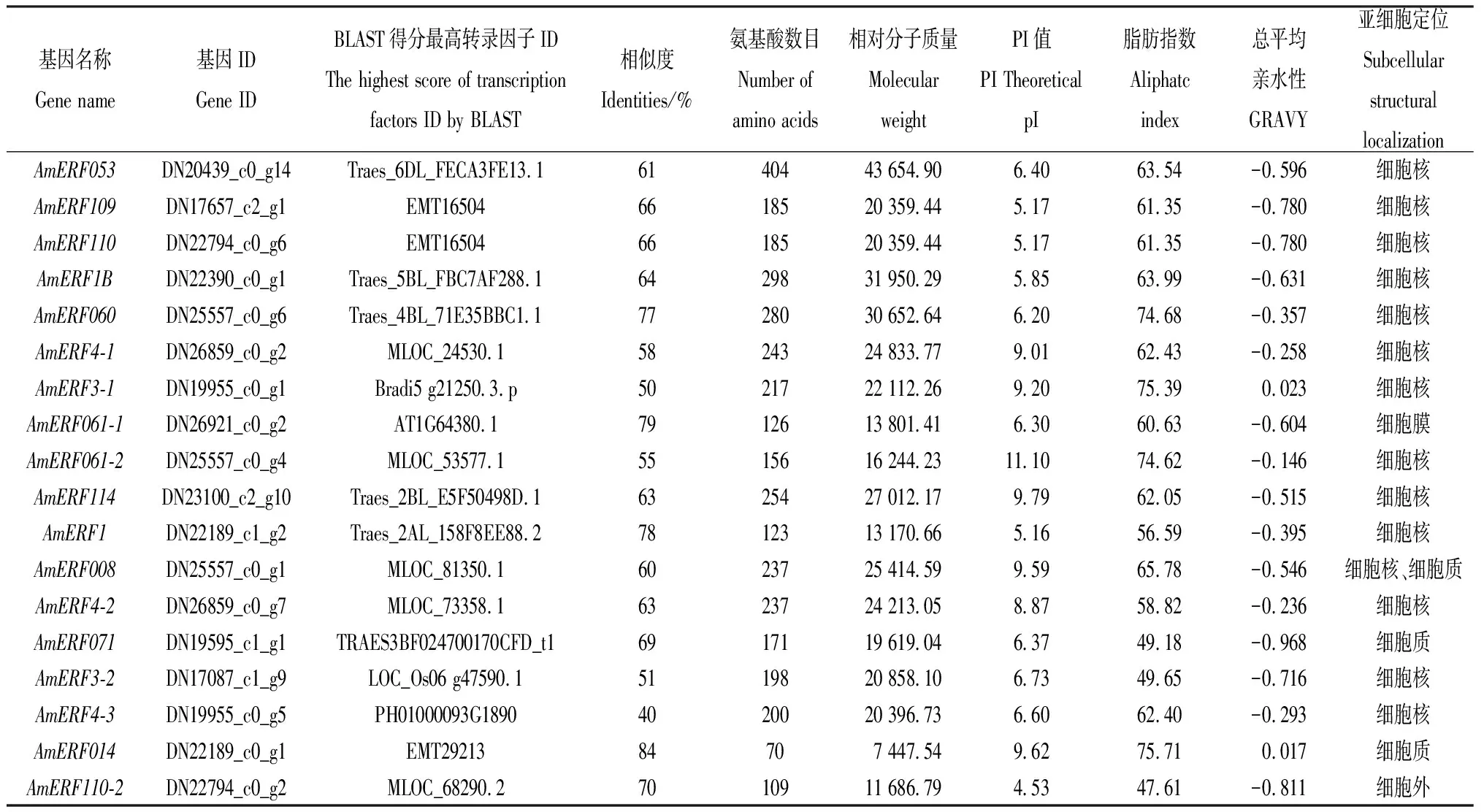
表3 蒙古冰草ERF轉錄因子理化性質及亞細胞定位
2.3 蒙古冰草ERF轉錄因子基序分析
蒙古冰草ERF轉錄因子保守基序分析發(fā)現(xiàn)7種motif(圖1),有16個ERF轉錄因子氨基酸序列出現(xiàn)保守的motif,AmERF061-1和AmERF110-2轉錄因子不含有motif。在含有motif的序列中,有15個ERF轉錄因子含有motif2、14個ERF轉錄因子含有motif1、13個ERF轉錄因子含有motif3、6個ERF轉錄因子含有motif6、2個ERF轉錄因子含有motif7、2個ERF轉錄因子含有motif5,同時含有基序motif1,motif2,motif3的序列有12個,出現(xiàn)的次數(shù)最多。motif1特征基序的(x)GRR(x)EI、motif2基序(x)RWLG(x)AA(x)D和motif3基序(x)G(x)N(x)構成AP2的結構域特征序列,且motif1,motif2,motif3通常以串聯(lián)形式在一起,所以推測motif1,motif2,motif3基序為蒙古冰草ERF轉錄因子的保守基序(圖2)。
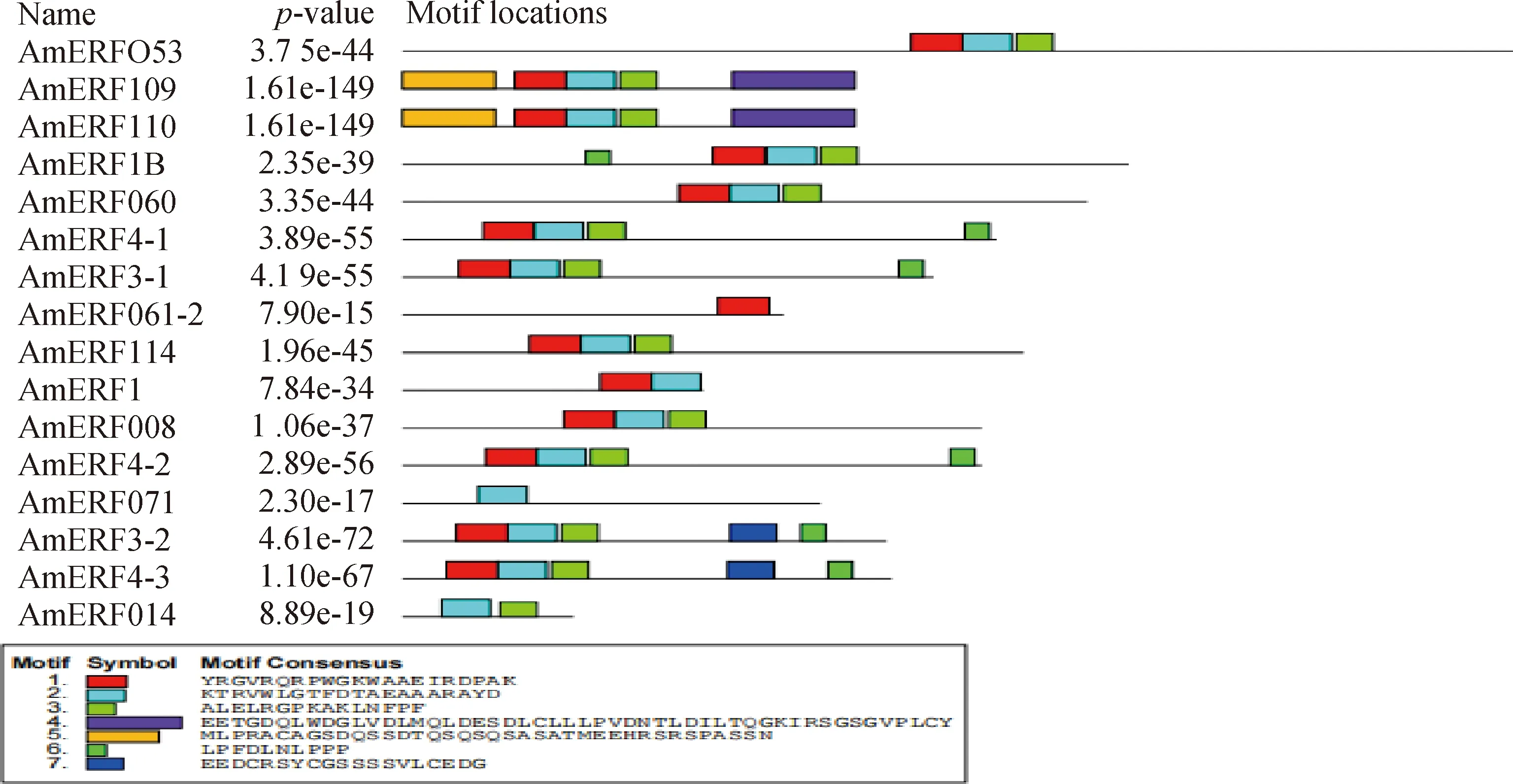
圖1 蒙古冰草ERF轉錄因子基序分析
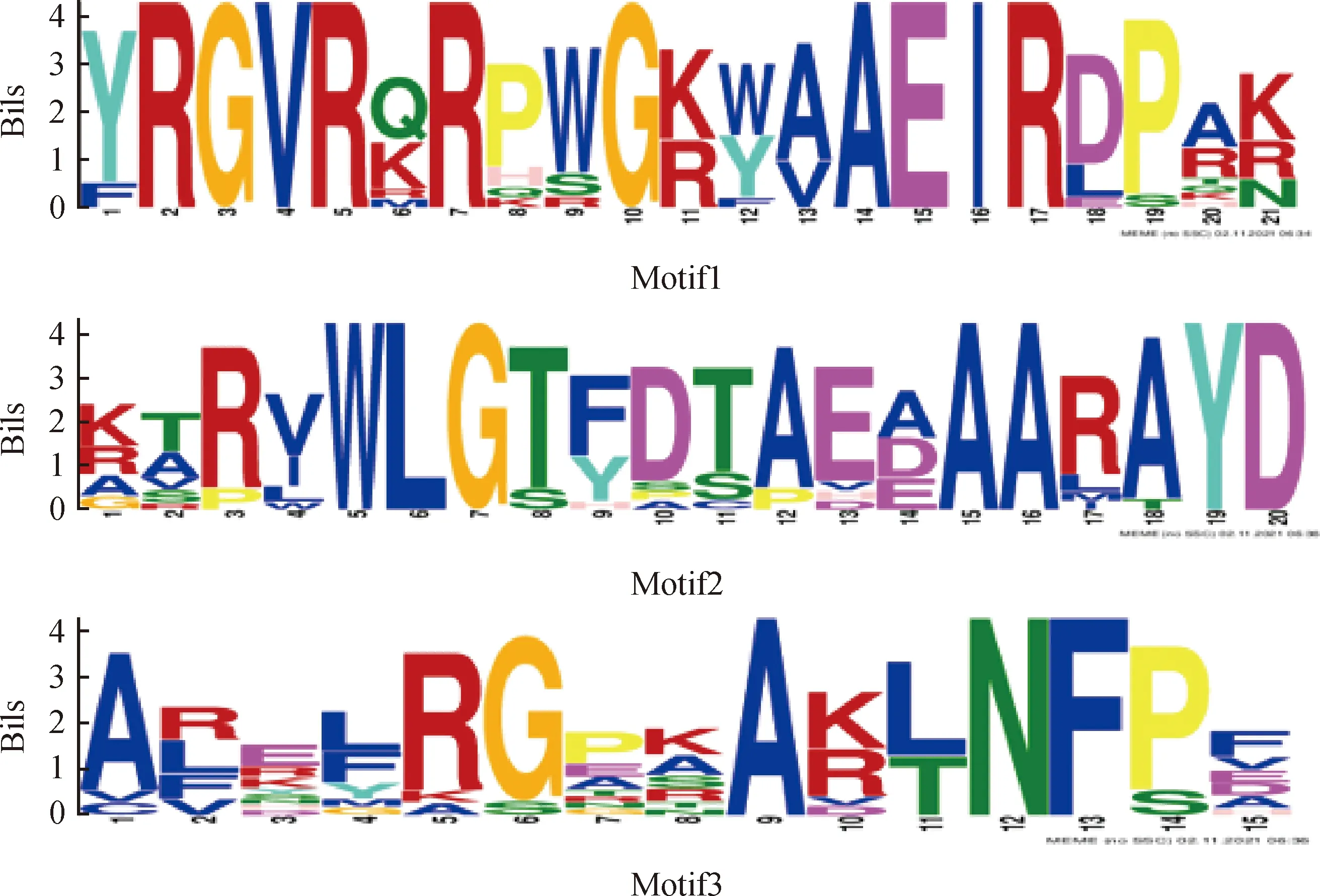
圖2 蒙古冰草ERF轉錄因子的保守基序
通過DNAMAN軟件對18個蒙古冰草ERF基因編碼的氨基酸序列進行多序列比對,發(fā)現(xiàn)AmERF061-1,AmERF061-2,AmERF1,AmERF014,AmERF110-2不具有AP2結構域,AmERF061-1和AmERF061-2氨基酸序列發(fā)生變化,AmERF1的C端發(fā)生缺失,AmERF014的N端發(fā)生缺失,AmERF110-2的N端發(fā)生變化、而C端發(fā)生缺失(圖3)。用WebLogo3分析18個蒙古冰草ERF轉錄因子的保守性,其存在AP2結構域特征序列(x)GRR(x)EI(x)RWLG(x)AA(x)D(x)G(x)N(x),在第二個β-折疊中第14位氨基酸是丙氨酸(A),19位是天冬氨酸(D)(圖3,圖4)。

圖3 蒙古冰草ERF家族基因的氨基酸序列比對
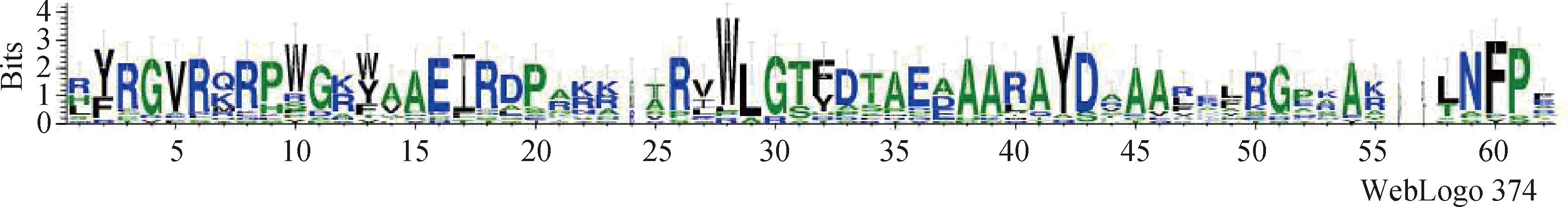
圖4 蒙古冰草ERF轉錄因子家族的保守結構域
2.4 蒙古冰草ERF轉錄因子進化關系分析
本研究將蒙古冰草ERF與玉米(Zeamays)ZmDREB160,大豆GmERF4,GmERF6,馬鈴薯(Solanumtuberosum)StERF1,小麥TaERF1等具有抗旱功能的轉錄因子構建進化樹,結果將ERF轉錄因子劃分為10個亞族,其中有5個亞族不含有蒙古冰草ERF轉錄因子。第Ⅰ亞族和第Ⅴ亞族分別有1個ERF轉錄因子,AmERF008劃分在第Ⅰ亞族,AmERF014劃分在第Ⅴ亞族;第Ⅱ亞族中有3個ERF轉錄因子,分別是AmERF071,AmERF061-1,AmERF061-2,AmERF053和AmERF060兩個轉錄因子劃分在第Ⅵ亞族,其中AmERF053與擬南芥AT2G20880.1(AtERF53)聚為一個分支;第Ⅲ亞族是最大的亞族,共有10個蒙古冰草ERF轉錄因子在此亞族中,其中AmERF3-1,AmERF4-3,AmERF1聚在一個分支,AmERF3-2,AmERF114,AmERF110,AmERF109聚在一個分支上,AmERF4-1與大豆GmERF6、馬鈴薯StERF1、擬南芥AtERF9在一個小分支,AmERF4-2與大豆GmERF4聚在一個小分支,AmERF1B與擬南芥AtERF11在一個分支。根據(jù)MEGA分族及各族的成員推測蒙古冰草ERF轉錄因子的功能,StERF1,AtERF9,GmERF6,GmERF4,AtERF11,AtERF53這些轉錄因子均被證明與干旱脅迫相關,根據(jù)以上結果推測蒙古冰草AmERF4-1,AmERF4-2,AmERF1B,AmERF053也具有相似的功能,可能參與干旱脅迫響應。
2.5 蒙古冰草ERF基因不同干旱處理表達模式分析
蒙古冰草在干旱處理 12 h,24 h,48 h,3 d,5 d,7 d、復水 24 h及對照(CK)情況下,其中15個ERF基因表達量呈顯著差異表達(圖6)。基因表達量的大小與數(shù)值有關,數(shù)值越大表達量越大,表達量越大越接近紅色,表達量越小越接近藍色。6個ERF基因表達量較高,其中AmERF3-1基因表達量最高。AmERF110和AmERF061-1兩個基因有表達,但是表達量較低在0~2之間,視為無效表達。隨著干旱處理時間延長,AmERF053,AmERF4-1,AmERF3-1,AmERF3-2,AmERF109和AmERF114共6個基因表達量呈現(xiàn)上調趨勢,AmERF1B,AmERF071,AmERF110-2,AmERF060共4個基因的表達量隨著干旱處理的進程呈現(xiàn)先升高后降低的趨勢,復水24h上調,隨著干旱處理的進程AmERF1基因表達量與CK相比較呈現(xiàn)先降低后升高的趨勢,AmERF4-2和AmERF061-2基因表達量隨著干旱處理過程中先升高后降低再升高。雖然都屬于ERF家族,但ERF轉錄因子在不同干旱處理下表達模式存在差異。
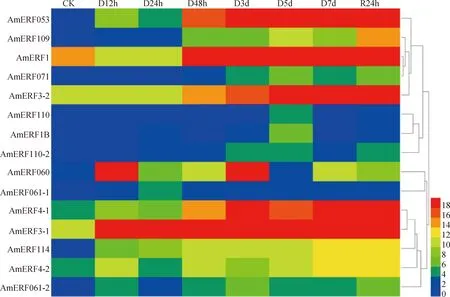
圖6 蒙古冰草ERF基因不同干旱表達模式
2.6 蒙古冰草抗旱相關的ERF轉錄因子二、三級結構
對蒙古冰草AmERF053,AmERF1B,AmERF4-1和AmERF4-2轉錄因子進行二級結構預測,主要以無規(guī)則卷曲為主,分別占59.03%,51.85%,61.32%和51.05%,其次是α-螺旋,分別占26.65%,34.68%,22.22%和32.49%,延伸鏈分別占9.69%,9.43%,12.35%和10.97%,β-折疊分別占4.63%,4.04%,4.12%和5.49%,表明4個蒙古冰草抗旱相關的ERF轉錄因子的二級結構主要以無規(guī)則卷曲和α-螺旋為主。
根據(jù)SWISS-MODEL的同源建模法對AmERF053,AmERF1B,AmERF4-1和AmERF4-2四個ERF轉錄因子的三級結構建模結果顯示(圖8),4個ERF三級結構都與擬南芥的ERF轉錄因子相匹配,含有AP2結構域,符合ERF結構域特征,三級結構與二級結構相吻合,且有1個α-螺旋,3個β-折疊的空間結構。
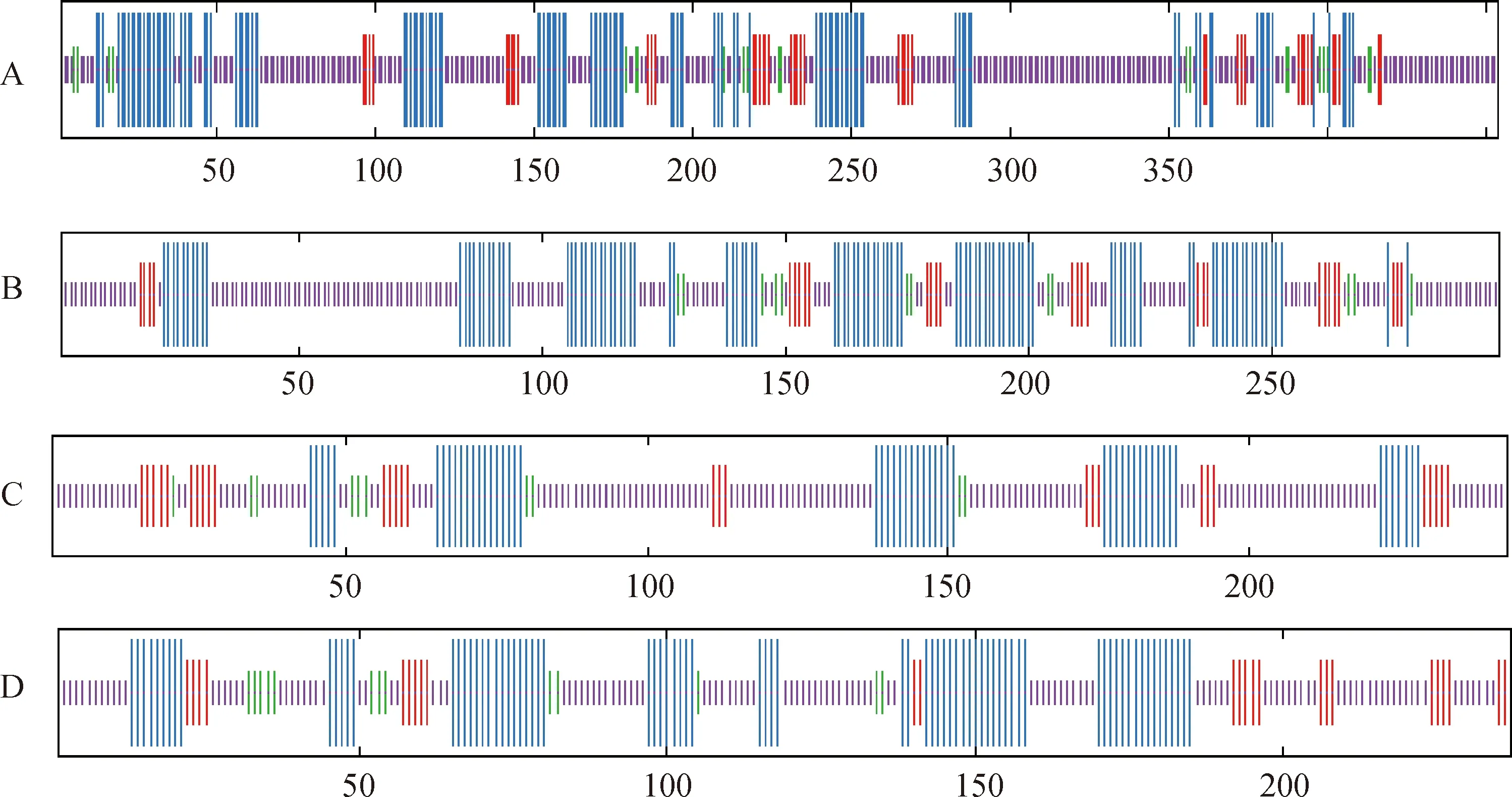
圖7 蒙古冰草ERF轉錄因子二級結構預測
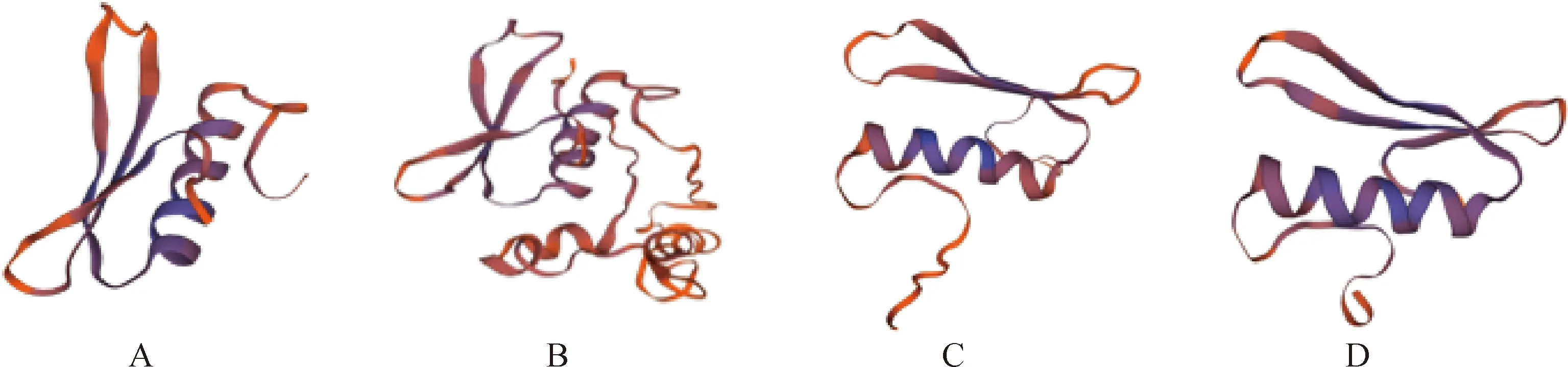
圖8 蒙古冰草ERF轉錄因子三級結構
2.7 蒙古冰草ERF基因的表達分析
對篩選出的與抗旱相關的蒙古冰草4個ERF基因進行RT-qPCR分析,4個ERF基因對干旱脅迫響應程度不同,AmERF053,AmERF1B和AmERF4-1呈現(xiàn)上調表達;AmERF053和AmERF1B兩個基因在5 d表達量最高,AmERF4-1在3 d表達量最高;AmERF4-2各個處理組的表達量均低于CK,呈現(xiàn)下調表達。在0.05水平上,4個ERF基因的處理組表達量均與CK的表達量存在顯著性差異,說明蒙古冰草ERF家族基因參與蒙古冰草對干旱脅迫的響應。
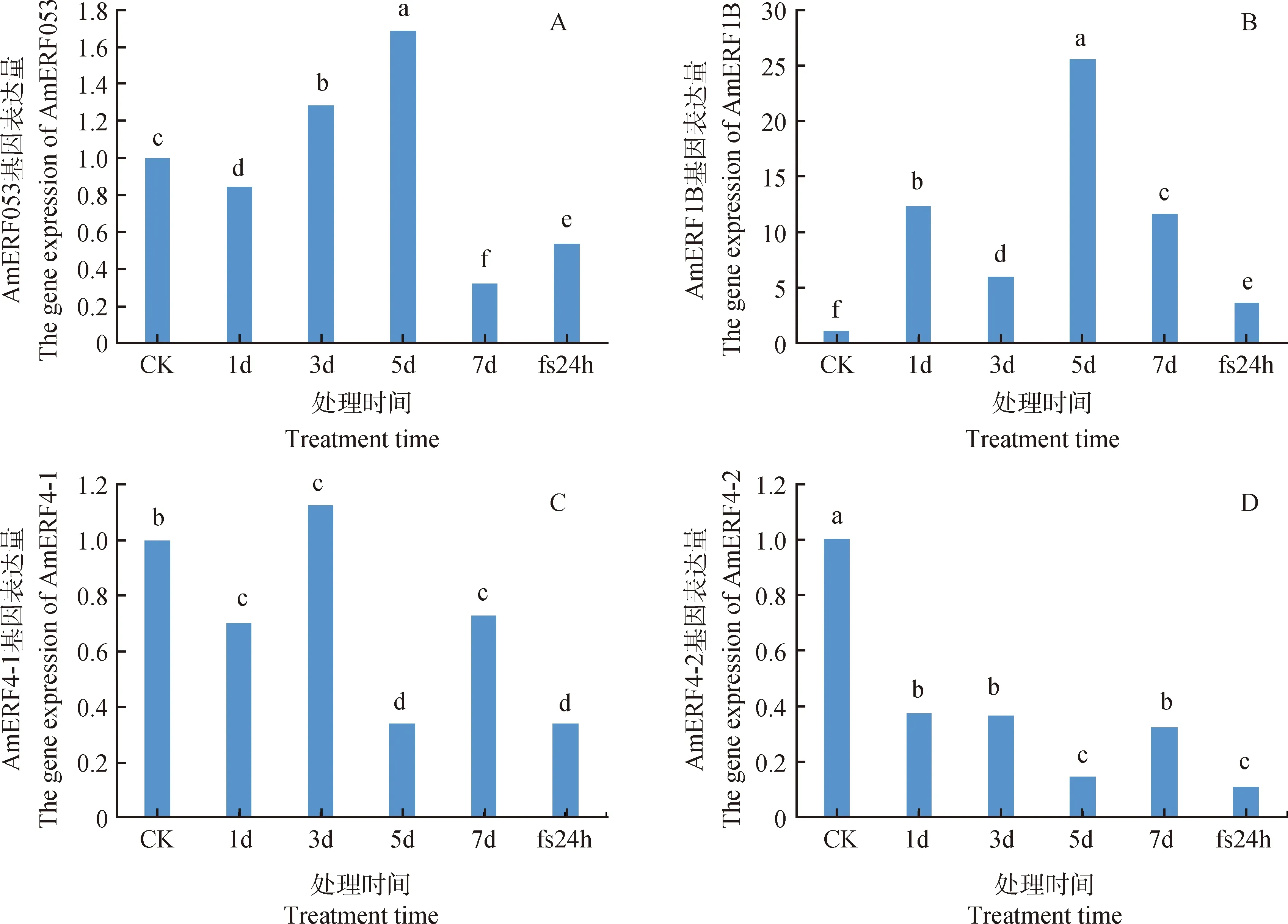
圖9 干旱脅迫下蒙古冰草抗旱相關的ERF基因相對表達量
3 討論
為篩選蒙古冰草抗旱相關的ERF轉錄因子,本研究基于生物信息分析,篩選出25個具有ERF結構域的基因,通過BLAST序列比對發(fā)現(xiàn),18個序列與其他物種具有親緣關系,7個序列與其他物種無親緣關系,總共篩選出16個具有AP2保守結構域的ERF轉錄因子。ERFs一般含有1個AP2保守結構域,AP2結構域由60~70個氨基酸殘基組成[36],蒙古冰草ERF的AP2結構域N端含有3個β-折疊片段,C端有1個α-螺旋片段,在N端含有YRG保守元件,呈堿性,C端含RAYD保守元件,這可能與其他蛋白互作有關[37],蒙古冰草ERF的AP2序列與大豆[38]、油橄欖(Oleaeuropaea)[39]ERF家族氨基酸序列一致。在同一基因家族中,擁有共同的保守基序可能發(fā)揮相似的功能[40]。在蒙古冰草ERF轉錄因子保守基序分析中,共出現(xiàn)了7個motif,其中motif1,motif2和motif3出現(xiàn)次數(shù)最多,通常以串聯(lián)形式出現(xiàn),是其共同含有的保守基序,motif1含有YRG保守原件,motif2含有RAYD保守原件,與桃、蘋果、擬南芥ERF轉錄因子家族具有相似的結構[41-43]。
通過對蒙古冰草ERF轉錄因子的理化性質分析發(fā)現(xiàn)大多數(shù)為親水性蛋白,與馬鈴薯StERF109的ERF蛋白親疏水性保持相似[44]。亞細胞定位表明蒙古冰草ERF轉錄因子大多數(shù)在細胞核中發(fā)揮功能,少數(shù)在細胞質和其他部位發(fā)揮功能,和木薯(Manihotesculenta)[45]、小麥[46]亞細胞定位情況相似。根據(jù)4個ERF蒙古冰草轉錄因子的二、三級結構的結果顯示,ERF主要以無規(guī)則卷曲為主,α-螺旋次之,與小黑楊(Populussimonii×P.nigra)ERF723[47]的二、三級結構相似,其三級結構有些差異,可能其所處亞族不同,這些差異與α-螺旋、β-折疊和無規(guī)則卷曲的長度有關,這些差異會使其發(fā)揮不同的功能[48]。
ERF轉錄因子在植物生長發(fā)育和抵御外界脅迫發(fā)揮著不同的作用[49]。蒙古冰草ERF轉錄因子和具有抗旱功能的ERF轉錄因子進行系統(tǒng)進化關系分析,擬南芥AtERF9[33],AtERF11[34],AtERF53[32]與GCC box或下游基因啟動子的脫水反應元件結合,調控干旱應答基因的表達從而提高植株的抗旱能力。將大豆GmERF6[29]基因轉入到擬南芥中,經(jīng)過斷水處理與野生型植株相比較,轉基因植株的種子發(fā)芽率高且正常生長、開花,在干旱脅迫下,GmERF4[28]在干旱處理后24 h內基因表達量顯著增加。StERF1在干旱處理后SDR(短鏈脫氫酶)、游離脯氨酸、丙二醛(MDA)等含量明顯增加,轉基因植株的株高、莖高、根長、鮮重等指標都高于未轉基因的植株,過量表達的StERF1可提高馬鈴薯的抗旱能力[30]。這些均被證明與干旱脅迫響應有關,且與蒙古冰草有較高的同源性,進而推測蒙古冰草AmERF4-1,AmERF4-2,AmERF1B,AmERF053也具有相似的功能,可能參與干旱脅迫響應。
經(jīng)過qRT-PCR驗證4個蒙古冰草ERF基因處理組的表達量與CK組相比較存在顯著性差異,既有正向調控又有負向調控,AmERF053,AmERF1B和AmERF4-1呈現(xiàn)上調表達,與趙夢雨研究結果一致,其通過qRT-PCR分析結果表明,苦蕎(Fagopyrumtataricum)FtDREB6轉錄因子在干旱脅迫下起正調控作用[50],趙彥對蒙古冰草MwDREB3基因進行實時熒光定量RT-PCR,結果分析表明MwDREB3在干旱脅迫下表達量上調[51]。AmERF4-2呈現(xiàn)下調表達,目前,關于ERF基因下調表達的研究較少較少,從水稻中發(fā)現(xiàn)OsERF109基因通過抑制乙烯的釋放從而對水稻的抗旱性起負調控作用[52]。
4 結論
本研究基于蒙古冰草轉錄組測序數(shù)據(jù)篩選出41個ERF轉錄因子,其中18個具有ERF結構域特征,通過對其保守基序、保守結構域、進化關系及表達模式分析,獲得4個可能具有抗旱功能的蒙古冰草ERF轉錄因子,其二、三結構主要以無規(guī)則卷曲為主。對4個ERF基因進行差異表達分析,qRT-PCR結果分析表明AmERF053,AmERF1B和AmERF4-1起正調控作用,AmERF4-2呈現(xiàn)負調控作用。

