參附注射液對阿霉素誘導的心力衰竭大鼠腸道細菌多樣性的影響
趙震宇, 胡炎芝, 董振華, 劉嘉豪, 張曦寧, 李 琳,2*
(1.湖南中醫藥大學,湖南 長沙 410208;2.湖南中醫藥大學中醫診斷研究所,湖南 長沙 410208)
心力衰竭是一種復雜的臨床綜合征,是許多心血管疾病發展的晚期[1]。很多疾病可以引起心衰,包括心肌病、心臟瓣膜病、糖尿病、肥胖等[2-3]。據統計,全球約6 300萬人患有此病,約50%的患者在最初診斷后的5年內死亡,超過了大多數類型的癌癥,已成為一種全球健康的負擔[4]。近年來心力衰竭以西醫治療為主,但副作用明顯,如應用利尿劑引起的低鈉血癥常導致神志不清、跌倒和痙攣等虛弱癥狀[5]。鑒于目前西醫治療心衰的困境,人們開始在中醫藥領域尋求“解藥”,包括參附注射液在內的多種中藥注射劑已經廣泛用于臨床,療效明確[6]。近年來許多心力衰竭與腸道菌群的相關研究證實,腸道菌群可通過介導三甲胺(TMA)/三甲胺氧化氮(TMAO)、短鏈脂肪酸、膽汁酸等代謝途徑參與心力衰竭的發生與發展[7]。參附注射液的治療效果是否與調節腸道細菌菌群結構有關,目前尚未明確。因此,本實驗以腸道菌群為切入點,利用16S rRNA高通量測序的方法,明確參附注射液對心衰大鼠腸道菌群的影響,探討參附注射液對心力衰竭大鼠療效的作用機制。
1 材料
1.1 動物 15只5周齡雄性Sprague-Dawley大鼠,由湖南斯萊克景達實驗動物有限公司提供,實驗動物生產許可證號SCXK(湘)2019-0004。實驗方案和動物使用已通過湖南中醫藥大學動物實驗管理中心動物使用與管理倫理委員會的批準,批號LL2020060401,實驗設計和實施依據《湖南實驗動物條例》和國家衛生研究院動物倫理使用指南進行。實驗開始前,所有大鼠適應培養1周。
1.2 試劑、藥物與儀器 參附注射液[華潤三九(雅安)藥業有限公司,批號20030101005]。阿霉素(美國APExBIO公司,批號A39662337769);生理鹽水(湖南康源制藥有限公司,批號C20090105d);DNA抽提試劑盒(美國Bio-Tek公司,型號E.Z.N.A.? soil DNA kit)。MiSeq PE300型高通量測序儀(美國Illumina公司);PCR儀(美國ABI公司,型號ABI GeneAmp?9700);建庫試劑盒(美國Bioo Scientific公司,型號NEXTFLEX?Rapid DNA-Seq Kit)。
2 方法
2.1 造模 所有大鼠適應性培養1周后,按照隨機數字表法分為空白組、模型組、參附組,每組5只,其中空白組大鼠每周腹腔注射生理鹽水,其余大鼠每周腹腔注射阿霉素(生理鹽水配制,2 mg/mL)1次,劑量為1.5 mL/kg,連續7周,總劑量21 mg/kg,依據文獻[8]報道制備心衰模型。
2.2 給藥 7周后,參附組大鼠按6 mL/kg劑量連續15 d腹腔注射參附注射液,空白組、模型組大鼠腹腔注射等量生理鹽水[9]。
2.3 樣本收集 末次給藥24 h后收集大鼠糞便,放入凍存管中保存,液氮速凍后放入-80 ℃冰箱中保存備用[10]。
2.4 DNA提取 依據E.Z.N.A.?soil DNA kit說明書對收集到的大鼠糞便樣本進行微生物群落總DNA抽提,瓊脂糖凝膠電泳檢測DNA提取質量,NanoDrop2000測定DNA濃度和純度。
2.5 腸道細菌基因聚合酶鏈反應(PCR)和16S rRNA測序 使用338 bp正向5′-ACTCCTACGGGAGGCAGCAG-3′和806 bp反向 5′-GGACTACHVGGGTWTCTAAT-3′序列對16S rRNA基因V3~V4可變區進行PCR擴增,參數為95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27個循環;72 ℃ 10 min,在4 ℃下保存。PCR產物經瓊脂糖凝膠電泳檢測,純化后的產品采用上海美吉生物醫藥科技有限公司提供的Illumina MiSeq PE300測序系統進行測序。
2.6 測序數據處理 ①過濾reads尾部質量值20以下的堿基,設置50 bp的窗口,如果窗口內的平均質量值低于20,從窗口開始截去后端堿基,過濾質控后50 bp以下的reads,去除含N堿基的reads;②根據PE reads之間的overlap關系,將成對reads拼接(merge)成1條序列,最小overlap長度為10 bp;③拼接篩選,最大錯配比率為0.2;④修正,barcode允許的錯配數為0,最大引物錯配數為2;⑤分析,使用UPARSE 7.1軟件,按照97%的相似度對序列進行OTU聚類并剔除嵌合體。利用RDP classifier對每條序列進行物種分類注釋,比對Silva 16S rRNA數據庫(版本號132),比對閾值是70%。
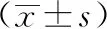
3 結果
3.1 參附注射液對心衰大鼠腸道菌群多樣性的影響 15個樣本通過測序、質控過濾后,共獲得413 910條有效序列數目,單個樣本平均產生27 594條,稀疏曲線隨測序量的增加而趨于平緩,一直延伸到X軸右端,說明目前的測序量可用于后續分析,見圖1。
通過對端測序可知,15個樣本共獲得1 028個OTUs,空白組、模型組、參附組OTU數目分別是844、871、840,共有OTUs 653個,每組樣本的Chao、ACE、Simpson、Shannon等指數見表1。由此可知,與空白組比較,模型組Simpson指數值下降(P<0.01),Chao、ACE、Shannon指數值升高,以Shannon值更明顯(P<0.05),說明心衰后大鼠腸道細菌多樣性增加,細菌豐度也呈現增長趨勢;與模型組比較,參附組Chao、ACE、Simpson、Shannon指數值回調,說明參附注射液有助于心衰大鼠腸道細菌豐度和多樣性的恢復。

表1 各樣本Alpha多樣性分析
3.2 參附注射液對心衰大鼠腸道菌群結構的影響 基于unweighted unifrac距離算法的主坐標分析(principal coordinates analysis,PCoA),考察大鼠腸道菌群β多樣性的差異,見圖2。由此可知,PC1對總體菌群的代表性為27.35%,PC2為17.07%,3組組間差異明顯;基于PC2軸可見,模型組的點與空白組的點偏差較大,空白組與參附組的點距離較近,說明空白組與參附組菌群結構相似度高,參附注射液有助于恢復心衰大鼠腸道細菌的結構。
3.3 參附注射液的心衰大鼠腸道細菌相對豐度的影響 腸道微生物群落結構的直方圖揭示了微生物種類及其相對豐度,共檢測出7個門,見圖3,可知3個樣本組的優勢門主要來源于厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidota),其次是放線菌門(Actinobacteria)、疣微菌門(Verrucomicrobia)、脫硫桿菌門(Desulfobacterota)、變形菌門(Proteobacteria)、螺旋體門(Spirochaetota)。與空白組比較,模型組擬桿菌門(Bacteroidota)、放線菌門(Actinobacteria)、脫硫桿菌門(Desulfobacterota)、螺旋體門(Spirochaetota)豐度最高,厚壁菌門(Firmicutes)豐度最低,模型組厚壁菌門相對豐度(70.88%)低于空白組(81.06%)(P<0.01),模型組擬桿菌門相對豐度(15.07%)高于空白組(6.87%)(P<0.05),參附組變形菌門相對豐度(2.95%)高于模型組(0.16%)(P<0.01),見圖4~5。與空白組比較,模型組厚壁菌門豐度減小(P<0.01),擬桿菌門豐度增加(P<0.05),F/B值減小;與模型組比較,參附組厚壁菌門豐度增加,擬桿菌門豐度減小,F/B值增加,差異無統計學意義(P>0.05),可認為參附組大鼠腸道中厚壁菌門和擬桿菌門豐度及其比值有回調趨勢,見表2。
所有標本共鑒定出30個屬,見圖6。由此可知,空白組的優勢菌依次為乳桿菌屬Lactobacillus39.78%,羅姆布茨菌屬Romboutsia7.28%,未知的S24-7科6.36%,未知的梭狀芽胞桿菌UCG-014家族5.85%,艾克曼菌屬Akkermansia5.83%,未分類的毛螺旋菌科unclassifiedLachnospiraceae4.13%;模型組的優勢菌依次為乳桿菌屬21.91%,未知的S24-7科11.63%,羅姆布茨菌屬5.85%,雙歧桿菌屬Bifidobacterium5.12%,未分類的毛螺旋菌科unclassifiedLachnospiraceae4.09%;參附組的優勢菌依次為異桿菌屬14.98%,未知的S24-7科12.84%,乳桿菌屬9.83%,Turicibacter7.27%,未知的梭狀芽胞桿菌UCG-014家族6.36%,即空白組和模型組乳桿菌屬比例最大,參附組異桿菌屬為優勢菌屬。
本實驗根據3組樣本在屬水平的物種注釋及豐度信息,選取豐度排名前35的屬,根據其在每組樣本中的豐度信息按組別進行聚類,見圖7。由此可知,這35個屬的細菌分屬于6個優勢的細菌門,其中26個屬于厚壁菌門,3個屬于放線菌門,1個屬于疣微菌門,2個屬于擬桿菌門,2個屬于脫硫桿菌門,1個屬于螺旋體門,表明在屬水平上檢測到的細菌中通過相對豐度進行了明顯的分離。
然后,篩選出具有維持腸道結構完整性和(或)改善心衰作用的7個細菌屬,并進行組間差異檢驗,見圖8~9。由此可知,與空白組比較,模型組羅姆布茨菌屬、布勞特氏菌屬Blautia、異桿菌屬、糞球帶菌屬Faecalibaculum的相對豐度降低,密螺旋體菌屬Treponema、Intestinimonas、普雷沃氏菌屬Prevotella的相對豐度升高,以Intestinimonas、普雷沃氏菌屬更明顯(P<0.05);與模型組比較,參附組羅姆布茨菌屬、布勞特氏菌屬、異桿菌屬、糞球帶菌屬、密螺旋體菌屬、Intestinimonas、普雷沃氏菌屬的相對豐度均呈現回調趨勢,以異桿菌屬(P<0.05)、Intestinimonas(P<0.01)更明顯,說明參附注射液可有效恢復菌群豐度的改變。
3.4 線性判別分析效應量(LEfSe)確定豐度差異顯著的菌群 本實驗篩選出3組大鼠腸道中具有差異的微生物(LDA閾值為4),采用LEfSe分析得出多級物種分類樹圖和柱狀圖,見圖10。由此可知,空白組腸道菌群主要包括4種細菌,即乳桿菌屬Lactobacillus、乳桿菌科Lactobacillaceae、乳桿菌目Lactobacillales、厚壁菌門Firmicutes,以益生菌為主;模型組中富含1種細菌,即普雷沃氏菌科Prevotellaceae,為條件致病菌;參附組特征性菌群有9種,即丹毒絲菌科Erysipelotrichaceae、丹毒絲菌目Erysipelotrichales、異桿菌屬Allobaculum、蘇黎世桿菌屬Turicibacter、嚴格梭菌屬Clostridium_sensu_stricto_1、梭菌科Clostridiaceae、梭菌目Clostridiales、γ-變形菌綱Gammaproteobacteria、變形菌門Proteobacteria。
4 討論
腸道是人體最大的消化器官,與人類的生命活動密切相關[11]。生活在腸道內的腸道菌群在人類日常飲食和口服藥物中扮演著“代謝物過濾器”的重要角色[12],其對機體物質的吸收、消化、代謝功能與中醫小腸“受盛化物”的功能相契合,對有害物質進行識別、抵抗、吸收的功能與中醫小腸“泌別清濁”的功能相關[13],可認為腸道菌群是腸道和其他器官之間的一個重要橋梁。
腸道菌群微生態環境的動態平衡才能維持正常的腸道微生態功能,如免疫功能、營養作用等,一旦平衡被打破,便會伴發多種疾病,如肥胖、胰島素抵抗、糖尿病等[14-15]。已有研究證實,心衰發生發展過程中可引起腸道黏膜損傷,腸道菌群移位,引發全身炎癥反應和免疫反應,失調的菌群通過介導炎癥反應進一步影響心衰的病理生理過程,誘發心衰晚期惡病質等不良反應[16-17]。大量臨床研究證實,參附注射液治療后心衰患者心功能明顯改善,生存率明顯提高[18-19]。結合中醫對腸道功能的認知和腸道菌群功能的重要性,推測腸道菌群可能是參附注射液治療心力衰竭的關鍵,故本實驗采用16S rRNA高通量測序技術探究參附注射液對心力衰竭大鼠腸道菌群結構的影響。
本研究中,與空白組比較,模型組的OTUs數量增加,結合Alpha多樣性分析結果,可認為心衰大鼠腸道細菌的豐度和多樣性較空白組增加,其腸道菌群豐度和多樣性的增加可能是由于各種有害細菌的過度繁殖導致的,這種觀點也被以往研究認同[20]。給予參附注射液后,參附組的OTUs數量減少,Alpha多樣性分析指數回調,與模型組比較無統計學意義,此結果與本課題組前期研究結果類似[21]。結合PCoA圖結果,PC2軸空白組與參附組的距離較空白組與模型組的距離明顯縮短。提示,參附注射液有助于恢復心衰大鼠腸道細菌的豐度和多樣性,使菌群結構接近空白組水平。
厚壁菌門是優勢菌門,其次是擬桿菌門、放線菌門等[22]。厚壁菌門和擬桿菌門的比值(F/B值)常用來測量腸道內穩態[23]。研究發現,與空白組比較,模型組厚壁菌門相對豐度下降,擬桿菌門相對豐度上升,F/B值減小,說明心衰后大鼠腸道內環境紊亂。給藥后,參附組厚壁菌門相對豐度上升,擬桿菌門相對豐度下降,F/B值增大,與以往研究相符,說明參附注射液對腸道內穩態的維持具有積極作用[24]。He等[25]發現,厚壁菌門和變形菌門是產生乳糖酶的主要菌門,模型組變形菌門的相對豐度低于空白組,參附注射液治療后變形菌門的相對豐度增加,推測參附注射液會促進某些產乳糖酶細菌的增殖來維持腸道內環境穩定,改善心衰狀態。
從屬水平分析3組大鼠腸道菌群結構差異,結果顯示,3組大鼠具有特征性的高豐度細菌,說明不同組別大鼠腸道菌群的物種結構具有差異性。乳桿菌屬在空白組大鼠腸道菌群中所占比重最大,心衰大鼠乳桿菌屬相對豐度較空白組下降,給藥后乳桿菌屬豐度進一步下降。乳桿菌屬是益生菌,有增強機體免疫力和抑制病原菌侵襲的作用,但給予參附注射液后的大鼠腸道菌群中乳桿菌屬豐度進一步下降,說明參附注射液不能通過增加乳桿菌屬的數量達到修復腸黏膜、改善心衰的作用[23,26]。與空白組比較,模型組羅姆布茨菌屬[27]、布勞特氏菌屬[28]、異桿菌屬[29]、糞球帶菌屬[30]等有益菌豐度減少,以往研究表明這些細菌在維持腸道健康方面有重要作用,密螺旋體屬[31]、Intestinimonas[32]、普雷沃氏菌屬[33]等致病菌屬在模型組的豐度增加。給藥后上述細菌豐度回調,說明參附注射液可能是通過增加有益菌數量,減少致病菌數量來維持腸道的完整性。Mao等[30]研究發現糞球帶菌屬可通過發酵作用促進丁酸的生成。丁酸是短鏈脂肪酸的一種,近期研究表明,腸道微生物介導的短鏈脂肪酸代謝途徑與心衰有關,可通過多種機制抑制炎癥反應,在改善心衰發生發展方面起到重要作用[26],提示參附注射液可能是通過促進糞球帶菌屬等產短鏈脂肪酸細菌的增殖來改善大鼠心衰狀態。
LEfSe結果表明,空白組的特征性細菌是以乳桿菌屬為主的益生菌;模型組以致病菌普雷沃氏菌科為主;給予參附注射液后,普雷沃氏菌科豐度下降,異桿菌屬等有益菌成為參附組的特征性細菌,可認為參附注射液具有促進心衰大鼠腸道有益菌增殖,抑制致病菌增殖的作用。
綜上所述,參附注射液對心力衰竭大鼠腸道微生物環境有積極作用,可改善因心衰導致的大鼠腸道細菌結構紊亂,具有抑制致病菌生長,促進有益菌生長的作用,其機制可能與增加SCFA的產生菌(如糞球帶菌屬)有關。

