基于Logistic回歸分析的重度ROP危險因素分析
張婉瑜 陳金國 簡美梅 徐國興
早產兒視網膜病變(retinopathy of prematurity,ROP)是發生于早產兒的視網膜病變,多項研究證實,出生體質量、出生胎齡、高濃度吸氧與ROP嚴重程度相關[1-2],隨著重癥監護室水平的提升及醫療的進步,極低體質量兒及合并全身情況的的早產兒的生存概率得到提高,ROP的嚴重程度也隨之加重。目前引起ROP嚴重程度的產前因素、產后新生兒全身情況等相關危險因素仍不明確,當合并全身嚴重情況無法定期檢查眼底時,無法預估ROP嚴重程度。本研究通過回顧性分析,采用眼底照相檢查儀器Retcam3檢查,雙目間接眼底鏡檢查明確ROP診斷并分期,針對早產兒相關因素以及母親相關因素等方面,探討ROP嚴重程度的危險因素,早期干預,減少重度ROP的發生率,改善早產兒后期生活質量,為我國早產兒視網膜篩查標準提供臨床參考。
1 資料與方法
1.1 一般資料
采用回顧性分析,收集2019年11月-2022年4月期間于我科門診就診及NICU住院,檢查后確診為ROP的患兒134例。其中男76例,女58例,平均出生胎齡(gestational age,GA)(30.69±2.99)周,平均出生體質量(birth weight,BW)(1.55±0.49)kg。納入標準:(1)符合ROP診斷標準,并參照ROP分期標準[3];(2)在我院門診完成檢查的早產兒;(3)出生后在我院NICU住院,并獲取完整臨床數據。排除標準:(1)住院病例資料缺失者;(2)全身情況差,無法行眼科治療者;(3)出生后行全身手術治療者;(4)眼部合并有其他疾病者。本研究經我院醫院倫理委員會審批通過,檢查前及治療前均由患兒父母簽署相關知情同意書。
1.2 方法
(1)檢查方法:ROP檢查由專業眼科醫生采用眼底照相檢查儀器Retcam3檢查眼底,同一個主治醫師進行雙目間接眼底鏡檢查,明確診斷和分期,手術均為同一個主治醫師進行操作。出生后2周開始檢查,檢查至ROP視網膜出現退行性改變或病變達到需要手術治療為止。(2)分組方法:將134例ROP患兒按嚴重程度分為重度ROP組和輕度ROP組[4],重度ROP組30例,輕度組104例。重度ROP組為閾值病變、1型和2型閾值前病變、3期以上的病變及急進型后極部ROP(acute porier retinopathy of prematurity,AP-ROP),達到手術指征者均行ROP治療。其中抗血管內皮生長因子(vascular endothelial growth factor,VEGF)藥物(雷珠單抗)治療者28例,激光治療者1例,兩者聯合治療者1例。輕度ROP組為非閾值期及閾值前期的1期及2期病變,不伴有附加病變,可在45周之前自行發生視網膜退行性改變或視網膜完全血管化。(3)ROP手術指征:病變達閾值病變、1型閾值前病變及AP-ROP者,行抗VEGF治療;治療后病變復發或加重,可再次行抗VEGF治療或激光治療;抗VEGF治療后仍有未退行的視網膜新生血管,可再次行周邊視網膜無血管區的激光治療未退行的視網膜[5-6]。(4)相關危險因素分析:收集入組ROP患兒的住院資料,并詢問母親妊娠期情況,其中早產兒相關因素涉及GA、BW、新生兒肺炎、新生兒肺透明膜病(hyaline membrane disease,HMD)、新生兒支氣管肺發育不良(bronchopulmonary dysplasia,BPD)、新生兒胎糞吸入綜合征(meconium aspiration syndrome,MAS)、顱內出血(intracerebral hemorrhage,ICH)和有創機械通氣(invasive mechanical ventilation,IMV),母親相關因素涉及妊娠年齡、妊娠期糖尿病(gestational diabetes mellitus,GDM)、妊娠期高血壓疾病(hypertensive disorders of pregnancy,HDP)和產前用地塞米松(dexamethasone,DXM)。
1.3 觀察指標
美國兒科協會、美國眼科學會在2018年的早產兒視網膜篩查研究中,認為GA<30周、BW<1 500 g是ROP的高危因素[7],參照其分組。新生兒肺炎、HMD、BPD和MAS診斷參照臨床診斷標準[8];ICH采用彩色多普勒超聲診斷儀在患兒出生后進行檢查,出現的顱內出血包括腦實質出血、硬膜下出血、蛛網膜下腔出血、腦室周圍白質軟化(periventricular leukomalacia,PVL)等[9],均診斷為ICH;IMV模式包含持續正壓通氣(continuos positive airway pressure,CAPA)、高頻振蕩通氣(high frequency oscillatory ventilation,HFOV)和同步間歇指令通氣(synchronized intermittent mandatory,SIMV)。患兒全身疾病均在我院NICU住院期間診斷并接受治療。GDM診斷標準參照美國糖尿病學會更新的2021版GDM診療標準[10],HDP診斷標準參照2020年版指南[11]。比較重度ROP組和輕度ROP組的ROP的發生與早產兒相關因素和母親相關因素等的相關性。
1.4 統計學方法
采用SPSS 21.0軟件,對兩組早產兒相關因素和母親相關因素進行數據統計分析處理。計量資料采用()表示,兩組間比較采用t檢驗;計數資料采用n(%)表示,兩組間比較采用χ2檢驗或Fisher確切概率法,P<0.05差異有統計學意義。多因素分析采用逐步二元Logistic回歸分析,分析影響ROP病變的主要危險因素。
2 結果
2.1 單因素分析
134例ROP患兒中,重度ROP組、輕度ROP組分別為30例(22.39%)、 104例(77.61%)。表1可見,兩組間GA及BW方差相等,采用獨立樣本t檢驗,兩組間比較差異有統計學意義(P<0.05)。表2可見,經χ2檢驗及Fisher確切概率法分析,重度ROP組和輕度ROP組中,GA<30周、BW<1 500 g、BPD和IMV組間比較差異有統計學意義(P<0.05)。表3可見,經χ2檢驗分析,母親相關因素中,GDM和產前DXM組間比較差異有統計學意義(P<0.05)。
表1 兩組之間計量資料比較()
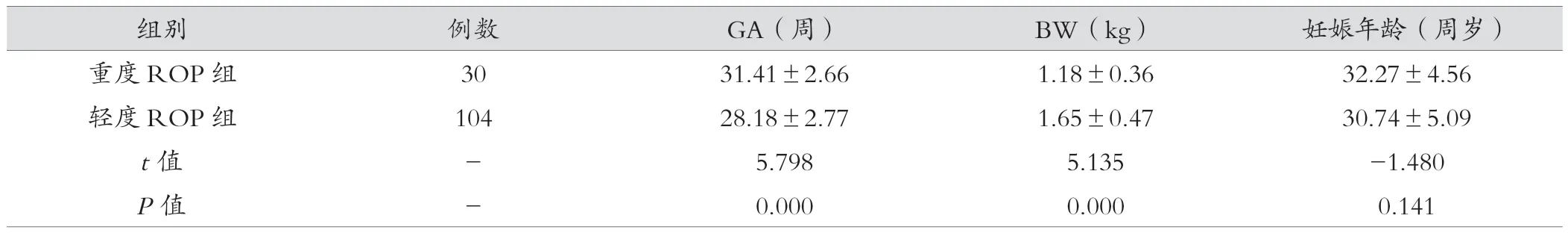
表1 兩組之間計量資料比較()
組別 例數 GA(周) BW(kg) 妊娠年齡(周歲)重度 ROP 組 30 31.41±2.66 1.18±0.36 32.27±4.56輕度 ROP 組 104 28.18±2.77 1.65±0.47 30.74±5.09 t值 - 5.798 5.135 -1.480 P值 - 0.000 0.000 0.141

表2 兩組之間早產兒相關因素分類變量比較[例(%)]
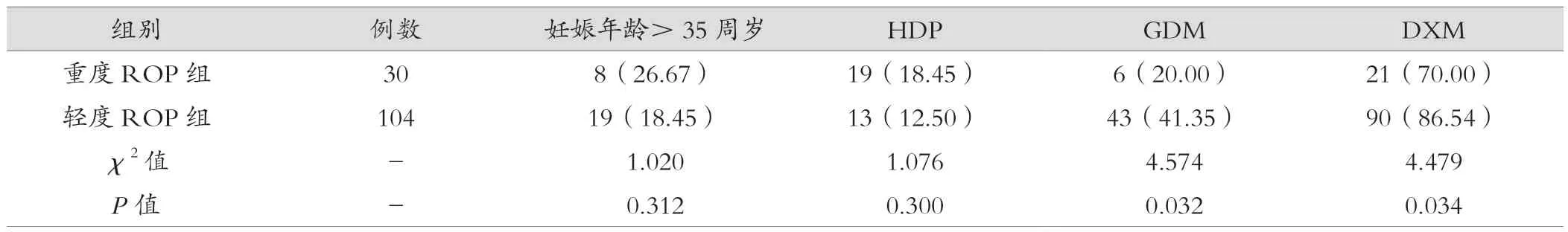
表3 兩組之間母親相關因素分類變量比較[例(%)]
2.2 多因素分析
表4可見,排除單因素分析中P>0.1的因素,其余因素納入多因素分析,經逐步二元Logistic回歸分析,GA<30周與ROP嚴重程度呈正相關,產前DXM與ROP嚴重程度呈負相關。

表4 多因素二元Logistic回歸分析結果
3 討論
ROP是由于早產、視網膜缺氧等因素,進而促使VEGF大量產生,刺激血管內皮細胞增殖,導致視網膜新生血管生長,繼而部分可能出現血-視網膜屏障破壞,致視網膜出血、視網膜增殖牽拉,甚至視網膜脫離[12]。隨著醫學技術的進步,越來越多全身情況嚴重的早產兒存活率得以提升,但ROP的發生率及嚴重程度也隨著升高。重度ROP的治療主要是激光治療、抗VEGF藥物治療,但如治療不及時,達到ROP 4期及5期病變的患兒致盲率高,需行玻璃體切割治療,因此ROP的治療時間窗應嚴格把握,以防ROP進展,引起視網膜嚴重牽拉及視網膜脫落,影響預后和視覺發育。明確ROP進展的危險因素是防控的關鍵,對控制ROP的病情有臨床價值。本研究針對134例ROP的早產兒臨床資料進行回顧性分析,經單因素分析、二元 Logistic回歸分析后發現,母親相關因素及早產兒相關因素均會影響ROP的病情嚴重程度。單因素分析研究結果表明,GA、BW、BPD、IMV、GDM、DXM是導致重度ROP的危險因素(P<0.05)。經二元Logistic回歸調整協變量后發現,GA<30周、產前DXM是ROP嚴重程度的獨立相關因素。本研究結果為我國早產兒視網膜病變的篩查后期標準的制定提供了借鑒內容。
美國多中心臨床研究已證實,GA、BW和高濃度吸氧是ROP的獨立危險因素,GA及BW越小,發生ROP的風險越大[7]。墨西哥的臨床研究中[13],對存在風險的早產兒進行篩查和密切的眼科隨訪發現,BW<1 750 g 和GA≤34周在重度ROP患兒中更為常見。墨西哥的另一項臨床研究證實,BW<1 500 g導致ROP的嚴重程度風險增加[14]。本研究亦證實了BW、GA與ROP嚴重程度有關,且經多因素分析,GA<30周可導致重度ROP的發生風險加大。出生胎齡和出生體質量越小,早產兒出生全身情況越差,需要高濃度吸氧及長時間吸氧等的風險加大。相對高濃度吸氧可使視網膜血管收縮,導致視網膜無血管區代謝更加活躍,產生大量VEGF,刺激病理性新生血管增多,進而導致增殖病變,產生ROP[15]。
有關早產兒出生后肺部情況,本研究單因素研究證實,BPD與ROP的嚴重程度明顯相關。BPD是一種慢性肺部疾病,多見于新生兒呼吸窘迫綜合征長時間使用呼吸機后及長期氧療者。新生兒呼吸窘迫綜合征是由于身體缺乏肺表面活性物質導致的一種新生兒疾病。Stritzke等[16]也證實了增加肺表面活性物質,可以減少ROP的發生,Higgins等[17]證實了吸氧濃度和吸氧時長可以加重ROP程度。本研究發現,當BPD合并有ROP時,可加劇ROP嚴重程度,可能原因為長期使用呼吸機導致新生兒肺表面活性物質減少,需進一步加大吸氧濃度及吸氧時長,從而導致視網膜增殖病變。對于合并BPD的ROP患兒,應加強眼底篩查,避免ROP進展成重度ROP后,錯過治療時間。
在病情嚴重、痰堵塞等情況下,無創機械通氣持續高壓力和高氧濃度,仍無法維持氧合濃度并及時控制病情,需及時調整無創機械通氣模式為IMV模式,使氧飽和濃度等達到一定標準。IMV通過切開的氣管和氣管插管,將高濃度氧氣直接輸送至肺部,保證適宜的肺泡內正壓,直接提高氧合。臨床研究表明,因與正常呼吸供氧模式不同,長期機械通氣可擾亂肺發育過程[18]。Ding和Silahli等[19-20]研究發現,使用過IMV后,ROP嚴重程度明顯加重。本研究亦發現,IMV可影響ROP的嚴重程度,考慮因IMV其有創的通氣模式直接致早產兒肺損傷,或因其吸氧濃度過高而間接導致早產兒肺損傷。
在妊娠期間,使用糖皮質激素地塞米松,可以明顯促進胎肺成熟,進而大幅度提高早產兒的生存率。本研究結果闡明,產前使用DXM后,ROP的嚴重程度明顯下降,且相關性明顯。試驗研究提示,DXM可以抑制VEGF基因表達[21]。在孕期使用DXM后,通過糖皮質激素抑制VEGF表達,促進視網膜前血管的正常發育,從而降低了視網膜病變的嚴重程度。產前使用DXM,可以促進胎肺成熟,降低使用高濃度氧的概率,間接降低了ROP的發生。但本研究對產前使用糖皮質激素地塞米松的具體劑量和時間未明確,存在差異,需進一步明確。
當母親患有GDM,血糖通過臍帶血使胎兒的血糖也隨之升高,導致巨大兒,是早產的危險因素之一,而早產是ROP的危險因素。Amelie和Ozgur等[22-23]經回顧性分析研究,證實了ROP的嚴重程度與GDM相關,且相關強度隨ROP嚴重程度的增加而增加。因此GDM可以直接或者間接影響ROP的嚴重程度。本研究發現,GDM發生可影響ROP的嚴重程度,與糖尿病母親的胎兒血糖改變及體質量改變可能相關。本研究缺少入組患兒的血糖值,需完善早產兒的血糖情況,進一步明確相關性。
本研究在ROP病例中,重度ROP發生率為22.39%。Akkawi等[24]研究結果顯示,新生兒重癥監護病房需要治療的重度ROP發生率為23.5%,與本研究結果相近。本研究為回顧性分析,樣本量較小,僅收集了單中心的資料。今后將繼續收集相關臨床資料,以增加樣本量并追蹤遠期預后結局。
總之,早產兒相關因素及母親相關因素,均可影響ROP的嚴重程度。其中GA<30周可導致重度ROP的風險加大,母親產前使用DXM亦可影響重度ROP風險。當GA<30周且BW小,出生后予有創機械通氣或合并有BPD時,應加強ROP患兒眼底篩查,早期干預,避免ROP加重,錯過手術時機。同時,當母親合并有GDM,應警惕新生兒眼底情況,并加強眼底篩查管理。早期進行檢查并及時治療,可有效降低重度ROP發生率,改善早產兒生活質量,具有良好的社會效應。

