大孔吸附樹脂分離純化羊肚菌多糖過氧化氫改性物
張雪松, 謝春芹, 凡軍民, 曹 正, 舒 瑾, 苗 雪
(江蘇農(nóng)林職業(yè)技術(shù)學(xué)院茶與食品科技學(xué)院,江蘇 句容 212400)
糖尿病是因胰島素分泌不足或胰島素作用障礙而導(dǎo)致的內(nèi)分泌類代謝性疾病,糖苷酶抑制劑因其效果持久、毒副作用小、作用溫和等優(yōu)點廣泛運用于2型糖尿病的治療[1]。近年來,對天然植物來源的糖苷酶抑制劑展開的研究成為熱點[2]。很多中藥包括食藥用菌提取物有降糖作用,多糖成分在其中起著重要作用[3-4]。羊肚菌屬珍稀食藥用菌,羊肚菌多糖具有降血脂、降血糖、抗腫瘤等作用[5-7]。
抑制α-淀粉酶活性的試劑可用于抑制腸道內(nèi)的淀粉酶活性,阻礙碳水化合物的水解,對高血糖、肥胖癥以及高血脂等具有較好的防治作用[8]。糖苷酶抑制劑中,食用菌多糖來源廣泛,但其生物活性很難與藥物相提并論,限制其應(yīng)用前景。研究表明,食用菌多糖的糖苷鍵類型、分子量大小等因素均能影響其生物活性,通過改變分子量、空間結(jié)構(gòu)等可以改變食用菌生物活性的有效途徑[9]。課題組前期采用過氧化氫氧化降解羊肚菌多糖組分,提高其對α-淀粉酶的抑制活性[10]。本實驗以α-淀粉酶抑制率為指標,利用大孔樹脂分離純化羊肚菌多糖過氧化氫改性物,通過篩選D101、AB-8、S-8、NKA-9、LX-17大孔樹脂,考察羊肚菌多糖的分離純化影響因素和工藝條件,以期為后續(xù)天然來源的糖苷酶抑制劑的工業(yè)化應(yīng)用提供參考。
1 材料
1.1 試劑與藥物 六妹羊肚菌由江蘇農(nóng)林職業(yè)技術(shù)學(xué)院食用菌教學(xué)基地種植,經(jīng)專家鑒定為正品。20 000 U/mL α-淀粉酶購自上海麥克林生化科技有限公司;氯仿、淀粉、3, 5-二硝基水楊酸(DNS)、過氧化氫為分析純,購自國藥集團化學(xué)試劑有限公司。
1.2 儀器 GZLYZ-1型真空冷凍干燥機(諸城市博匯機械有限公司);Thermo Nicolet 5700型傅里葉紅外光譜儀(美國Thermo公司);T6型紫外-可見分光光度計(北京普析通用儀器有限責(zé)任公司);SY-5000型旋轉(zhuǎn)蒸發(fā)儀(上海亞榮生化儀器廠)。
2 方法
2.1 多糖制備 新鮮羊肚菌滅菌烘干后粉碎過40目篩,參考文獻[10]報道制備多糖,經(jīng)真空冷凍后為黃色粉末,提取率為10.32%。
2.2 多糖改性物制備 參考文獻[10]報道,稱取多糖1 g,按最佳條件用30%過氧化氫氧化降解羊肚菌多糖,反應(yīng)液經(jīng)濃縮、真空冷凍干燥得白色粉末狀改性物0.854 2 g,得率為85.42%。
2.3 α-淀粉酶抑制活性研究 參考文獻[11]報道,取抑制對照管和抑制管,分別加入0.5 mL 2%淀粉溶液和40 mg/L 1.0 mL羊肚菌多糖改性物溶液,取空白對照管和空白管,分別加入蒸餾水1.0 mL,再在抑制對照管加入蒸餾水0.5 mL,抑制劑管和空白管各加入α-淀粉酶(20 U/mL)0.5 mL,37 ℃水浴10 min,再加入DNS試劑1.0 mL,沸水浴加熱5 min后加入蒸餾水10.0 mL。冷卻至室溫后在540 nm波長處測定吸光度(A),計算抑制率(InR),公式為InR=[1-(A3-A4)/(A1-A2)]×100%。
2.4 分離純化研究
2.4.1 預(yù)處理 選用AB-8、LX-17、D101、NKA-9、S-8樹脂,分別用95%乙醇浸泡24 h后淋洗,最后用蒸餾水沖洗。
2.4.2 樹脂篩選 取上述5種樹脂各5 g,置于于錐形瓶中,加入40 mg/L多糖改性物溶液100 mL,在30 ℃、100 r/min下吸附24 h,計算吸附率,公式為吸附率=[(初始溶液抑制率-吸附后溶液抑制率)/初始溶液抑制率]×100%。
2.4.3 靜態(tài)吸附實驗 參考文獻[12]報道。
2.4.3.1 吸附時間 稱取預(yù)處理好的D101樹脂5 g,加入40 mg/L多糖改性物溶液100 mL,在30 ℃ 100 r/min下吸附12 h,每隔1 h測定溶液對α-淀粉酶的抑制率。
2.4.3.2 吸附溫度 稱取預(yù)處理好的D101樹脂5 g,加入40 mg/L多糖改性物溶液100 mL,分別在20、25、30、35、40 ℃下吸附3 h,測定溶液對α-淀粉酶的抑制率。
2.4.3.3 樹脂用量 分別稱取預(yù)處理好的D101樹脂1、2、3、4、5 g,加入40 mg/L多糖改性物溶液100 mL,在35 ℃下吸附3 h,測定溶液對α-淀粉酶的抑制率。
2.4.4 動態(tài)吸附實驗 參考文獻[13]報道。
2.4.4.1 pH值 稱取預(yù)處理好的D101樹脂10 g裝柱,用5% NaOH或5%HCl調(diào)節(jié)多糖改性物溶液至pH值為4、5、6、7、8,倒入100 mL溶液上樣,控制體積流量為2 BV/h,通過2 BV 95%乙醇進行洗脫,洗脫液旋蒸后定容到100 mL,測定其對α-淀粉酶的抑制率。
2.4.4.2 洗脫劑體積分數(shù) 稱取預(yù)處理好的D101樹脂10 g裝柱,倒入100 mL pH值為7的多糖改性物溶液上樣,控制體積流量為2 BV/h分別通過2 BV 20%、40%、60%、80%、100%乙醇洗脫,洗脫液旋蒸后定容到100 mL,測定其對α-淀粉酶的抑制率。
2.4.4.3 洗脫劑用量 稱取預(yù)處理好的D101樹脂10 g裝柱,倒入100 mL pH值為7的多糖改性物溶液上樣,控制體積流量為2 BV/h,通過100 mL 80%乙醇洗脫,每1 BV(25 mL)收集1次洗脫液,旋蒸后定容至100 mL,測定其對α-淀粉酶的抑制率。
2.4.4.4 上樣質(zhì)量濃度 稱取預(yù)處理好的D101樹脂10 g裝柱,倒入100 mL pH值為7的多糖改性物溶液上樣,質(zhì)量濃度分別為20、30、40、50、60 mg/L,控制體積流量為2 BV/h,通過80%乙醇2 BV洗脫,洗脫液旋蒸后定容到100 mL,測定其對α-淀粉酶的抑制率。
2.4.4.5 上樣體積流量 稱取預(yù)處理好的D101樹脂10 g裝柱,倒入100 mL、pH值為7、質(zhì)量濃度為30 mg/L的多糖改性物溶液上樣,控制體積流量為1、2、3、4、5 BV/h,通過用80%乙醇2 BV洗脫,洗脫液旋蒸后定容到100 mL,測定其對α-淀粉酶的抑制率。
2.5 紅外光譜掃描分析 多糖改性物及D101樹脂洗脫產(chǎn)物冷凍干燥樣品磨成粉末后與溴化鉀混合,壓片,在4 000~5 00 cm-1波數(shù)范圍內(nèi)進行紅外光譜掃描分析。
3 結(jié)果
3.1 樹脂篩選 由表1可知,多糖改性物溶液被樹脂吸附后,對α-淀粉酶的抑制活性均有所降低,并且差異較大,其中D101吸附后最低,相對吸附率為61.96%,即吸附效果最好。

表1 5種樹脂吸附作用比較
3.2 靜態(tài)吸附分析
3.2.1 吸附時間 由圖1可知,前3 h內(nèi)α-淀粉酶抑制率下降最快,當吸附時間超過3 h后變化不大,說明吸附在3 h后已達到飽和。Ho等[14]發(fā)現(xiàn),大孔吸附樹脂的吸附分為4個過程,在吸附的前3 h,樹脂對多糖改性物中α-淀粉酶抑制成分的吸附主要是在位于表面的活性中心上,主要是通過在溶液以及液膜中的擴散,在樹脂表面即被吸附,而吸附時間超過3 h以后,樹脂表面α-淀粉酶抑制成分吸附量逐漸飽和,多糖改性可通過樹脂的內(nèi)部孔道擴散到樹脂的內(nèi)表面上,由于樹脂內(nèi)部擴散阻力較大,吸附過程趨于平緩直至飽和。

圖1 吸附時間對α-淀粉酶抑制率的影響
3.2.2 吸附溫度 由圖2可知,隨著吸附溫度從20 ℃上升到40 ℃,多糖改性物溶液對α-淀粉酶的抑制率先降低再升高;當吸附溫度為35 ℃時,溶液對α-淀粉酶的抑制活性最低,為5.51%。溫度升高會加快分子運動,有效的降低溶液黏度,減小外擴散和內(nèi)擴散的阻力,有利于吸附和擴散過程的進行。
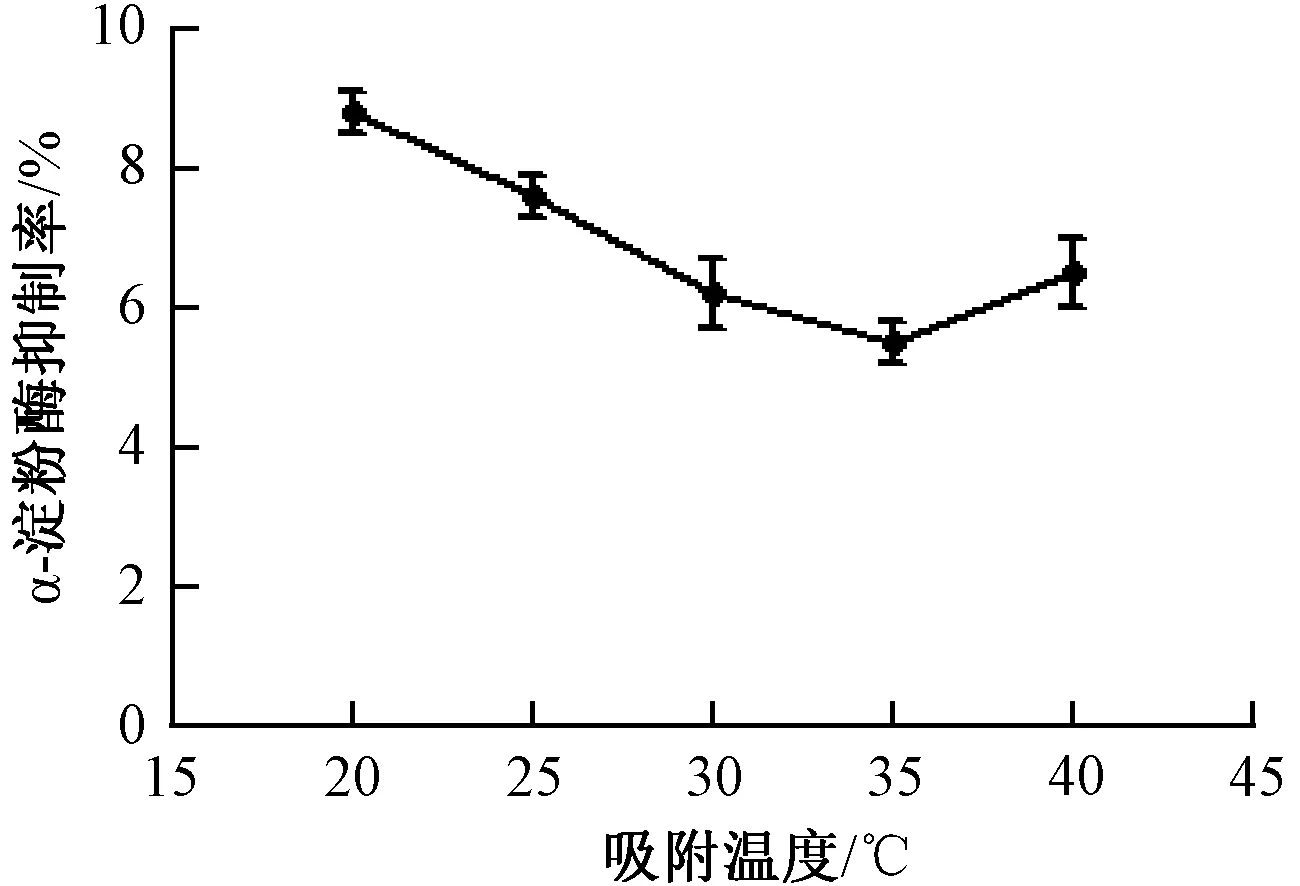
圖2 吸附溫度對α-淀粉酶抑制率的影響
3.2.3 樹脂用量 由圖3可知,隨著樹脂用量上升,α-淀粉酶抑制率逐漸下降,為4 g時最低,此時吸附趨于飽和,超過4 g后基本不變。

圖3 樹脂用量對α-淀粉酶抑制率的影響
3.3 動態(tài)吸附分析
3.3.1 pH值 由圖4可知,隨著pH值增大,α-淀粉酶抑制率先升高后降低,為7時最高,達24.36%,這可能是由于多糖改性產(chǎn)物分子中存在羥基,在酸性條件下容易質(zhì)子化,從而削弱和水分子之間的作用力,樹脂吸附力下降,洗脫液對α-淀粉酶的抑制活性下降;但pH過大,大孔樹脂也容易結(jié)成塊狀物,不利于對樣品進行吸附[15]。

圖4 pH值對α-淀粉酶抑制率的影響
3.3.2 洗脫劑體積分數(shù) 由圖5可知,隨著乙醇體積分數(shù)不斷增加,洗脫液對α-淀粉酶的抑制率呈現(xiàn)出先升高后降低的趨勢,為80%時最高,達27.87%,說明在該體積分數(shù)下洗脫得到的目標成分最多。使用非極性D101大孔樹脂時,洗脫劑的極性越小,洗脫能力越強[16],同時,經(jīng)過氧化氫氧化降解后羊肚菌多糖改性物分子量相對較小,在不同體積分數(shù)乙醇中的溶解度也存在較大差異。

圖5 洗脫劑體積分數(shù)對α-淀粉酶抑制率的影響
3.3.3 洗脫劑用量 由圖6可知,經(jīng)2 BV乙醇洗脫后,洗脫液對α-淀粉酶的抑制率最高,達36.21%,即洗脫的目標成分最多。洗脫劑用量過少,則洗脫不完全;洗脫劑用量過多,洗脫液中α-淀粉酶抑制物質(zhì)濃度將會下降,會降低其抑制效果。

圖6 洗脫劑用量對α-淀粉酶抑制率的影響
3.3.4 上樣質(zhì)量濃度 由圖7可知,隨著上樣質(zhì)量濃度的增大,洗脫液對α-淀粉酶的抑制率呈現(xiàn)出先升高后降低的趨勢,其原因可能是上樣質(zhì)量濃度較低時,多糖改性物溶液中的α-淀粉酶抑制物質(zhì)與樹脂內(nèi)表面接觸機會減少,擴散到樹脂表面以及孔道內(nèi)的速度較慢,影響吸附的效果;隨著上樣質(zhì)量濃度的增加,多糖改性物溶液中α-淀粉酶抑制物質(zhì)與樹脂內(nèi)表面接觸機會逐漸增加,更多前者被樹脂吸附并洗脫,洗脫液抑制活性提高,但若上樣質(zhì)量濃度過高,多糖改性物溶液中其他物質(zhì)可能會與α-淀粉酶抑制物質(zhì)形成吸附競爭關(guān)系,甚至形成沉淀而造成孔道堵塞,降低擴散速率,影響吸附效果,同時當樹脂吸附達到飽和以后,單純地增加上樣質(zhì)量濃度對提高洗脫液的α-淀粉酶抑制率影響不大。本實驗發(fā)現(xiàn),上樣質(zhì)量濃度為30 mg/L時,對α-淀粉酶的抑制率達到最高,為40.33%。

圖7 上樣質(zhì)量濃度對α-淀粉酶抑制率的影響
3.3.5 上樣體積流量 由圖8可知,隨著上樣體積流量的上升,洗脫液對α-淀粉酶的抑制率先升高后降低,為1~3 BV/h時較高,為2 BV/h時最高,為40.33%。上樣體積流量過大,多糖改性物溶液中α-淀粉酶抑制物質(zhì)在樹脂層停留的時間就會短,與樹脂的接觸時間減少,吸附效果降低,洗脫液對α-淀粉酶的抑制率就會隨著體積流量的增加而減小;上樣體積流量過小,則會延長試驗和生產(chǎn)時間,不利于經(jīng)濟生產(chǎn)。

圖8 上樣體積流量對α-淀粉酶抑制率的影響
3.4 分離純化前后樣品表征 由圖9可知,羊肚菌多糖改性物及其D101樹脂洗脫物均在1 150 cm-1左右處出現(xiàn)環(huán)上C-O吸收峰,1 630 cm-1左右處出現(xiàn)-OH彎曲振動吸收峰、2 920 cm-1左右處出現(xiàn)C-H伸縮振動吸收峰,3 420 cm-1左右處出現(xiàn)-OH伸縮振動吸收峰等多糖的典型吸收特征,說明采用D101大孔樹脂分離純化多糖過氧化氫降解改性產(chǎn)物所得洗脫物仍然具有典型的多糖結(jié)構(gòu)。
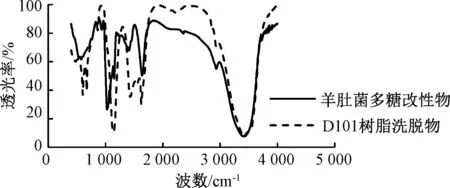
圖9 分離純化前后傅里葉紅外光譜圖
4 討論
本實驗通過篩選D101、AB-8、S-8、NKA-9、LX-17大孔吸附樹脂對羊肚菌多糖改性物中α-淀粉酶抑制組分的吸附效果,確定D101大孔樹脂為目標樹脂。結(jié)果,最佳純化條件為上樣質(zhì)量濃度30 mg/L,pH值7,吸附溫度35 ℃,樹脂用量4 g,上樣體積流量2 BV/h,2 BV 80%乙醇洗脫,洗脫產(chǎn)物對α-淀粉酶抑制率為40.33%,相較純化前提高了2.45倍。紅外圖譜表明,純化后的洗脫物仍具有多糖的吸收特征。本實驗用5倍上樣量及樹脂用量進行放大驗證,重復(fù)3次測得洗脫產(chǎn)物的平均收率為50.17%,對α-淀粉酶的抑制率為40.95%,基本與放大前相當。
目前,分離純化常用的方法有超臨界CO2法、色譜法等,但工藝相對較為復(fù)雜,成本較高[17]。大孔樹脂比表面積較大,并且具有優(yōu)良網(wǎng)狀結(jié)構(gòu),在萜類、黃酮類以及苷類等各種天然產(chǎn)物活性成分分離純化領(lǐng)域應(yīng)用廣泛[18]。本實驗針對羊肚菌多糖改性物溶液中α-淀粉酶抑制物質(zhì)所建立的大孔樹脂分離純化工藝合理、簡單可行,并且分離純化效果較好,為進一步研究羊肚菌多糖及其改性物組分降糖能力提供依據(jù)。結(jié)果,分離純化羊肚菌多糖過氧化氫改性產(chǎn)物所得洗脫物仍然具有典型的多糖結(jié)構(gòu),利用D101大孔樹脂進行了初步的分離提純。下一步,將結(jié)合凝膠層析技術(shù),獲取具有較高α-淀粉酶抑制活性且組分較為單一的多糖成分,為后續(xù)羊肚菌多糖及其改性產(chǎn)物的組成、結(jié)構(gòu)以及活性分析提供基礎(chǔ)。

