解毒散結方聯合中藥靜脈制劑對晚期非小細胞肺癌患者的臨床療效
諸 君, 張國磊, 韓 力, 方志紅
(上海中醫藥大學附屬市中醫醫院腫瘤科,上海 200071)
目前,肺癌在世界上的發病率和死亡率均居前列,對于驅動基因陰性、進展期的非小細胞肺癌患者,接受含鉑兩藥化療的中位生存期只有10個月[1-2]。目前,中醫正應用于肺癌晚期治療,在穩定瘤體、提高生活質量、延長生存期方面療效明確,但缺乏大規模臨床試驗數據[3]。解毒散結方是上海中醫藥大學附屬市中醫醫院腫瘤科的經驗處方,對Lewis肺癌小鼠有明顯抑瘤作用,臨床療效顯著,患者反饋良好,故本研究考察該方聯合中藥靜脈制劑對晚期非小細胞肺癌患者的臨床療效及對免疫功能的調節作用,現報道如下。
1 資料與方法
1.1 一般資料 2017年9月至2018年12月收治于上海中醫藥大學附屬市中醫醫院腫瘤科的208例晚期非小細胞肺癌患者,隨機數字表法分為對照組(103例)和觀察組(105例),其間對照組脫落4例,脫落率為3.88%;觀察組脫落4例,脫落率為3.80%,最終2組分別納入99、101例。其中,對照組年齡31~75歲,平均年齡(60.95±8.72)歲;病程1~3年,平均病程(1.97±0.53)年;疾病分期Ⅲb期34例,Ⅳ期65例;病理類型腺癌65例,鱗癌24例,腺鱗癌10例,而觀察組年齡40~74歲,平均年齡(63.96±4.83)歲;病程1~3年,平均病程(2.06±0.47)年;疾病分期Ⅲb期32例,Ⅳ期69例;病理類型腺癌61例,鱗癌27例,腺鱗癌13例,2組一般資料比較,差異無統計學意義(P>0.05),具有可比性。研究經醫院倫理委員會批準(倫理批件號2017HL-KYYS-24)。
1.2 診斷與分期標準 采用2017年國際肺癌研究學會(IASLC)第八版肺癌TNM分期標準進行分期[4]。根據《中國原發性肺癌診療規范(2015年版) 》[5],組織病理學或細胞病理學診斷為非小細胞肺癌;根據《中藥新藥臨床研究指導原則(試行)》[6],辨證為熱毒瘀結證。
1.3 納入標準 ①符合非小細胞肺癌臨床或(和)病理學診斷標準;②預計生存期≥3個月;③年齡18~75歲,男女不限;④一般狀況PS≤2;⑤具有化療適應證;⑥治療期間未進行靶向、免疫治療;⑦體力狀況評分(KPS評分)≥70分[7];⑧入選觀察前停用其他抗癌藥物1個月以上,納入研究前西醫三線治療方案無效;⑨患者接受治療方案及各項理化檢查,依從性較好,配合隨訪,簽署知情同意書。
1.4 排除標準 ①不符合“1.3”項下納入標準;②未按規定用藥;③合并嚴重心、肝、腎功能損害;④無法判斷療效,或資料不全而影響療效判斷;⑤妊娠期或哺乳期婦女;⑥合并嚴重凝血功能障礙或有明確出血傾向;⑦合并精神及認知功能障礙。
1.5 中止指標 ①出現嚴重并發癥,病情惡化,必須采取緊急措施;②依從性差,不能堅持治療;③接受可能會對研究結果產生影響的放療、化療、靶向、免疫等治療手段;④因個人原因要求退出研究。
1.6 治療手段
1.6.1 中藥靜脈制劑 鴉膽子油乳注射液(10 mL/支,廣州白云山明興制藥有限公司,批號20170311)30 mL,加到0.9%氯化鈉注射液250 mL中靜脈滴注,每天1次,連續14 d,間隔15 d后再進行下一周期治療,共3個周期;或復方苦參注射液(5 mL/支,山西振東制藥股份有限公司生產,批號Z14021231)20 mL,加到0.9%氯化鈉注射液250 mL中靜脈滴注,每天1次,連續14 d,間隔15 d后再進行下一周期治療,共3個周期。
1.6.2 對照組 在中藥靜脈制劑基礎上采用單藥化療方案,吉西他濱(江蘇豪森藥業股份有限公司,批號20170625) 1 000 mg/m2,第1、8天靜脈注射;或培美曲塞 (齊魯制藥有限公司,批號20140505)500 mg/m2,第1天靜脈滴入,每21天為1個周期,共4個。
1.6.3 觀察組 在中藥靜脈制劑基礎上采用解毒散結方,組方藥材石見穿30 g、石上柏30 g、蛇舌草30 g、半枝蓮30 g、夏枯草30 g、海藻30 g,氣虛嚴重者,加黃芪30 g;陰虛者,加沙參9 g、麥冬9 g;嘔吐者,加生姜9 g、半夏6 g,藥材由上海市中醫醫院中藥房提供,加1 000 mL水,在100 ℃下煎煮30 min,煎取藥液400 mL,密封袋封裝,每袋200 mL,每天早晚2次分服,每次1袋,每21天為1個周期,共4個周期。
1.7 療效評價 參照實體瘤療效評價標準(RECIST)[8],分為完全緩解、部分緩解、穩定、進展,客觀緩解率=[(完全緩解例數+部分緩解例數)/總例數]×100%,瘤體控制率= [(完全緩解例數+部分緩解例數+穩定例數)/總例數]×100%。
1.8 指標檢測
1.8.1 試劑與儀器 人源熒光抗體PE-CD127、FITC-CD25、PE-CD4、PE-CD16、FITC-CD3、APC-CD56、FICD11b、PerCP-HLA-DA、FITC-CD33,均購自美國Biolegend公司;PBS緩沖液,購自江蘇凱基生物技術股份有限公司;人外周血淋巴細胞分離液,購自北京索萊寶科技有限公司。低溫離心機,購自美國Thermo Scientific Multifuge公司;流式細胞儀,購自美國Beckman Coulter公司。
1.8.2 生活質量 采用KPS評分進行評價,治療前后各記錄1次。
1.8.3 生存期 ①中位生存期,生存時間為入組時間至死亡時間或隨訪結束時間;②6個月、1年、2年生存率。
1.8.4 細胞免疫指標 取15 mL離心管標記后,加入2 mL人外周血淋巴細胞分離液,再緩慢加入2 mL抗凝管中全血于分離液上層,3 000 r/min離心20 min后抽取中間絮狀淋巴細胞,置于3 mL PBS中,1 000 r/min離心10 min,除去上清,加入400 μL PBS重懸,均等分裝于1.5 mL EP管中,分別加入其相應的熒光抗體3 μL,設置同型對照,在4 ℃下避光孵育30 min,每管加入1 mL PBS,1 000 r/min離心5 min,洗滌1次,除上清,加入100 μL PBS,混勻,流式儀上機檢測CD3、CD4、CD8水平,計算CD4/CD8。
1.8.5 腫瘤微環境細胞因子 ①體液免疫指標,包括IgG、IgA、IgM水平,采用單項免疫擴散法檢測;②外周血Tregs水平,采用Foxp3流式細胞儀檢測;③外周血MDSCs水平,采用流式細胞術檢測。各指標變化程度分為提高(治療后由異常提高≥10%,或由異常恢復到正常)、降低(治療后由異常下降≥10%,或由正常變為異常)、穩定(治療后上升或下降不足10%,或維持在正常范圍)。
1.8.6 安全性指標 ①血常規、肝腎功能指標;②不良事件發生情況。
2 結果
2.1 近期療效 觀察組客觀緩解率、疾病控制率低于對照組(P<0.05),見表1。

表1 2組近期療效比較
2.2 生活質量 治療后,觀察組KPS評分高于對照組(P<0.05),見表2。
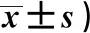
表2 2組KPS評分比較(分,
2.3 中位生存期 治療后,2組中位生存期比較,差異無統計學意義(P>0.05),見圖1。
2.4 生存率 2組6個月、1年、2年生存率比較,差異無統計學意義(P>0.05),見表3。
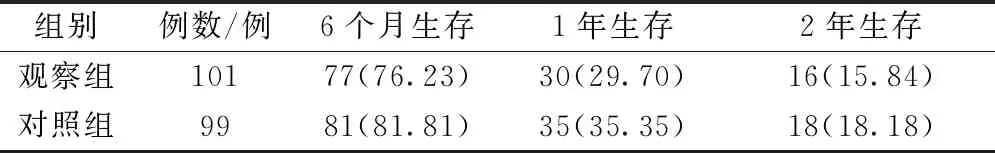
表3 2組生存率比較[例(%)]
2.5 細胞免疫指標 治療后,2組CD3、CD4、CD8水平及CD4/CD8比較,差異無統計學意義(P>0.05),見表4。
表4 2組細胞免疫指標比較
2.6 體液免疫指標 治療后,2組IgG、IgA、IgM水平比較,差異無統計學意義(P>0.05),見表5。
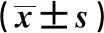
表5 2組體液免疫指標比較
2.7 外周血Tregs、MDSCs水平 治療后,觀察組Tregs、MDSCs水平低于對照組(P<0.05),見表6。
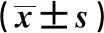
表6 2組外周血Tregs、MDSCs水平比較
2.8 安全性指標 治療后,2組血常規、肝腎功能指標比較,差異無統計學意義(P>0.05),并且均未發生明顯不良事件。
3 討論
中醫對于惡性腫瘤的認識最早源于《黃帝內經》,首次提出了“瘤”的概念,認為“癌毒”是導致其發生、發展的根本因素[9-10],歷代醫家在治療時常加入清熱解毒之劑以蕩滌熱毒。現代藥理研究也表明,以石見穿為代表的清熱解毒類中藥能通過抑制腫瘤細胞增殖、誘導凋亡、調節和增強機體免疫、抑制腫瘤血管生成、逆轉多藥耐藥等機制來控制腫瘤生長和轉移[11-15],并且夏枯草等中藥可通過p53、PI3K/Akt等信號通路在治療中發揮作用[16]。
本研究發現,解毒散結方干預后客觀緩解率、疾病控制率均低于單藥化療,提示化療在縮小瘤體方面可能優于中醫藥;在6個月、1年、2年生存率和中位無進展生存期方面兩者無顯著差異,提示仍需進行更長時間隨訪;KPS評分更高,表明該方可明顯提高晚期非小細胞肺癌患者生活質量。
調節性T細胞(Tregs)在機體免疫自穩態中起到了關鍵作用,對腫瘤的免疫起負向調節作用,其數目在患者腫瘤組織和外周血中增多,并且通常與不良預后相關[17-18]。髓系來源的抑制細胞(MDSCs)可誘導T 細胞發生凋亡,抑制T細胞抗腫瘤免疫應答,此外還會分泌VEGF、MMPs、TGF-β等促血管生成因子,促進腫瘤血管生成[19-20]。本研究發現,解毒散結方對細胞免疫、體液免疫指標無明顯改善作用,但在調節Tregs、MDSCs水平方面優于單藥化療,推測該方抗腫瘤作用可能與其對負性免疫細胞的干預有關。
晚期非小細胞肺癌預后較差,化療仍是主要治療手段,但對三線及以上化療的有效率不足20%,而且無標準方案,可能導致患者因無法耐受不良反應而減量甚至停藥,從而影響療效,故亟需新的補充和替代療法。雖然解毒散結方在近期臨床療效方面稍遜于單藥化療,但生存率、中位無進展生存期已接近后者,同時可顯著改善患者生活質量,抑制體內Tregs、MDSCs水平,而且安全性較好,有望成為備選治療方案。但本研究仍存在不足,如樣本量偏少,可能導致研究結果偏倚;隨訪時間較短,目標人群篩選不夠精確,故今后應增加樣本量,延長隨訪時間,完善相關結局指標,并將中醫藥與免疫調控、微環境、分子生物等領域相結合,深入探討其抗癌作用機制,從而進一步提高臨床療效。

