腎上腺動脈栓塞聯合微波消融術治療腎上腺轉移瘤
梁逸寧, 杜貞華, 王志龍, 林文俐, 左太陽
腎上腺轉移瘤較為常見,在腫瘤血行轉移瘤的好發部位中占第4位[1]。常見腎上腺轉移瘤的原發腫瘤包括肺癌、肝細胞癌、腎透明細胞癌及乳腺癌等[2-4]。腎上腺轉移瘤傳統的治療方式包括外科手術、放射治療及化療等[5-6]。但是大多數患者就診時已失去了最佳外科手術機會,且外科開放性手術創傷大、并發癥多,身體狀況較差的患者難以耐受[7]。影像設備引導下的各種微創介入治療技術以其創傷小、恢復快、可重復、安全性高、并發癥較少等優點,越來越廣泛地應用于實體腫瘤的治療,可有效控制腫瘤的進展并改善患者的預后[8-9]。經導管動脈栓塞術(transarterial embolization,TAE)可以阻斷腫瘤供血,微波消融術(microwave ablation,MWA)可以有效滅活腫瘤,兩者聯合治療具有協同作用,已廣泛應用于原發性肝細胞癌的介入治療[10-13],但兩者聯合治療腎上腺轉移瘤的文獻報道較少。本研究通過分析TAE同步聯合MWA治療21例腎上腺轉移瘤患者的臨床資料,初步探討其可行性、安全性與有效性。
1 資料與方法
1.1 臨床資料
選擇2018年1月至2021年12月在山東第一醫科大學附屬中心醫院介入科接受TAE同步聯合MWA治療的腎上腺轉移瘤患者21例,男性16例,女性5例,年齡為(49.5±2.5)歲。腫瘤最大徑為(5.6±1.2)cm。病理診斷均為腎上腺轉移瘤,原發腫瘤為肝細胞癌15例,肺癌5例,腎透明細胞癌1例。術前8例患者行MRI平掃、13例患者行CT增強掃描評估腫瘤的位置、大小、數量及周圍軟組織受侵犯的情況。單側腎上腺累及17例,其中右側10例,左側7例,雙側腎上腺累及4例。13例患者經TAE后腫瘤進展或復發,5例患者基本狀況較差無法耐受外科手術,3例患者拒絕外科手術。納入標準:①患者年齡大于18歲;②經病理確診為腎上腺轉移瘤;③不適合或無法耐受外科手術;④患者拒絕標準治療或標準治療后病灶進展或復發;⑤預計生存期大于3個月。排除標準:①患者血細胞及血小板計數嚴重降低;②患者具有凝血功能障礙或已知的出血性疾病;③患者基本狀況較差,如肝腎功能不全、惡液質等;④隨訪資料不齊全、不完善。
1.2 介入診療設備與器材
數字減影血管造影機(飛利浦,荷蘭)、ECO-100A1微波治療儀(南京億高)、大孔徑模擬定位CT及屏幕顯示系統(飛利浦,荷蘭)、鉛柵CT引導穿刺定位標尺(南京億高)。一次性微波消融針(南京億高,2 mm×150 mm)、罌粟乙碘油(江蘇恒瑞)、明膠海綿顆粒(杭州艾力康)、聚乙烯醇栓塞微球(江蘇恒瑞)、穿刺針及5 F股動脈鞘管(泰爾茂,日本),RH管(天津哈娜好)。
1.3 TAE同步聯合MWA
術前肌內注射異丙嗪25 mg、哌替啶50 mg,靜脈推注地塞米松5 mg、帕洛諾司瓊0.25 mg。患者取仰臥位。常規準備,局麻下Seldinger技術穿刺右股動脈,置入股動脈鞘管,經鞘管送入RH管,選插靶動脈(腎動脈、腎上腺上動脈、腎上腺中動脈、腎上腺下動脈、腎包膜動脈、腸系膜上動脈或腰動脈等),注入對比劑行數字減影血管造影(digital angiographic subtraction,DSA)檢查。經RH管送入微導管,分別超選腫瘤供血動脈,注入對比劑行DSA檢查以確認腫瘤血管及腫瘤染色,透視下緩慢注入罌粟乙碘油栓塞腫瘤血管,后續注入300~500 μm栓塞微球及560~710 μm明膠海綿顆粒栓塞至腫瘤血管及腫瘤染色消失。術畢拔管、加壓包扎。患者入CT室取仰臥位或俯臥位,先做CT平掃以觀察碘油沉積情況。之后以CT掃描定位來設定穿刺點及進針路線,術區皮膚消毒,鋪巾,1%利多卡因5 mL將穿刺點分別做局部麻醉,用消融針在CT引導下,避開重要臟器及血管按照設計路線穿刺至腎上腺腫物。再次行CT掃描以確認穿刺針位于腫瘤內。之后外接微波治療儀,35~50 W消融5~10 min。術中嚴密監測患者生命體征,針道消融后拔出消融針,術后再次CT掃描觀察有無氣胸、出血及大體消融范圍和病灶的壞死程度。
在栓塞及消融過程中密切監測生命體征,尤其是血壓變化;若出現高血壓危象,則靜推烏拉地爾10 mg,并用烏拉地爾靜脈滴注動態維持血壓。高血壓危象是由腎上腺髓質釋放兒茶酚胺入血引起,與腎上腺素(AE)和去甲腎上腺素(NE)有關,與皮質激素無關[14]。
1.4 復查方法
術后1個月、3個月、半年及1年對患者進行隨訪,行腹部CT/MRI檢查,通過對比病灶治療前后的影像學變化及觀察隨訪結果,根據改良版實體瘤療效評價標準(modified response evaluation criteria in solid tumors,mRECIST)[15]評價治療效果,分為完全緩解(complete release,CR)、部分緩解(partial release,PR)、疾病穩定(stable disease,SD)、疾病進展(progressive disease,PD)。客觀緩解率(objective response rate,ORR)的計算方法為(CR+PR)/(CR+PR+SD+PD)×100%。
若隨訪期間患者的病情進展未達到CR則重復TAE或MWA鞏固治療。隨訪采用住院、電話或門診復診的形式,記錄總生存期(overall survival,OS)及患者的存活狀態。隨訪終點為2021年12月31日或患者死亡。
2 結果
2.1 TAE聯合MWA
TAE聯合MWA的技術成功率為100%。TAE超選擇性插管的成功率為100%。1例男性60歲肝細胞癌并右側腎上腺轉移瘤的患者TAE后的CT檢查顯示病灶碘油沉積良好,消融術后CT檢查顯示病灶基本發生凝固性壞死,術后半年復查CT顯示病灶基本穩定,且碘油沉積良好(圖1)。另1例男性63歲肝細胞癌并左側腎上腺轉移瘤的患者TAE后的CT檢查顯示病灶碘油沉積良好,消融術后CT檢查顯示病灶基本發生凝固性壞死(圖2)。
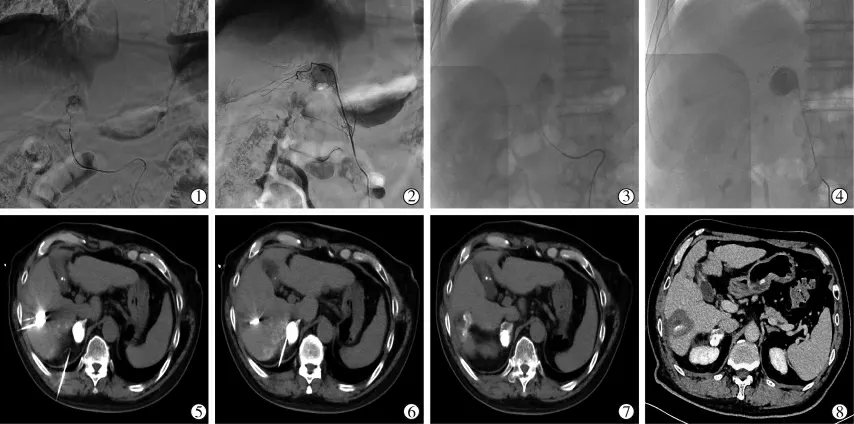
圖1 TAE聯合MWA治療肝細胞癌并右側腎上腺轉移瘤患者
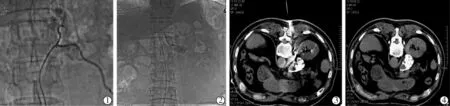
圖2 TAE聯合MWA治療肝細胞癌并左側腎上腺轉移瘤患者
2.2 隨訪
術后隨訪時間為7.5~32.8個月,中位隨訪時間為25.6個月,隨訪過程中無病例失訪。術后1、3、6個月及1年的CR率分別為95.2%(20/21)、95.2%(20/21)、85.7%(18/21)、80.9%(17/21);PR率分別為4.8%(1/21)、4.8%(1/21)、14.3%(3/21)、19.1%(4/21)。客觀緩解率為100%。至隨訪終點,14例生存(66.7%),7例死亡(33.3%),死因為腎上腺轉移瘤或原發腫瘤進展及相關并發癥的發生。其中4例患者為肝功能嚴重破壞導致的自發性出血,2例患者為呼吸及循環系統衰竭,1例患者為腎功能衰竭。中位OS為32.5個月,12、18、24個月總生存率分別為100%、85.7%、66.7%。
2.3 不良反應及并發癥
術中有2例患者出現高血壓危象,術中靜脈推注烏拉地爾10 mg,并用烏拉地爾滴注動態維持血壓。其中1例患者靜脈推注烏拉地爾3 min后出現低血壓,停止滴注烏拉地爾,加壓補充液體量,觀察5 min后,血壓升高并維持在95/70 mmHg(1 mmHg=0.133 kPa)左右。1例雙側腎上腺轉移瘤患者術后呈現出腎上腺功能不全的表現,患者表現為頭暈、淡漠、血壓下降及皮膚色素加深,予以潑尼松對癥治療后好轉。20例患者出現栓塞后綜合征,如腎區疼痛、發熱等,術后予以止痛、消炎、退熱、補液等對癥處理,均得到緩解,無腎上腺周圍器官(腸道、腎臟、輸尿管等)損傷,并未造成腫瘤細胞的種植轉移及其他嚴重不良反應。
3 討論
消融治療已逐漸應用于腎上腺轉移瘤、皮質腺癌、功能性腺瘤、嗜鉻細胞瘤及異位庫欣綜合征等,主要適用于不能或不愿手術、術后復發及放化療后病灶進展的患者。腎上腺轉移瘤的消融方法有射頻消融(radiofrequency ablation,RFA)、冷凍消融和MWA等,上述消融方式各有其優缺點[15-16]。MWA是在超聲、CT、MRI等影像設備的引導下,將消融針插入腫瘤組織內部,利用病灶部位極性分子摩擦產生的高溫,使其發生凝固性壞死,以達到外科手術的效果,實現從內部切除腫瘤的目的[17]。研究表明,MWA的療效和局部腫瘤控制率略高于RFA,且術后并發癥發生率較低[18]。由于MWA是主動性消融,微波的傳導不依賴于組織的導電性,因此與RFA相比,MWA具有更高的腫瘤內溫度、更短的消融時間以及更大的消融范圍[19-20]。此外,相較于RFA,MWA受血流灌注引起的冷卻效應的影響較小,可以均勻滅活靠近血管的腫瘤靶區[19-20]。
在對腎上腺轉移瘤進行MWA時,若直徑為3 mm的血管與靶病變相鄰,則腫瘤區域的快速血液流動會引發散熱效應,導致消融范圍縮小和消融溫度降低,使治療溫度無法完全使腫瘤組織失活,這種散熱效應又稱為熱沉效應。研究表明,TAE聯合MWA可以相互協調、相互補充[21-23]。文獻報道,外科手術預防高血壓危象的方法是結扎腎上腺靜脈[24]。本組21例患者中,有2例出現高血壓危象,1例雙側腎上腺轉移瘤患者術后出現腎上腺功能不全,表現為頭暈、淡漠、血壓下降及皮膚色素加深,予以潑尼松對癥治療后好轉。20例患者出現栓塞后綜合征,對癥處理后緩解。
在腎上腺轉移瘤介入和消融治療過程中最嚴重的并發癥之一是高血壓危象,由于腎上腺屬于內分泌器官,在創傷、手術、感染等各種應激狀態下,容易造成大量兒茶酚胺釋放入血,引發高血壓危象等各種臨床危急癥狀。手術擠壓、消融、栓塞或穿刺均可能引發高血壓危象[25-26]。發生高血壓危象時,容易誘發室性早搏與室顫,若救治不及時會發生心源性休克,甚至呼吸、心跳驟停而導致患者死亡[26]。有學者認為由于MWA比RFA有著更快的升溫速率,溫度更高,更容易誘發高血壓危象[27]。研究表明,RFA及MWA過程中的高血壓危象大多發生于消融開始時,冷凍消融過程中的高血壓危象大多發生于復溫時[27-29]。預防高血壓危象可采用小功率的熱消融,冷凍消融過程自然復溫也可降低高血壓危象的發生概率。既往放療或消融或栓塞后再行消融,發生高血壓危象的概率相對較低[27-29]。一旦發生高血壓危象,需通過內分泌科醫師會診,制定詳細的用藥計劃,先使用α-受體阻滯劑降低血壓后,再使用β-受體阻滯劑。高血壓危象發生時,應選擇起效快,且短效的藥物,如硝普鈉、硝酸甘油、烏拉地爾、酚妥拉明等,同時需備用升壓藥,防止血壓過低。
雙側腎上腺栓塞和消融時需要注意的并發癥是腎上腺皮質功能減退癥。腎上腺有三條供血動脈,即腎上腺上、中、下動脈,分別起源于膈下動脈、腹主動脈、腎動脈開口區,這使得腎上腺轉移瘤很難進行完整的TAE。由于腹主動脈、腎動脈及膈下動脈為腎上腺提供復雜的血液供應,單支動脈栓塞不會導致整個腎上腺梗死。若一側腎上腺發生梗死,對側腺體的完整性將阻止腎上腺功能不全的發生[23]。因此,腎上腺皮質功能減退癥是一種較為少見的并發癥,可予以潑尼松對癥治療[30]。
綜上所述,TAE聯合MWA治療腎上腺轉移瘤技術上可行,并發癥少,安全有效,兩者的協同作用更大。但本研究納入病例尚少,臨床應用仍需要進一步的隨訪及研究。

