鋰離子電池硅基負極材料嵌鋰行為的第一性原理研究
徐天齊, 閆共芹, 王 康
(廣西科技大學 機械與交通工程學院, 柳州 545616)
1 引 言
目前常用的鋰離子電池負極材料有碳基負極材料、硅基負極材料、錫基負極材料和鋰基負極材料等,其中,硅基材料具有高的理論容量(3590 mAh/g[1]),尤其是當鋰離子嵌在硅負極形成Li22Si5時理論容量可高達4200 mAh/g[2],因而被人們廣泛研究. 在鋰離子電池充放電反應過程中,硅負極的脫鋰和嵌鋰很大程度是以LixSi合金進行的,故這種脫鋰或嵌鋰行為又可稱為合金化或去合金化過程. 雖然簡單合金化過程的熱力學和電化學是已知的,但目前人們對于鋰的脫嵌行為的機理仍知之甚少[3]. 通過計算機仿真可以對電池的儲鋰性能進行預測,為優化電池系統提供了有效的工具[4]. 同時計算機模擬可以作為實驗的補充和依據,加快實驗的進程,有效縮短測試的時間.
隨著計算機和科學技術的快速發展,量子力學的第一性原理已廣泛運用于物理學、化學和材料科學等領域. 通過第一性原理,僅需采用5個基本物理常數(電子質量Me、電子電荷e、光速c、普朗克常數h和玻爾茲曼常數Kb)而不依賴其它任何經驗參數即可合理預測微觀體系的結構和性質[5].近年來,第一性原理,尤其是基于密度泛函的第一性原理在材料的設計、合成和分析有許多重大突破,人們對其研究越來越多,目前已經成為了計算材料科學的基礎和核心技術[6]. Hou[7]等人采用基于密度泛函理論的第一性原理,從電子結構對硅的儲鋰性能進行了模擬分析,結果表明,隨著嵌鋰過程的進行,鋰硅合金相的平均嵌鋰電壓逐漸降低,體積膨脹率逐漸增大,硅在嵌鋰過程中形成鋰硅合金相,從而使其導電性增加,通過EIS測試發現進行充放電循環之后的電池阻抗低于初始電池,證明了模擬分析的正確性. Kirklin[8]等人通過第一性原理研究發現鋰離子嵌入SiNi2生成的化合物是NiSi和Li12Si7,當Li繼續嵌入時,與NiSi形成Li12Si7和三元化合物LiNi2Si;Wen[9]等以NiSi2、乙炔黑以及粘結劑聚四氟乙烯,采用研磨制成混合物并制成電池,研究發現,在嵌鋰初期,Li與NiSi2反應生成NiSi和Li12Si7,驗證了Kirklin等人的模擬計算結果.
本文運用Castep模塊,建立硅模型、鋰硅合金模型、硅原胞模型和鋰硅合金原胞模型.原胞模型是晶體中最小的周期性重復單元,而晶胞模型是晶體最小周期性重復單元的幾倍. 研究了不同數量的鋰離子所引起的硅模型的體積變化以及硅負極嵌鋰形成能、嵌鋰電壓以及嵌鋰路徑,并以此來研究硅負極材料的電學性能,同時通過態密度圖分析了鋰離子的嵌入對硅負極材料導電性的影響.
2 理論計算
采用基于密度泛函理論的第一性原理平面波贗勢方法,對硅模型嵌鋰后的晶體結構、形成能以及平均嵌鋰電壓進行計算,對LixSi合金的形成能以及電子結構進行計算,同時對Li2Si合金體相中鋰離子遷移進行計算[10]. 本文運用Castep模塊,計算時所用參數如表1所示.

表1 Castep參數設計
硅負極在嵌鋰時發生的電極反應式如下[11]:
Si+xLi→LixSi
(1)
嵌鋰過程工作電壓為:
(2)

(2)式又可以寫成下式[12]:
(3)
其中,ΔG為吉布斯自由能,由于焓變ΔH和熵變ΔS對嵌鋰電壓影響遠小于ΔE,故在模擬時ΔG近似等于ΔE,因此,平均嵌鋰電壓可近似寫為[13]:
(4)
其中,ΔE由下式給出[14]:
ΔE=E(LixSi8)-E(Si8)-xE(Li)
(5)
或
ΔE=E(LixSi)-E(Si)-xE(Li)
(6)
其中式(5)為硅晶胞嵌入x個鋰離子所產生的能量差,式(6)是計算LixSi的形成能.
嵌鋰前后的體積膨脹率為[14]:
(7)
LixSi理論質量比容量可由下式計算[7]:
Ccal=ΔxF/(3.6MSi)
(8)
其中F為法拉第常數;MSi為硅的相對原子質量為28.086
3 結果與討論
3.1 硅晶胞嵌鋰后晶體結構
圖1為不同數量的鋰離子嵌入硅晶胞后的示意圖. 一個硅晶胞模型中可以嵌入8個鋰離子,圖1(a),(b),(c),(d)分別為在硅晶胞中嵌入0個、1個、3個和8個鋰離子的示意圖. 從圖中可以看出隨著嵌鋰數量的增加,硅晶胞模型中原子發生偏移,模型結構發生扭曲. 這是由于隨著嵌鋰數量的增加,Si—Si鍵被破壞,逐漸形成Si—Li鍵所導致. 同時隨著嵌鋰數量的增加,鋰離子會占據硅原子的空間,使得模型體積發生膨脹. 對嵌入不同數量鋰離子的硅晶胞進行結構優化,結合式(7)計算硅晶胞的體積變化,結果如表2所示.

表2 硅晶胞嵌入不同數量鋰離子后體積的變化

圖 1 不同數量的鋰離子嵌入硅晶胞后的模型
由表2可知,隨著嵌鋰數量的增大,硅晶胞的體積膨脹也在不斷擴大. 當嵌入8個鋰離子時,晶胞體積達到299.249 ?3,體積膨脹達到85.067 %. 由此可見在嵌鋰過程中,硅晶胞的體積效應非常大. 同時可以發現,當硅晶胞中嵌入8個鋰離子時,結構體積非常接近LiSi合金晶胞的體積(314.232 ?3). 這說明在嵌鋰過程中,鋰離子與硅自發的生成了Li—Si鍵,形成了LiSi合金.
3.2 硅晶胞嵌鋰形成能與平均嵌鋰電壓
為了分析硅晶胞在嵌鋰過程中平均嵌鋰電壓的變化,計算了嵌鋰前后體系能量的變化,結果如表3所示.

表3 硅晶胞嵌鋰形成能
由上表可知,隨著硅晶胞的嵌鋰數的增加,其形成能在不斷減小,說明硅晶胞中嵌入8個鋰離子時結構最穩定. 由式(6)計算可得,當嵌鋰數為8時,其平均嵌鋰電壓為2.324 V.
3.3 LixSi的形成能
為了驗證鋰離子在嵌入硅晶胞后是否形成了LixSi合金相,在不考慮嵌鋰過程,只考慮初態和終態的前提下,分析了當硅負極中鋰硅之比達到1、2、2.4、4.4時結構的形成能. LixSi的晶胞參數、形成能及理論容量如表4所示:

表4 LixSi的晶胞參數、形成能及理論容量
由上表可知,合金相的形成能均為負值,說明合金結構在常溫下可以自發進行. 而通過計算可以發現Li7Si3結構形成能最低,說明在嵌鋰過程中最易形成這種穩定的結構. 此外,由于不同合金相的形成能不同,可逆容量會逐漸降低. 同時,形成能較高的合金相在短時間內難以進行脫鋰,故在充放電過程中電流密度的大小也起著重要作用. 通過比較不同鋰硅合金的形成能,可以發現貧鋰相的形成能最高,在嵌鋰過程中不易穩定存在.
3.4 LixSi的電子結構
鋰電池負極材料在充放電過程中的電子結構分析是十分重要的,也是評價負極材料的重要指標. 通過分析嵌鋰前后模型的態密度圖來分析嵌鋰前后導電性的變化. 由于部分模型體積過大,本文僅通過原胞結構[15]進行分析,計算合金相時,用原胞結構能更有效得出電子結構的性質.
圖2所示為硅原胞示意圖. 對硅原胞進行布居分析,結果如表5所示. 與硅晶胞相比,硅原胞中硅原子數量由8個變為2個. 此外,硅原胞中每個硅原子所帶的總電荷為+4e,且僅由s軌道和p軌道提供. 同時硅原子與硅原子之間的鍵長也并未發生改變,這使得采用原胞分析電子結構的準確性得到保證.

表5 硅原胞與硅晶胞原子布居數

圖2 硅原胞結構
圖3為采用贗勢方法計算而得到的硅原胞能帶結構與態密度圖. 圖3(a)為硅原胞的能帶結構圖,其中縱坐標中0 eV處表示費米能級,在0 eV上方為導帶,下方為價帶. 由圖可知,費米能級處無電子態占據,表現出絕緣性質. 同時可以計算出硅的帶隙為0.743 eV,在半導體帶隙范圍[18]. 圖3(b)為硅原胞的分波態密度圖,由圖可以發現,硅的s軌道在費米能級處的電子為0,故硅在費米能級處的電子值由p軌道提供. 按照s軌道和p軌道對態密度的貢獻,可以將圖3(b)中的分波態密度圖分成三部分,從-12 eV到-7 eV左右,s軌道提供的電子數占比最多,從-7 eV至-5 eV左右s軌道與p軌道提供的電子數差不多,從-4.5 eV至12 eV左右,態密度主要由p軌道貢獻. 總體來說,硅的態密度主要由p軌道及少量的s軌道貢獻,符合硅原子是sp3雜化的性質.

圖3 硅原胞的能帶結構圖與分波態密度圖
圖4為LixSi的總態密度圖和分波態密度圖,由圖可知,由于鋰離子的加入,在費米能級處s軌道提供電子的貢獻逐漸增大,從而導致費米能級處的導帶數增加,能帶隙減少,利于電子的能級躍遷. 由總態密度圖可以發現,在費米能級附近的電子能量隨著鋰離子量的增加而逐漸增大,電子導電性逐漸增強. 同時,在費米能級的左側的價帶,p軌道提供的電子數量越來越少. 而當鋰硅合金形式為Li22Si5時,在-10 eV至-5 eV之間態密度只由s軌道貢獻. 圖5是Li原子的態密度圖,可以發現,鋰離子在費米能級處的電子全由s軌道提供,故隨著嵌鋰的增加,LixSi在費米能級處s軌道提供的電子數逐漸增加.

圖4 LixSi的總態密度圖和分波態密度圖

圖5 鋰離子的態密度圖
3.5 Li2Si體相中的鋰離子的遷移
通過對鋰離子嵌入過程的研究,分析了鋰離子在合金形成過程中的遷移路徑及遷移勢壘. 對Li2Si的空位形成能的計算可通過移除Li2Si體相中的一個鋰離子進行. Li2Si體相中移除的一個鋰離子后的能量記為E(Lim-1Sin),單個鋰離子的能量記為E(Li),其中m和n為Li2Si體相中實際的Li及Si原子數,然后通過下式計算空位形成能[16]:
Ef=E(Lim-1Sin)+E(Li)-E(LimSin)
(9)
根據式(9),如圖6所示的Li2Si在1處形成空位所需能量為2.9352 eV,在2處形成空位所需能量為3.0617 eV,與姚胡蓉等人做出的數據接近[17]. 由于Li2Si結構的對稱性,其體相中只有這兩種單鋰空位[18]. 通過計算出的空位形成能表明,在Li2Si體相中很難直接形成鋰空位. 將1處的鋰離子移至3處,需要克服擴散能壘[19]. 運用LST/QST方法中Ts Search任務可計算擴散能壘,精度Medium,如圖7所示,從1處遷移至3處所需克服的勢壘為0.54873 eV. 結果表明,在Li2Si體相中容易發生鋰離子的遷移. 圖8為從1處到3處的過渡態圖,通過分析可以得出,鋰離子的遷移也會對周圍的原子產生影響,所以鋰離子的遷移速率與其周圍的電子濃度存在一定的關系.

圖6 Li2Si中的鋰空位(1,2為合金相中鋰空位,3為1空位鋰原離子遷移后的位置)
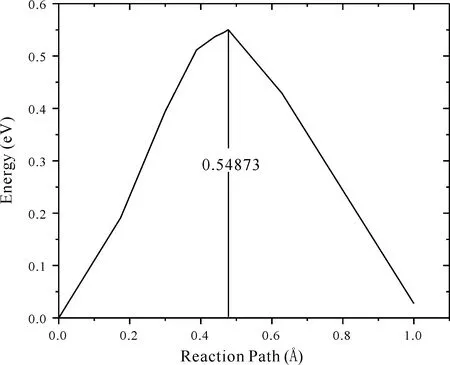
圖7 鋰離子1→3處的遷移勢壘

圖8 鋰離子1→3遷移過渡態圖
4 結 論
本文主要研究了不同數量的鋰離子所引起的硅模型的體積變化以及硅負極嵌鋰形成能、嵌鋰電壓以及通過嵌鋰路徑來研究鋰離子電池硅負極的性能,同時通過態密度圖分析了鋰離子的嵌入對硅負極導電性的影響,主要得出以下結論:
(1)隨著嵌鋰數量的增加,硅晶胞的體積膨脹越來越大,此外鋰離子的嵌入伴隨著合金相的生成,通過計算不同合金相的形成能可知鋰硅合金的形成能先降低再升高,由于合金相的形成能不同,硅材料的可逆容量會逐漸降低.
(2)通過態密度分析,硅在費米能級處的電子值由p軌道提供,隨著嵌鋰數量的增加,費米能級處s軌道提供的電子數增多,使得結構從半導體漸漸轉為金屬結構,同時導電性也逐漸增加.
(3)通過分析體相中的鋰離子遷移,發現空位鋰離子的遷移很容易發生,同時通過分析過渡態圖發現在遷移過程中鋰離子的遷移速率與其周圍的電子濃度存在一定的關系.

