獼猴源大腸桿菌藥敏試驗與高致病性毒力島基因的檢測
韓冬梅,陳柄汛,趙維薇,萬 全,鄧 靜,王 喜,張 博,呂龍寶,肖 鵬,高 洪
(1.云南農業大學動物醫學院,云南 昆明 650201;2. 中國科學院昆明動物研究所,云南 昆明 650201 ;3. 云南農業大學食品科學技術學院,云南 昆明 650201;4. 云南農業大學動物科學技術學院,云南 昆明 650201)
獼猴(Macacamulatta)又稱“恒河猴”,具有與人類相似的生理生化和代謝特征,大腦發達,適應性強,容易馴養繁殖,因此獼猴被廣泛應用于生物學和醫學研究。高質量實驗動物有利于科研工作的順利進行,但是在獼猴的飼養繁育過程中發現其腹瀉發病率較高,不利于養猴業持續高質量發展[1]。引起獼猴腹瀉的原因有很多,其中大腸桿菌(Escherichiacoli,E.coli)是溫血動物腸道中廣泛存在的共生細菌,在一定條件下也是引起腸道疾病的常見病原體[2]。E.coli大量存在于人和動物中,一旦產生致病性E.coli對于養殖場是致命打擊,并且有些飼養管理者會使用抗菌藥對猴群進行集體治療和預防,這導致E.coli耐藥菌株增加,大大提高了飼養成本。
高致病性毒力島(High pathogenicity island,HPI)最初于耶爾森菌中發現,是耶爾森菌中1個35~45 kb 的基因組,攜帶的基因與鐵載體耶爾森桿菌素合成、調節和轉運有關[3]。具有毒力島的基本特征:(1)載有耶爾森菌素與毒力相關的編碼基因; (2)僅存在于強毒株; (3)G+C mol%與耶爾森菌染色體有明顯差異; (4)染色體片段一般大于35 kb; (5)為一緊密、明確的遺傳學單位; (6)一側外緣與酰胺-轉運核糖核酸(Asparagine-transfer ribonucleic acid,asn-tRNA)基因相連; (7)載有“可移動”的基因[4-5]。HPI主要含有與攝取鐵有關的毒力基因簇,編碼參與攝取及合成鐵載體耶爾森桿菌素的鐵抑制蛋白基因及其調節基因,來行使“鐵的攝取功能”[6]。其中鐵調節蛋白2(Iron regulatory protein 2, irp2)基因為鐵調節基因并且核苷酸序列具有高度保守性[7],是HPI的標志基因[8]。大量的研究表明,HPI能介導細菌的致病性,HPI+菌株致病性強于HPI-菌株[9-10]。大量文獻證明,HPI可以通過噬菌體介導的水平轉移存在于不同腸道菌(如大腸埃希菌、構株酸桿菌、克雷伯菌和沙門菌等)[11-13]和不同種屬中,嚴重影響著我國養殖業的健康發展,使養殖場經濟效益變差。因此,不可忽略E.coliHPI+對獼猴養殖業的影響。本試驗通過對采集的23份腹瀉獼猴糞便進行E.coli分離鑒定、HPI全基因組攜帶情況檢測、紙片擴散法檢測和動物回歸試驗,探索HPI基因攜帶率與耐藥性和致病率之間的關系,為研究E.coli引起獼猴腹瀉的致病機理提供科學依據,并為昆明動物研究所靈長類實驗動物飼養繁殖基地的飼養管理和疾病預防提供思路。
1 材料與方法
1.1 材料
1.1.1 樣品采集 于2020年10月在中國科學院昆明動物研究所靈長類實驗動物飼養繁殖基地采集了23只腹瀉獼猴的糞便,離心管收集,冰袋保存運輸。
1.1.2 主要試劑 2×TaqPCR Master Mix,購自北京百泰克生物有限公司;DL2 000 DNA Marker,購自博邁生物科技有限公司;麥康凱瓊脂培養基、LB(Luria-Bertani)瓊脂和LB肉湯,均購自廣東環凱微生物科技有限公司;細菌微量生化反應管,購自杭州濱和微生物試劑有限公司;細菌藥敏紙片,購自杭州天和微生物試劑有限公司;標準革蘭染色液,購自南京森貝伽生物科技有限公司。實驗小鼠品種為昆明小鼠,雌性,體重約為30 g,購自昆明醫科大學[生產許可證號:SCXK(滇)K2020—0004]。
1.2 方法
1.2.1 細菌分離 將采集的腹瀉獼猴源糞便樣品分別用5 mL生理鹽水稀釋,用無菌挑菌環挑取稀釋后的糞便樣品在麥康凱培養基平板上劃線,放入37 ℃恒溫培養箱隔夜培養。待第2天早上用挑菌環挑取麥康凱平板上的粉紅色單菌落在LB平板上劃線,放入37 ℃恒溫培養箱培養后取單菌落接種于LB液體培養基,37 ℃、200 r/min振蕩培養,至OD600值達0.6~0.8,于4 ℃冰箱保存。
1.2.2 細菌革蘭染色及生化鑒定 取LB平板上的單菌落,根據革蘭染色液說明書的方法分別進行涂片固定、初染、水洗、媒染、脫色、復染6個步驟,最后在油鏡下觀察細菌形態特征。E.coli生化鑒定按照說明書的方法取LB液體純培養物分別接種于麥芽糖、乳糖、蛋白胨、硫化氫、甘露醇、尿素、葡萄糖共7個微量生化鑒定管。
1.2.3 分離菌株HPI基因檢測 在 NCBI 網站 GenBank 中檢索E.coliHPI 中 12 個基因的序列,通過 BLAST 得到各基因編碼區(Coding sequence,CDS)的保守區,使用 Primer 5.0 軟件設計引物,引物由碩擎生物技術有限公司合成,引物序列見表1。

表1 引物序列
取純化菌液進行PCR擴增,PCR反應體系為20 μL:模板1 μL,2×TaqMaster Mix 10 μL,上、下游引物各1 μL,去離子水7 μL。PCR反應條件:95 ℃預變性5 min;94 ℃變性30 s,退火(退火溫度見表1)30 s,72 ℃延伸1 min,共34個循環;72 ℃終延伸10 min。PCR擴增產物以 2%瓊脂糖凝膠進行電泳鑒定,最后在凝膠成像系統中觀察并拍照。
1.2.4 藥敏試驗 采用世界衛生組織(World Health Organization,WHO)推薦的紙片法(Kirby-Baure)將分離純化的E.coli菌液稀釋至0.5麥氏單位,取 200 μL菌液均勻致密地涂布在LB瓊脂培養基上,取阿米卡星、多黏菌素、氯霉素、環丙沙星、頭孢哌酮、頭孢噻肟、苯唑西林、四環素、頭孢唑林、頭孢曲松等藥敏片均勻貼到培養基表面,為防止藥敏紙片掉落先平置放入37 ℃恒溫培養箱1 h后,再倒置培養18~24 h觀察藥敏結果。按美國臨床和實驗室標準協會(Clinical and Laboratory Standards Institute,CLSI)標準進行藥敏試驗結果判斷。
1.2.5 致病性試驗 取12只健康的小鼠隨機分為3個組:HPI陽性(HPI+)組、HPI陰性(HPI-)組和空白組,每組4只。將篩選出的攜帶HPI全基因組的E.coli感染豬小腸上皮細胞,觀察出現致細胞病變效應(Cytopathic effect,CPE)最明顯的菌株選定為HPI+菌株,從HPI基因攜帶率為0的E.coli菌株中隨機選出1株作為HPI-菌。隨后將HPI+和HPI-菌液都稀釋至0.5個麥氏單位,分別腹腔注射0.5 mL菌液于對應分組的小鼠,空白組腹腔注射0.5 mL LB液體培養基。3個組小鼠分別飼養并觀察,記錄各組小鼠臨床表現及死亡情況,剖檢死亡小鼠,取腸道組織分離細菌并鑒定。
1.2.6E.coliHPI全基因組測序 將篩選出攜帶HPI全基因組的E.coli感染豬小腸上皮細胞,觀察出現CPE最明顯的2株菌株(H-7和H-23)培養至對數期,委托北京擎科生物科技有限公司進行全基因組測序。為了更加直觀地了解基因在正、反義鏈上的分布情況、基因組序列信息、基因組序列的GC含量等,構建H-7、H-23菌株基因組圈圖并進行基因功能注釋,包括蛋白相鄰類的聚簇(Clusters of Orthologous Groups,COG)、基因本體(Gene Ontology,GO)和京都基因和基因組百科全書(Kyoto Encyclopedia of Genesand Genomes,KEGG)。
2 結果
2.1 細菌分離與鑒定 本試驗從23份腹瀉樣品中成功分離獲得23株分離菌,分離率為 100%。分離菌株在麥康凱培養基上為桃紅色的單菌落(圖1A),在LB平板上為突起、光滑、圓形的單菌落(圖1B),革蘭染色呈紅色短桿狀,成對或單個出現(圖1C)。
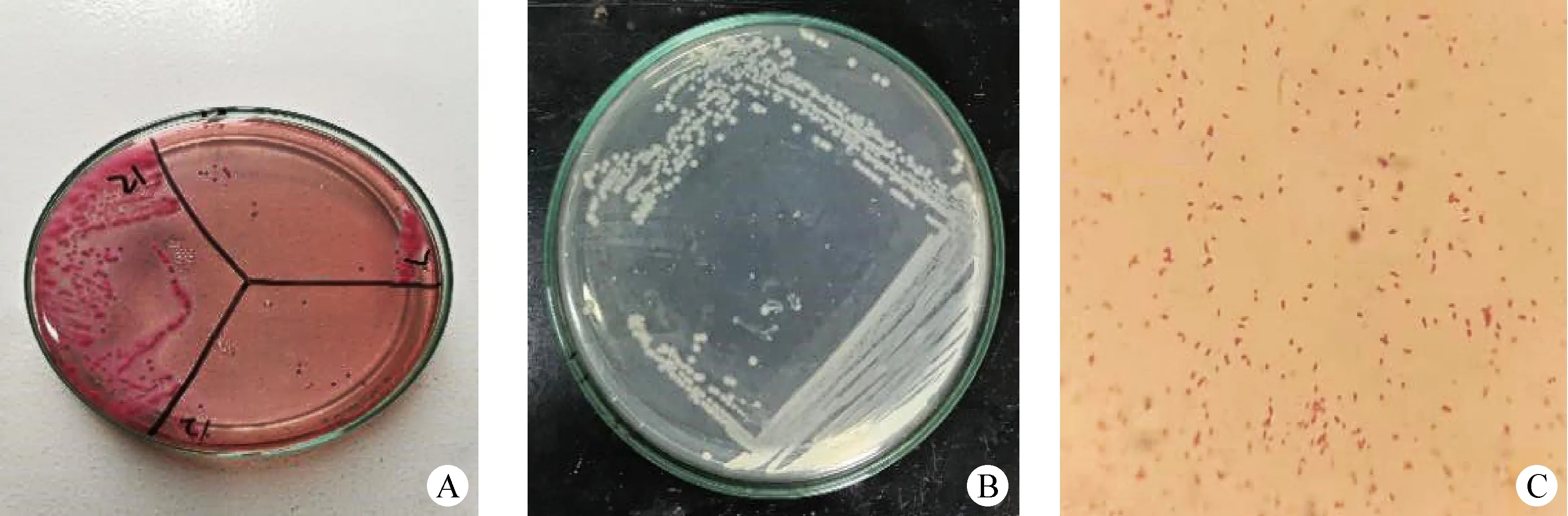
圖1 細菌分離結果
將分離菌株接種于細菌微量生化管,鑒定結果如表2所示,分離菌均能利用葡萄糖、乳糖、麥芽糖、甘露醇、蛋白胨,產酸產氣,硫化氫試驗和尿素試驗結果均為陰性,符合E.coli特性。

表2 菌株生化鑒定結果
2.2 分離菌株HPI基因檢測E.coliHPI 12個全島基因檢測的凝膠電泳成像結果見圖2,HPI基因攜帶情況為23株E.coli中21株含HPI基因,攜帶率為91.30%,其中共11株E.coli檢測出含irp2基因,陽性率為47.83%;15株E.coli檢測出含irp1基因,陽性率為65.22%;8株E.coli檢測出含irp3基因,陽性率為34.78%;11株E.coli檢測出含irp4基因,陽性率為47.83%,16株E.coli檢測出含irp5基因,陽性率為69.57%;13株E.coli檢測出含irp6基因,陽性率為56.62%;10株E.coli檢測出含irp7基因,陽性率為43.48%;9株E.coli檢測出含irp8基因,陽性率為39.13%;10株E.coli檢測出含irp9基因,陽性率為43.48%;8株E.coli檢測出含fyuA基因,陽性率為34.78%,這8株菌株同時也檢出全部含irp2基因,陽性率為100%;15株E.coli檢測出含intB基因,陽性率為65.22%;6株E.coli檢測出含ybtA基因,陽性率為26.09%。該批樣品ybtA基因攜帶率最低,為26.09%,irp5基因攜帶率最高,為69.57%,其中攜帶HPI全島基因的E.coli共有5株,占樣品總量的21.74%。

圖2 HPI基因的PCR擴增
2.3 藥敏試驗 5株攜帶HPI全島基因的E.coli對試驗藥物多數呈耐藥狀態,對頭孢類藥物中頭孢哌酮、頭孢噻肟、頭孢曲松和頭孢唑林具有耐藥性的分別有4、4、4株和5株;對氯霉素、阿米卡星、環丙沙星、苯唑西林和四環素具有耐藥性的分別有1、3、3、5株和5株;這5株E.coliHPI+對多黏菌素的耐藥性都處于中介(表3)。5株攜帶HPI全島的E.coli都表現為多重耐藥,全部耐3種以上抗菌藥。

表3 5株攜帶HPI全島基因大腸桿菌分離株的藥敏試驗結果
2.4 致病性試驗 小鼠感染細菌后12 h的存活情況如圖3所示,HPI+組小鼠感染HPI+菌株在8 h內全部死亡,占100%,而HPI-組感染HPI-菌株的小鼠在12 h內有1只小鼠死亡,占25%,空白組小鼠始終保持正常。死亡小鼠被毛粗亂無光澤,肛門附近沾有糞便,剖檢小鼠發現肝淤血呈黑褐色,胃膨大,內含黃白色物體,小腸菲薄,腸內充滿氣體和淡黃色稀薄內容物,黏膜充血呈淡紅色(圖4)。取HPI+組死亡的小鼠腸道進行組織涂板后,分離獲得的菌株與攻毒菌一樣,均為E.coli,且從HPI+組死亡小鼠中分離出的E.coli攜帶HPI的陽性率為100%。

圖3 小鼠存活情況
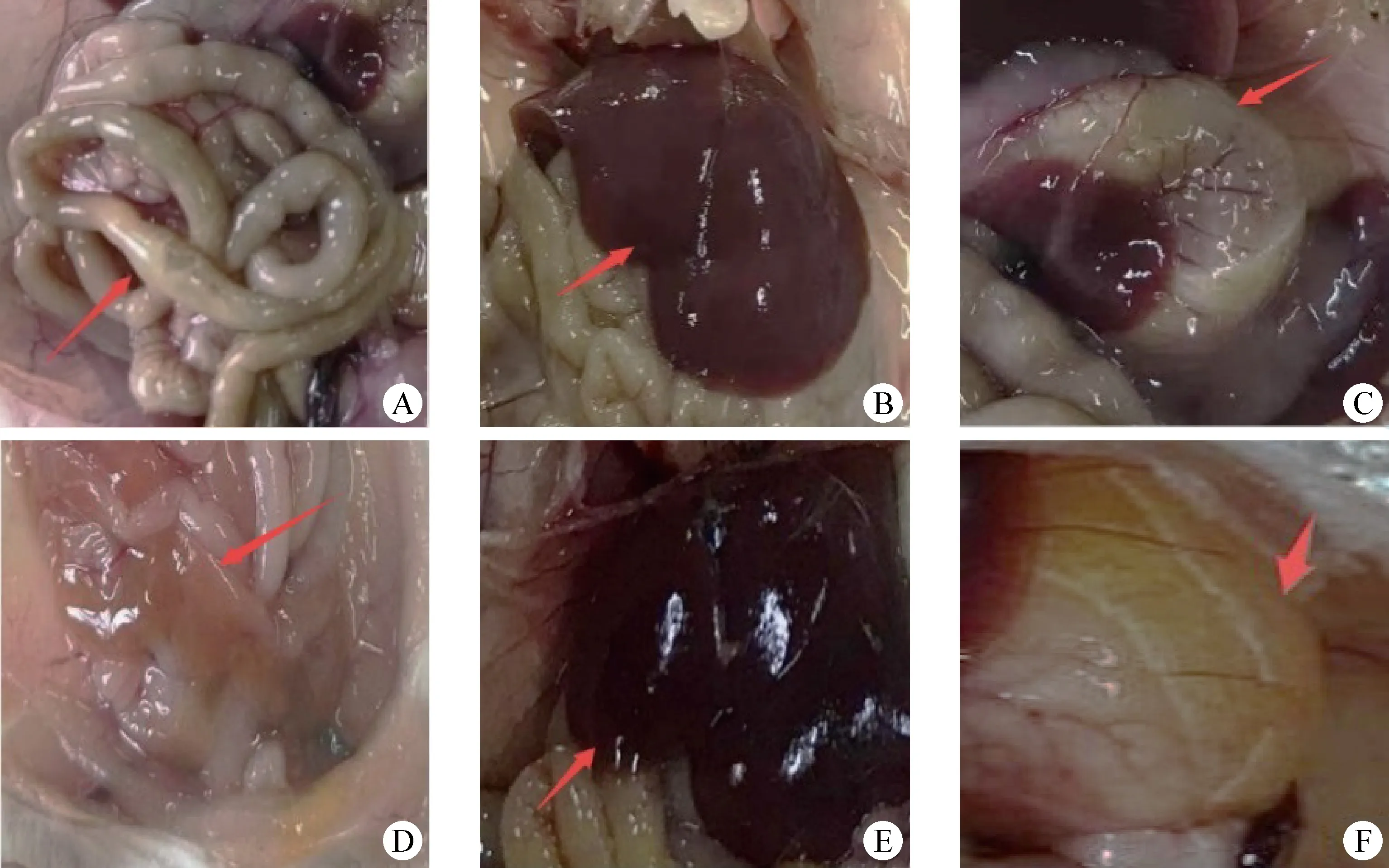
圖4 小鼠剖檢結果
2.5 菌株H-7和H-23基因組圈圖和基因功能注釋
2.5.1 菌株H-7和H-23基因組圈圖 通過 Prokka(1.13)軟件對菌株H-7和H-23的高通量測序結果進行分析,H-7預 測 到5 300個編碼基因,其總長4 728 917 bp,平均長度892 bp。非編碼核糖核酸(Ribonucleic acid,RNA)預測中,核糖體核糖核酸(Ribosomal ribonucleic acid,rRNA)有24個、轉運核糖核酸(Transfer ribonucleic acid,tRNA)有96個、轉運-信使核糖核酸(Transfer-messenger ribonucleic acid,tmRNA)有1個、其他核糖核酸(Miscellaneous ribonucleic acid,misRNA)有236個;H-23預測到5 460個編碼基因,其總長4 811 637 bp,平均長度881 bp。非編碼RNA預測中,rRNA有24個、tRNA有89個、tmRNA有1個、miscRNA有212個。利用預測得到的基因組信息用Circlize繪制H-7、H-23基因組圈圖(圖5),H-7基因組全長5 273 592 bp,G+C mol%為50.45%;H-23基因組全長5 415 449 bp,G+C mol%為50.32%。菌株H-7和H-23的基因圈圖由外到內第1圈為基因組序列信息;第2圈為基因組序列的GC含量曲線,可見該菌株在全基因組平均GC含量線中上下波動頻繁,但波動幅度不大;第3圈為基因組序列的GC skew曲線以2 000 bp為一滑窗在基因組上滑動,統計的平均GC含量;虛線展示了GC skew為0的參考線;第4圈為二代測序深度及覆蓋度信息以2 000 bp為一滑窗在基因組上滑動,統計的平均測序深度,反應出不同區域的Reads覆蓋情況;虛線展示了整體水平的平均Reads覆蓋度;第5圈為三代測序深度及覆蓋度信息以2 000 bp為一滑窗在基因組上滑動,統計的平均測序深度,反應出不同區域的Reads覆蓋情況;虛線展示了整體水平的平均Reads覆蓋度;第6圈展示了參考基因組中的基因編碼區(CDS)以及非編碼RNA區(rRNA、tRNA),以內外兩層表示,外層代表正鏈,內層代表負鏈。

圖5 H-7(A)和H-23(B)基因組圈圖
2.5.2 菌株H-7和H-23的COG 注釋 將H-7、H-23菌株預測得到的基因序列與 COG功能數據庫做 BLAST+(2.9.0+)比對,得到的基因功能注釋結果如圖6所示,H-7和H-23分離株基因通過COG分析,分別得到2 870個和2 782個基因信息分到22類COG中,主要與碳水化合物轉運和代謝(G)、氨基酸轉運和代謝(E)、能量生產和轉化(C)有關。

圖6 H-7(A)和H-23(B) COG 結果分類
2.5.3 菌株H-7和H-23的GO注釋 將H-7和H-23分離株基因組數據通過GO數據庫注釋結果,如圖7所示,分別共有7 563個和7 651個基因,分為生物學過程、細胞成分和分子功能三大類,大部分基因富集在細胞成分。

圖7 H-7(A)和H-23(B)GO注釋結果分類
2.5.4 菌株H-7和H-23的KEGG 注釋 使用KEGG數據庫對H-7菌株的2 818個基因和H-23菌株的2 846個基因進行注釋,并將基因分為五大類,主要分布為細胞過程、環境信息處理、遺傳信息處理、代謝和生物系統。其大部分基因主要富集在碳代謝過程,如圖8所示。

圖8 H-7(A)和H-23(B) KEGG pathway結果分類
3 討論
獼猴作為我國使用最廣泛的實驗動物,我國共有6個亞種,分別為海南亞種、指名亞種、川西亞種、西藏亞種、福建亞種和河北亞種,均為國家二級保護動物[14]。實驗動物的健康問題影響著試驗結果的可靠性,而獼猴腹瀉在靈長類動物飼養基地是較為常見的一種疾病,發病后會使獼猴營養不良、繁殖率降低,甚至會導致仔猴死亡[15],嚴重危害靈長類動物的飼養管理,不利于高質量實驗動物的產出,應該引起高度重視。本試驗采集的23份腹瀉獼猴糞便,經革蘭染色、生化鑒定分離得到23株E.coli,分離率為100%。在23株E.coli中HPI各基因攜帶率由高到低為irp5(69.57%)>irp1(65.22%)=intB(65.22%)>irp6(56.62%)>irp2(47.83%)=irp4(47.83%)>irp7(43.48%)=irp9(43.48%)>irp8(39.13%)>irp3(34.78%)=fyuA(34.78%)>ybtA(26.09%),說明HPI各基因攜帶率具有差異。其中fyuA攜帶率比irp2低,可能是由于fyuA處于毒力島功能核心區的邊緣,HIP的不穩定性使其在不斷進化的過程中,更易于被破壞和改變[16]。本試驗結果顯示從獼猴腹瀉糞便中分離出來的E.coli存在HPI,耶爾森菌素 (Yersiniabactin,Ybt)鐵載體介導的鐵獲取是HPI的主要功能,E.coli中存在HPI可增強E.coli的環境適應力和感染力。其次,雖然E.coli中存在多種鐵獲取系統,但Ybt鐵載體對Fe3+具有較高的親和力,有研究表明鐵載體不僅在鐵運輸中起作用,還可能抑制宿主免疫應答[17-18]。HPI不僅是豬源、禽源、兔源等常見動物E.coli的重要毒力因子[19-20],還存在于日常生活不常見的動物中。如史秋梅等[21]報道在腹瀉水貂源性E.coli中檢測出HPI基因irp2和fyuA;高平光等[22]報道在腹瀉的6只狐貍中有4只狐貍的E.coli檢測出含有HPI基因irp2和fyuA;徐繼英等[23]報道在奶牛源E.coli也檢測出含HPI基因irp2和fyuA;宋曉莉等[24]通過對10份腹瀉羔羊源糞便進行增菌培養,制備DNA模板,并用PCR方法進行檢測,結果發現其中攜帶HPI的E.coli占樣品的一半,表明HPI已經通過質粒水平轉移[25],在不同種屬間廣泛存在,嚴重危害公共安全,其潛在的流行病學意義不容忽視。本試驗成功分離出的獼猴源致病性E.coliHPI+菌株為耶爾森菌HPI在不同種屬間水平轉移提供了重要依據。本試驗分離攜帶HPI全基因組的5株E.coli對10種常用獸用抗菌藥的耐藥率都較高,其中5株E.coliHPI+分離株對苯唑西林、四環素和頭孢唑林均能產生耐藥性,只有對氯霉素和多黏菌素耐藥性較低,故在獼猴飼養管理實際生產中可以聯合使用氯霉素和多黏菌素進行治療。在致病性試驗中小鼠腹部注射E.coliHPI+菌后在8 h內4只全部死亡,而接種E.coliHPI-菌的小鼠在12 h內僅死亡1只。說明含HPI強毒力島會增強E.coli的致病性。本試驗通過高通量測序獲得了H-7、H-23基因組圖譜、GO、COG和KEGG注釋,通過GO、COG、KEGG注釋進一步清楚了解E.coliHPI+菌株中編碼基因的作用方式、特征以及所參與的代謝通路,為E.coliHPI+分子致病機制研究提供了初步線索。
綜上所述,23份獼猴源性腹瀉樣品中分離鑒定得到23株E.coli,分離率為100%,其中攜帶HPI基因有21株,占91.30%,攜帶HPI全島菌株有5株,占21.74%。HPI通過水平轉移存在于不同源性的E.coli中,嚴重威脅公共衛生安全,后續可以深入研究獼猴源E.coliHPI+菌株的致病機理,為預防獼猴腹瀉病提供科學依據。藥敏試驗說明攜帶HPI全島基因的E.coli耐藥性極高,提示可以進一步研究高耐藥性是否與攜帶HPI有關。通過高通量測序獲得了基因組圖譜、GO、COG和KEGG注釋,得到了大量的生物學信息,可為更好地了解E.coliHPI的發病機制提供參考。

