促炎因子、生殖內分泌激素、脂肪因子對多囊卵巢綜合征發病的影響及其交互作用
馮奕習,陳見輝,李漢秋,彭偉如,傅錦堅,黃雪梅,呂慧賢
多囊卵巢綜合征(polycystic ovary syndrome, PCOS)發病率呈逐年遞增趨勢[1-2]。目前,該病已成為影響女性健康最為嚴重的疾病之一,并受到全世界研究學者們的廣泛關注。PCOS是一種以排卵功能障礙和雄激素分泌過多為主要臨床表現的復雜性疾病[3],不但會造成患者出現如月經失調、不孕、多毛、肥胖等癥狀,還會增加患者高血壓、糖尿病、脂代謝異常等疾病的患病風險,使女性身心健康受到嚴重威脅[4-6]。然而目前對于PCOS的致病因素及各因素間相互作用關系尚未完全闡明。為此,本研究分析促炎因子、生殖內分泌激素、脂肪因子對PCOS的影響及其交互作用,擬探究PCOS患病因素間作用效應。
1 資料與方法
1.1一般資料 將2020年1月—2022年1月于我院內分泌科就診的PCOS 100例作為PCOS組。納入標準:確診PCOS患者;血糖正常、無高雄激素疾病、超聲檢查結果示排卵無異常者;排除標準:因精神疾病無法配合研究者;伴有高血壓病、糖尿病、甲狀腺功能異常等患者;近半年有激素藥物服用史患者。將同期于我院進行體檢的健康女性100例作為健康組。參與研究者均簽署知情同意書,且本研究經醫院倫理委員會審核通過。
1.2觀察指標
1.2.1一般情況:記錄并分析2組年齡、身高、體質量及體質量指數(BMI)。
1.2.2血液學指標:2組于清晨抽取靜脈血,測定空腹血糖(FBG)、胰島素(INS)、生殖內分泌激素[促卵泡激素(FSH)、黃體生成激素(LH)、總睪酮(T)、抗苗勒管激素(AMH)]、脂肪因子[脂聯素(ADPN)、瘦素(LEP)、視黃醇結合蛋白(RBP)]、促炎因子[超敏C反應蛋白(hs-CRP)、淀粉樣蛋白A(SAA)、kruppel樣因子7(KLF7)、糖類抗原125(CA125)、人趨化因子(FK)、單核細胞趨化蛋白-1(MCP-1)]水平。
1.2.3穩態模型-胰島素抵抗指數(HOMA-IR):計算2組HOMA-IR,HOMA-IR=FBG(mmol/L)×空腹INS(μU/ml)/22.5,其中系數22.5是校正因子,是指在正常理想個體中5 μU/ml血漿胰島素對應4.5 mmol/L的血糖水平。

2 結果
2.1一般資料及實驗室指標比較 2組年齡、身高、體質量比較差異無統計學意義(P>0.05);PCOS組BMI、生殖內分泌激素(FSH、LH、T、AMH)、脂肪因子(ADPN、RBP)、促炎因子(hs-CRP、KLF7、CA125、MCP-1)、血糖相關指標(INS、FBG、HOMA-IR)與健康組比較差異有統計學意義(P<0.05,P<0.01)。見表1。
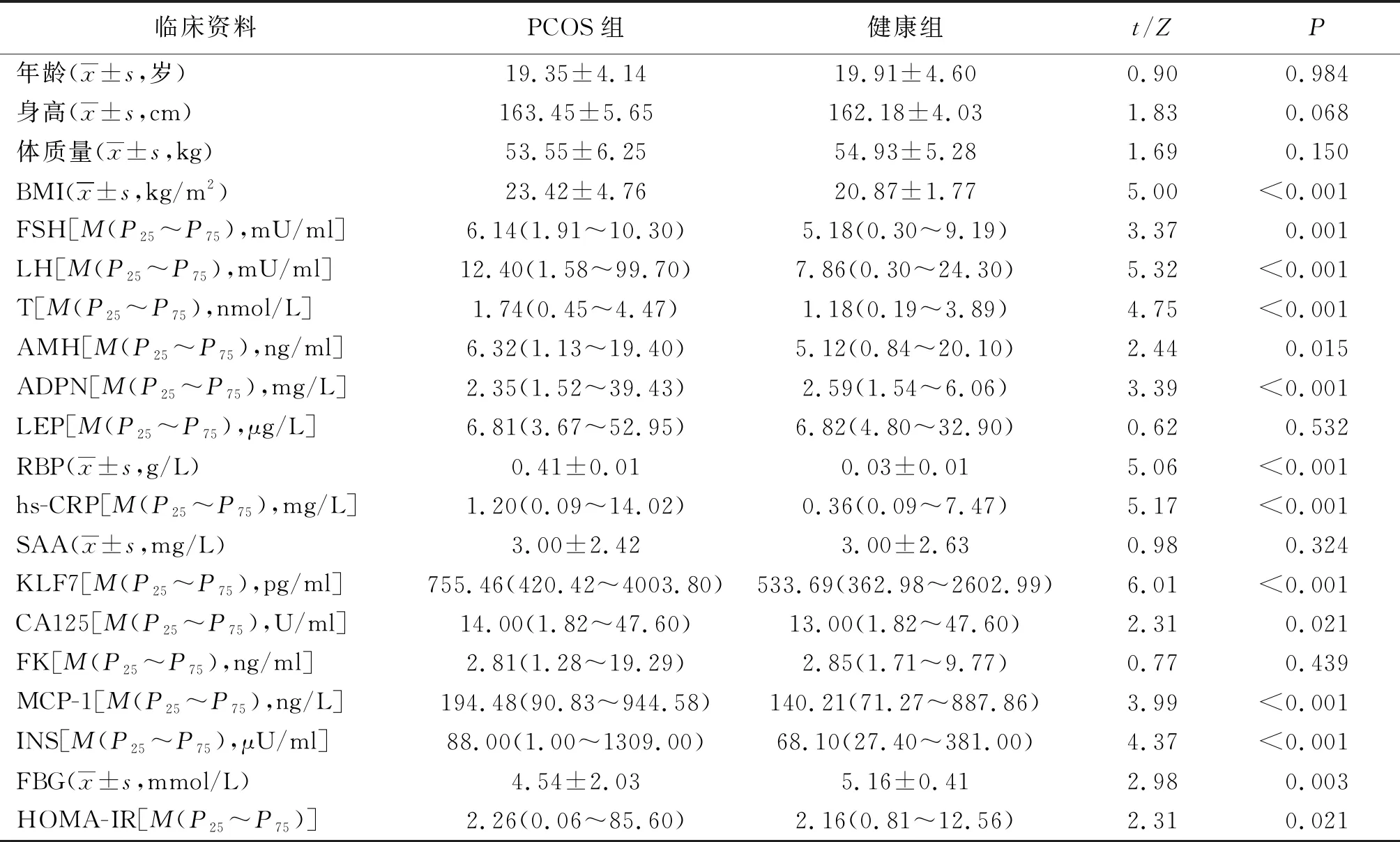
表1 2組一般資料及實驗室指標比較
2.2促炎因子、生殖內分泌激素、脂肪因子與PCOS的關系 將單因素分析差異有統計學意義的因素(INS和FBG除外,因已納入HOMA-IR進行分析)納入多因素Logistic回歸分析,采用Backward LR的模式,分析PCOS發病的影響因素,結果顯示,BMI、KLF7、T、LH、ADPN、hs-CRP、RBP、HOMA-IR是PCOS發病的影響因素(P<0.05,P<0.01)。見表2。
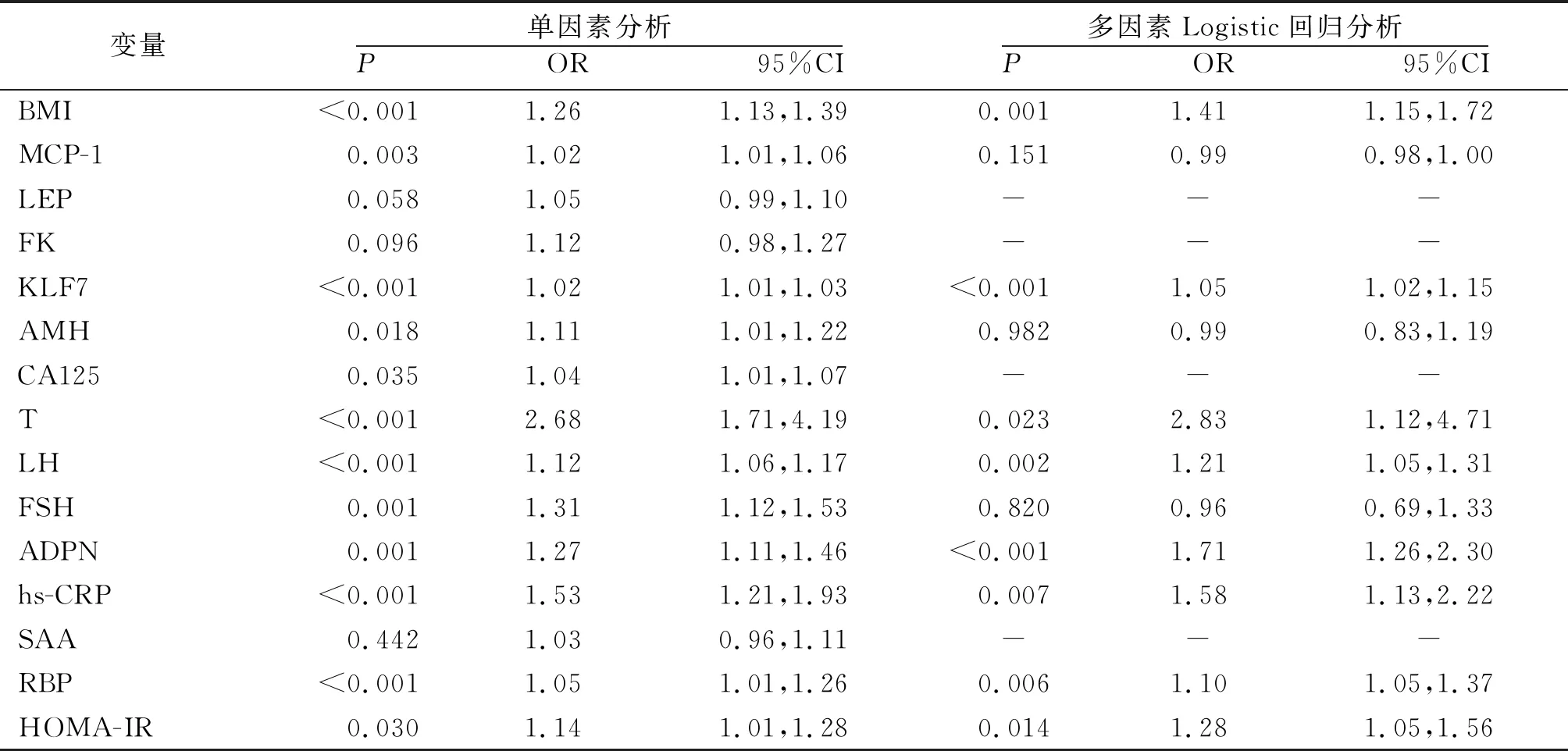
表2 促炎因子、生殖內分泌激素、脂肪因子與PCOS的關系
2.3促炎因子異常、生殖內分泌激素異常、脂肪因子異常對PCOS患病的交互作用 將上述差異有統計學意義的8個因素分為3組,將BMI、生殖內分泌激素(T、LH)分別與血液其他脂肪因子、促炎因子及胰島素抵抗指數進行相乘交互作用,分析PCOS患者體內生殖內分泌激素、脂肪細胞功能障礙和慢性炎癥狀態,采用多因素Logistic回歸分析,采用Backward LR的模式,計算體內代謝產物之間是否存在交互作用,結果顯示,BMI與脂肪因子、促炎因子及HOMA-IR均有正向交互作用(P<0.05,P<0.01);T與KLF7、ADPN、hs-CRP及HOMA-IR有正向交互作用(P<0.01);LH與KLF7、ADPN、hs-CRP及HOMA-IR有正向交互作用(P<0.05,P<0.01)。見表3~5。
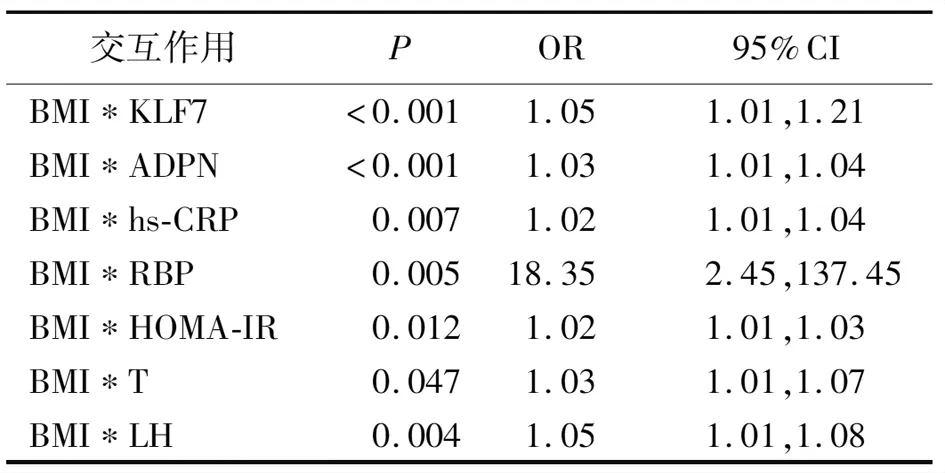
表3 BMI與PCOS患者脂肪因子、炎性因子及胰島素抵抗指數的交互作用結果

表4 T與PCOS患者脂肪因子、炎性因子及胰島素抵抗指數的交互作用結果
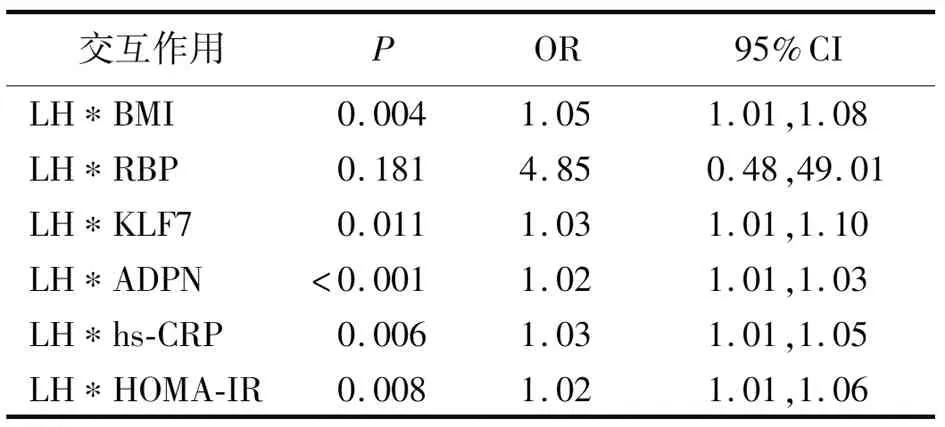
表5 LH與PCOS患者脂肪因子、炎性因子及胰島素抵抗指數的交互作用結果
3 討論
既往文獻報道,LH、LH/FSH異常升高是PCOS患者的主要特征[7-9],但由于LH/FSH比值受BMI、胰島素抵抗等因素的影響,使其升高程度對于PCOS的診斷價值目前仍有爭議。睪丸是T的主要生成器官,女性卵巢也可少量分泌,發揮雄性激素作用,其水平異常升高,將導致女性患者出現高雄激素血癥,使卵巢異常增生,引起排卵障礙[10]。本研究結果顯示,PCOS患者T含量高于健康組,提示此指標的異常對于診斷PCOS具有一定價值。胰島素抵抗是PCOS的重要代謝特點,其原因可能與胰島素的異常分泌促進LH釋放有關。既往研究發現,PCOS患者胰島素異常分泌可降低腦垂體對GnRH的反應,進而減少LH[11],但由于其作用機制較復雜,目前仍未完全闡明。隨著對PCOS發病影響因素研究的深入,越來越多的研究證實PCOS是一種與慢性炎癥密切相關的女性生殖內分泌疾病。本研究結果顯示,BMI、KLF7、T、LH、ADPN、hs-CRP、RBP、HOMA-IR是PCOS發病的影響因素,與既往研究結果一致。
本研究多因素Logistic回歸分析發現,BMI、脂肪因子、促炎因子及HOMA-IR之間均有交互作用關系,且PCOS組上述指標均較健康組升高,提示BMI、脂肪因子、促炎因子及HOMA-IR共同參與PCOS的發病過程。BMI是評價個體肥胖程度的重要指標,BMI較低患者,其PCOS患病風險較低[12-14],且隨著患者BMI的升高,其體內脂肪因子常出現表達異常,而脂肪因子異常可導致糖脂代謝異常、炎癥等相關疾病的發生,以上各因子表達及代謝的異常均可導致PCOS的發生[13-14]。
既往學者通過基因多態性和關聯分析發現,KLF7是影響糖尿病發生的重要基因,其可在脂肪組織中發揮重要作用,是改善胰島素抵抗、減輕肥胖的重要因素[15]。相關研究結果顯示,促炎因子可介導肥胖引起的脂肪組織炎癥反應,促使成熟脂肪細胞中過表達KLF7[16],而過表達的KLF7會導致ADPN的降低[17],引發胰島素抵抗[18],而胰島素抵抗可導致LH、T的異常表達[19],增加PCOS的發病風險。本研究結果與上述文獻報道一致。
綜上所述,BMI、KLF7、T、LH、ADPN、hs-CRP、RBP、HOMA-IR是PCOS發病危險因素,且BMI與脂肪因子、促炎因子及胰島素抵抗指數均有交互作用,T與KLF7、ADPN、hs-CRP及胰島素抵抗指數有交互作用,LH與KLF7、ADPN、hs-CRP及胰島素抵抗指數有交互作用。

