胰腺巨大包裹性壞死穿刺后導致醫源性結腸瘺1例
彭思揚 姚倩 胡楊 熊慧芳 陳幼祥 呂農華 劉丕
南昌大學第一附屬醫院消化科,南昌 330006
【提要】 重癥急性胰腺炎后期出現感染性胰腺壞死時常常需要清創引流,本文報道1例重癥急性胰腺炎后出現巨大包裹性壞死患者,在B超引導下行穿刺置管術造成醫源性結腸瘺,經采取內鏡微創方法后治療愈合。
患者女,50歲。因“持續性上腹痛10 d”入院。患者既往膽囊結石病史4年,無酗酒、無高脂血癥等相關病史。10 d前患者因餐后突發持續性上腹痛在當地醫院就診,診斷為重癥急性膽源性胰腺炎,給予抑酸、抑酶、補液、抗感染等治療后,腹圍增大呈現膨隆改變,復查CT后提示急性壞死性胰腺炎并急性壞死物積聚,于2020年3月8日轉診至南昌大學第一附屬醫院消化內科。入院實驗室檢查:白細胞13.49×109/L,C-反應蛋白230.52 mg/L,降鈣素原1.56 ng/ml。繼續予以抑酸、抑酶、補液、抗感染等治療。3月11日置入空腸營養管給予腸內營養治療。3月20日復查白細胞為6.70×109/L,C-反應蛋白44.4 mg/L,降鈣素原0.91 ng/ml,均較前有所下降,但患者腹脹、腹痛進行性加重。3月21日復查CT,提示胰腺頭部及體尾部出現巨大包裹性壞死(圖1A)。考慮到患者腹痛劇烈,且腹脹進行性加重,隨時有可能出現包裹性壞死破裂或者感染的風險,遂于3月22日行急診床旁超聲引導下包裹性壞死穿刺置管術,引流出暗紅色血性液體。送檢穿刺液,淀粉酶為27 510 U/L,提示可能存在胰瘺。術后患者腹脹、腹痛明顯緩解。3月26日,患者又出現腹痛的臨床表現,未發熱,復查CT提示醫源性結腸瘺,引流管刺破降結腸(圖1B)。經過討論,首先根據血培養結果加強抗感染,再予以夾閉引流管,引流管暫時不予拔出,原穿刺路徑不予以處理(圖1C),等待形成竇道后通過腸鏡予以鈦夾夾閉瘺口。同時在CT引導下置入12F豬尾巴引流管重新經皮行胰腺包裹性壞死穿刺引流(圖1D)。術后患者反復發熱,體溫37~39℃,C-反應蛋白107.00 mg/L、降鈣素原0.67 ng/ml。予每日生理鹽水沖洗引流管,兩次血培養均陰性,經驗性升級抗生素泰能聯合替考拉寧抗感染。因引流效果不佳,4月1日更換雙套管引流,并于4月13日及4月20日分別兩次經雙套管形成的竇道行內鏡清創(圖2A),且在第2次清創后行降結腸瘺內鏡閉合術(圖2B),夾3枚鈦夾,后患者順利出院。2020年5月29日患者返院行ERCP,置入胰管支架解決胰瘺問題,置入膽管支架預防結石阻塞膽道。2020年9月在外科切除膽囊去除病因,10月16日取出胰管及膽管支架。后患者多次返院復查,一般情況均良好。
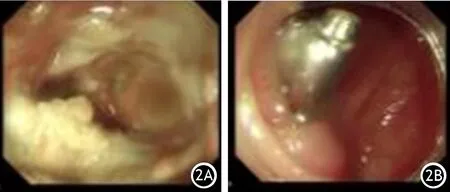
圖2 巨大胰腺包裹性壞死內鏡清創及降結腸瘺鈦夾夾閉術內鏡圖像 2A 經雙套管竇道行內鏡清創;2B 經雙套管竇道再次內鏡清創后行降結腸瘺內鏡下鈦夾閉合術
討論感染性胰腺壞死(infected pancreatic necrosis, IPN)是重癥急性胰腺炎的主要死因。目前IPN的治療方式已經由外科手術轉變為升階梯式的清創引流,后者在術后并發癥的發生率與長期預后方面均顯示出明顯優勢[1]。IPN的治療時機一般延遲至首次出現后至少4周[2],延遲干預可以使壞死組織的引流更容易,減少干預后并發癥的風險。但如果在4周前壞死出現感染或者消化道梗阻等病情變化,干預也可以在早期進行[3-4]。本例患者有壓迫癥狀,包裹物破裂及感染風險高,故在病程的第4周左右進行經皮置管引流,但由于包裹性壞死巨大,體位變動時導致腸管受壓,超聲顯影不清,未能識別腸管最后導致了穿刺損傷造成醫源性結腸瘺。結腸瘺常致腹腔嚴重感染,對結腸瘺患者,外科手術被認為是首選治療方法。此外,經評估也可行內鏡微創處理,常見的有經內鏡置入覆膜支架、鈦夾閉合、內鏡下縫合或組織內注射封閉膠等方式[5]。本例結腸瘺患者未出現明顯腹膜刺激癥及高熱,未表現出明顯腹腔嚴重感染的征象,因此采取內鏡微創方法,成功地在內鏡下使用鈦夾夾閉瘺口,避免了外科手術。
本例患者所帶來的經驗教訓:(1)當出現巨大包裹性壞死時不宜行B超或者CT引導下穿刺,因為巨大的包裹性壞死易壓迫腸管,導致穿刺時易損傷腸管,即便穿刺也應該優先考慮CT下引導穿刺并慎重選擇穿刺路徑。(2)當穿刺損傷腸管時,需要密切關注患者病情變化,若未出現明顯的腹膜炎體征,可以使用內科保守治療補救,暫不拔除引流管,開辟新的通路進行清創,原引流管位置等待形成竇道后內鏡夾閉,可以避免外科手術。若出現彌散的腹膜炎體征及難以控制的感染,則不可盲目保守治療,需要及時外科手術,避免錯過最佳手術時機。
利益沖突所有作者聲明無利益沖突

