經皮左心耳封堵術在心房顫動合并缺血性腦卒中或短暫性腦缺血發作恢復期患者中的安全性和有效性研究
武德崴,王宇彬,李博宇,許驥,尹春琳
經皮左心耳封堵術(LAAC)在臨床中越來越多地被用于非瓣膜性心房顫動(NVAF)患者的缺血性腦卒中(IS)預防治療,尤其在出血高危患者或不能耐受長期口服抗凝藥的患者中,LAAC 的應用更加必要[1]。Watchman 封堵器的批準使用基于PRORECT AF 研究和PREVAIL 研究兩項隨機對照試驗,這兩項研究證實了在NVAF 患者中,LAAC 的安全性和有效性均不劣于華法林抗凝治療。然而,這兩項研究中入選的患者均為IS 風險較低的患者,中位CHADS2評分分別為2.2 分和2.6 分,既往有IS 或短暫性腦缺血發作(TIA)史的患者比例僅20%~30%[2]。
對于高IS 風險和近期內發生IS 的患者,LAAC相關的研究尚不充分。對于CHA2DS2-VASc 評分≥5分的患者,不采取預防措施時,每年IS 風險大于12%,即使進行了正規的抗凝治療,每年的IS 風險依然大于4%[3-4]。并且,IS 恢復期的心房顫動患者若不能接受理想的IS 預防治療,短期內再發IS 的風險依然較高。一些真實人群研究表明,LAAC 能夠在不能耐受長期抗凝治療的患者中預防IS 事件,但增加了手術并發癥。同時,腦血管事件急性期或亞急性期患者的手術風險也會在一定程度上升高,導致LAAC 在這部分人群中的安全性和有效性存在疑問[5]。因此,本研究擬探索在近期發生IS 或TIA 的缺血高風險NVAF 患者中LAAC 的安全性和有效性。
1 資料與方法
1.1 研究對象
本研究連續入選2020 年9 月至2022 年4 月在我中心心房顫動合并IS 或TIA 恢復期行LAAC的患者61 例。所有患者在術前均進行電生理醫師、結構心臟病醫師、神經科醫師及麻醉科醫師多學科會診,評估IS 風險、出血風險、麻醉意外風險,并充分評估患者對口服抗凝藥物的依從性和耐受性后決定是否實施LAAC。入選標準:(1)CHA2DS2-VASc 評分男性≥2 分,女性≥3 分的NVAF 患者;(2)90 d 之內發生過IS 或TIA 事件;(3)存在以下LAAC 的適應證之一:①不能耐受長期抗凝治療的出血風險高危患者;②規范抗凝治療期間[口服華法林者國際標準化比值(INR)達標或足量新型口服抗凝藥(NOAC)]仍出現IS 事件。排除標準:(1)30 d 內發生過IS 或TIA 或出血性腦卒中事件;(2)合并風濕性二尖瓣狹窄、主動脈瓣或二尖瓣機械瓣置換術;(3)IS 發作時美國國立衛生研究院腦卒中量表(NIHSS)評分>8 分者;(4)惡性腫瘤終末期、嚴重肝功能障礙及其他手術禁忌的患者。所有患者均簽署知情同意書。
1.2 手術用藥及手術方法
所有患者術前均接受了充分的抗凝治療,抗凝藥物包括低分子肝素、華法林、NOAC,藥物選擇根據患者的共患疾病決定。對于口服華法林的患者,INR 在術前、術中和術后隨訪過程中需維持在2~3;使用低分子肝素和NOAC 的患者,抗凝劑量根據患者年齡、腎功能進行調整。術前理想的抗凝時間為2~3 周,最少為24~48 h。術前停用1 次口服抗凝藥,術后即刻恢復抗凝治療。
所有患者均在鎮靜條件下進行LAAC,術中行經食道超聲心動圖(TEE)引導。術前給予靜脈推注肝素,目標活化凝血時間為300 s。經右側股靜脈置入房間隔穿刺鞘,房間隔穿刺在X 線透視下完成。穿刺完成后置入豬尾導管行左心耳造影,確定左心耳形狀及開口直徑、深度。選擇合適尺寸的Watchman 封堵器(波士頓科學,美國)覆蓋左心耳口部,隨后行TEE 確認封堵效果,并在X 線透視下牽拉封堵器測試穩定性。最后釋放封堵器,撤出導管,加壓包扎股靜脈傷口。
患者術后觀察1~3 d 后出院,術后常規口服抗凝藥治療45 d。所有患者在術后住院期間及出院后均進行手術相關并發癥的評估,包括殘余分流、器械表面血栓、房間隔穿孔、心包填塞、手術入路出血、封堵器脫落、心肌梗死、心力衰竭等并發癥。并囑患者在出院后出現出血或其他不適時即刻就診。術后45 d 進行常規訪視,行TEE 檢查評估封堵有效性及器械相關血栓。所有TEE 均在我中心進行。若TEE 確認無器械相關血栓,殘余分流量<5 mm,患者即可停用抗凝治療,改為阿司匹林聯合氯吡格雷雙聯抗血小板治療,并維持至術后6 個月,此后改為阿司匹林單藥長期維持。術后6 個月及12 個月再次行定期訪視,此后每年進行1 次隨訪,若有臨床需要,囑患者隨時就診。
1.3 研究終點
本研究的評估終點為LAAC 的安全性和有效性。主要的有效性終點為術后的死亡、心肌梗死、IS 及體循環栓塞事件的復合終點;安全性終點為國際血栓形成和止血協會定義的大出血及與臨床相關的非大出血。
1.4 統計學方法
連續性正態分布變量以均數±標準差表示,非正態分布變量用中位數(P25,P75)表示。分類變量以頻數(率)表示。
2 結果
2.1 61 例IS 或TIA 恢復期合并心房顫動患者的基線資料(表1)
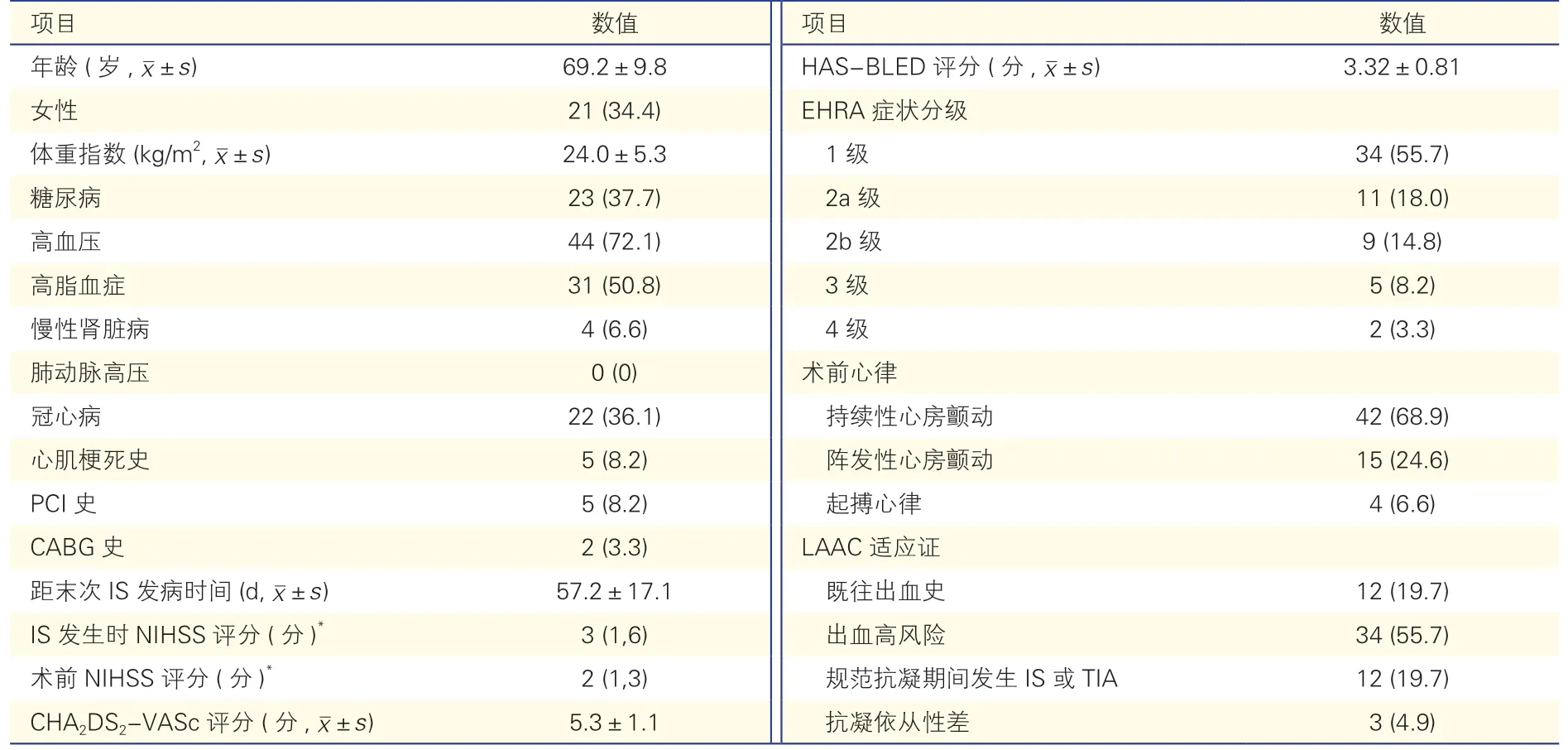
表1 61 例IS 或TIA 恢復期合并心房顫動患者的基線資料[例(%)]
共61 例IS 或TIA 恢復期合并心房顫動的患者行LAAC,女性21 例(34.4%),平均年齡(69.2±9.8)歲。CHA2DS2-VASc 評分為(5.3±1.1)分,HASBLED 評分為(3.32±0.81)分,距離末次IS 發病時間為(57.2±17.1)d,患者IS 發病時NIHSS 評分為3(1,6)分,術前NIHSS 評分為2(1,3)分。術前持續性心房顫動患者42 例(68.9%),陣發性心房顫動15 例(24.6%),起搏心律4 例(6.6%)。在LAAC適應證中,既往出血史12 例(19.7%,包括消化道出血、腦出血),出血高風險患者34 例(55.7%),規范抗凝治療期間發生IS 或TIA 患者12 例(19.7%),抗凝依從性差3 例(4.9%)。
2.2 患者術前超聲心動圖特征及術中指標(表2)

表2 61 例患者術前超聲心動圖特征及術中指標[例(%)]
術前TEE 評估中,左心耳內徑長度為(23.2±11.4)mm,開口內徑為(17.3±2.3)mm,12例(19.7%)患者呈現左心耳內高凝狀態。在所有患者中,有3 例(4.9%)因左心耳形態異常或開口過大未能成功放置封堵器,58 例(95.1%)患者封堵器成功釋放。同期行心房顫動射頻消融術患者45 例(73.8%),同期行經皮冠狀動脈介入治療(PCI)患者2 例(3.3%),同期行經皮卵圓孔未閉封堵術1 例(1.6%)。手術患者中,監護麻醉47 例(77.0%),全身麻醉14 例(23.0%),氣管插管5 例(8.2%),麻醉時間為(55.4±19.1)min。
2.3 患者術后超聲心動圖數據及短期隨訪抗栓方案(表3)
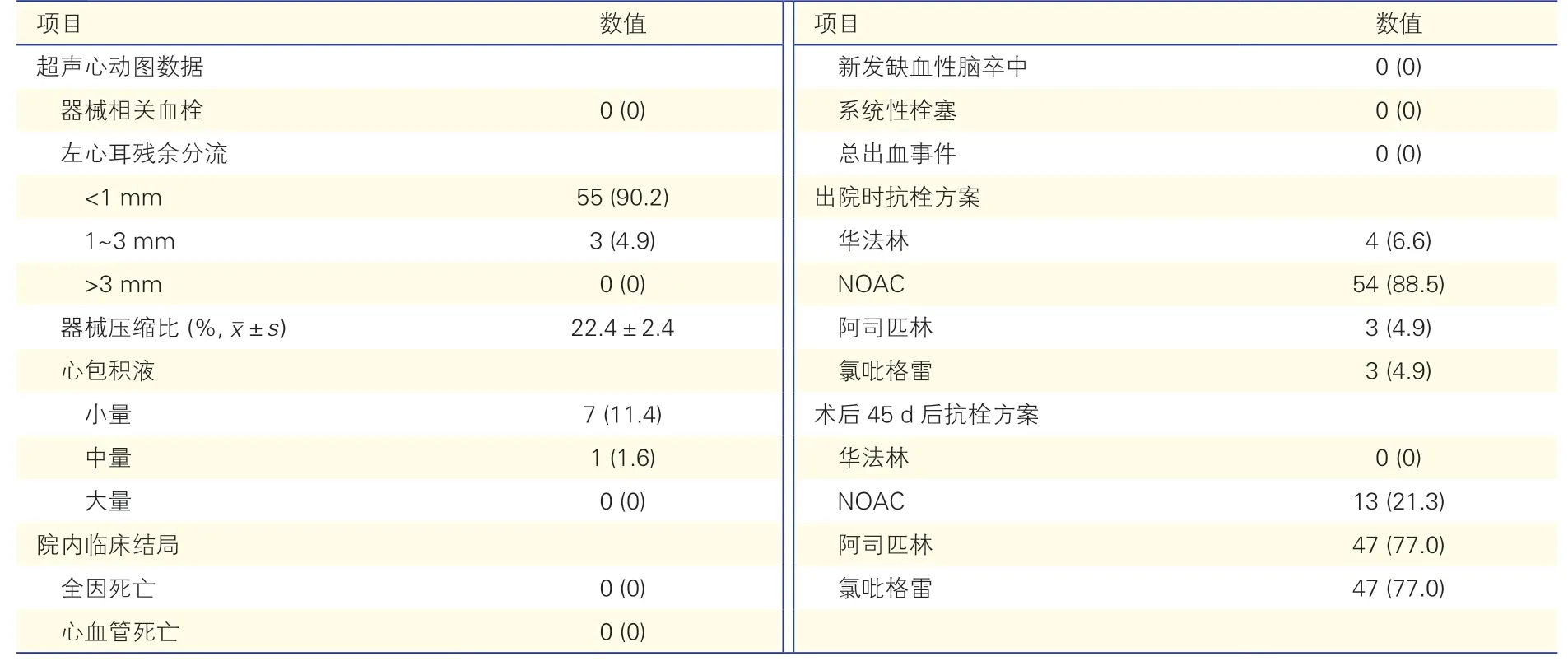
表3 61 例患者術后超聲心動圖數據及短期隨訪抗栓方案[例(%)]
所有患者術后即刻行TEE 評價,無患者發生即刻器械相關血栓,器械壓縮比為(22.4±2.4)%。55例(90.2%)未出現或有小于1 mm 的術后左心耳殘余分流,3 例(4.9%)出現1~3 mm 左心耳殘余分流,沒有患者出現>3 mm 左心耳殘余分流。7 例(11.4%)出現小量心包積液,1 例(1.6%)出現中量心包積液,這些患者均為行射頻消融+LAAC 一站式手術患者,其中5 例為持續性心房顫動患者;無大量心包積液或行心包穿刺引流術。住院期間無患者出現全因死亡、心血管死亡、系統性栓塞、新發IS、出血等不良事件。
出院時,因腎功能不全口服華法林抗凝4 例(6.6%),因同期行PCI 或出血風險高口服阿司匹林聯合氯吡格雷雙聯抗血小板治療3 例(4.9%),54 例(88.5%)患者口服NOAC(利伐沙班、艾多沙班、達比加群)抗凝治療,其中3 例(4.9%)患者因抗凝治療期間出現口腔、鼻黏膜、泌尿系統出血停止抗凝,改為抗血小板治療。術后45 d,48 例(78.7%)患者改為口服阿司匹林聯合氯吡格雷雙聯抗血小板治療,13 例(21.3%)因IS 高風險繼續口服NOAC 抗凝治療。1 例患者術前曾有下肢靜脈血栓病史,故抗凝治療延長至術后3 個月。
2.4 長期隨訪
所有患者均進行了門診或電話隨訪,平均隨訪時間為(10.7±4.4)個月。隨訪過程中,1 例(1.6%)患者于術后7 d 因腎功能衰竭發生猝死,1 例(1.6%)患者術后3 個月發生急性心肌梗死,并于發病3 周后死亡,1 例(1.6%)患者術后6 個月再次發生IS,3 例(4.9%)患者在抗凝治療期間出現口腔、鼻黏膜、泌尿系統出血,無大出血事件發生。
3 討論
本研究探索了在IS 或TIA 后早期行LAAC 治療的安全性與可行性。本研究入選了NIHSS 評分≤8分的IS 或TIA 患者,具有心原性腦卒中的高危因素,同時存在維持抗凝的相對禁忌,或在規范抗凝治療過程中依然反復發作IS 或TIA。對這些患者在IS 或TIA 后3 個月內行LAAC 治療,95.1%成功置入左心耳封堵器械,2 例患者分別于術后7 d 和3 個月后死亡,1 例患者再發IS,無大出血事件發生。
Watchman 左心耳封堵器在心房顫動患者IS 二級預防中的價值在PROTECT 研究和PREVAIL 研究中已被證實[2,6],在CHA2DS2-VASc 評分高危患者中,與口服抗凝藥相比,LAAC 能夠取得類似的IS 預防效果[7-9]。在維持抗凝禁忌的患者中,2020 年歐洲心臟病學會(ESC)心房顫動治療指南推薦將LAAC作為備選的IS 預防方案。后續發表的PRAGUE-17研究進一步提示,在心原性腦卒中高危的心房顫動患者中,LAAC 在預防IS 或TIA 方面與NOAC 有相似的療效,并有降低主要出血風險的趨勢[10]。因此,LAAC 已成為心房顫動患者IS 預防的有效治療方案,在存在抗凝禁忌患者或出血高危患者中尤其重要。
研究表明,心原性腦卒中發生后,若不進行規范抗凝治療,心房顫動患者14 d 內IS 的再發率每天高達0.5%~1.3%[11]。目前指南推薦,心原性腦卒中發生后,應根據患者IS 嚴重程度,充分評估出血風險后,盡早啟動抗凝治療。然而對于合并出血高風險的患者,如既往存在腦出血病史、淀粉樣腦血管病、消化道出血病史等患者,抗凝治療的應用率很低,即便啟動了抗凝治療,后續發生的出血并發癥也會抵消IS 預防帶來的獲益。此外,有研究顯示,對于心原性腦卒中患者,接受規范口服抗凝藥后1年內IS 再發率高達9.8%[12],部分心房顫動伴心原性腦卒中高危患者雖然已經接受了規范抗凝治療,但仍反復發作心原性腦卒中,IS 后短期內強化IS 二級預防治療的需求同樣迫切。
關于擇期手術,目前指南建議應在急性IS 3 個月后進行。其主要原因包括梗死區域組織軟化,易發生出血轉化,梗死區域腦血管調節機制紊亂,麻醉狀態和血壓變化可能加重腦組織損傷等。部分研究顯示,IS 后3 個月內行擇期手術會增加術后心腦血管事件的發生率,且發生率與梗死面積呈正相關。然而,也有研究顯示,對于因腦血管狹窄引起的IS患者,IS 后3 個月內行頸動脈內膜剝脫術解除血管狹窄因素能夠改善患者預后,提示IS 急性期改善IS誘因能夠為IS 患者帶來獲益。但是,目前并未研究探討IS 急性期行LAAC 的安全性和有效性。
既往研究顯示,對于NIHSS 評分≤8 分的患者,IS 急性期早期啟動抗凝治療不顯著增加出血轉化風險[11]。因此,本研究入選了IS 或TIA 發病后30~90 d,NIHSS 評分≤8 分的患者,對于存在長期抗凝治療禁忌或規范抗凝治療過程中反復發生IS 或TIA 的患者行LAAC 治療,并探討其安全性和有效性。同時,由于IS 恢復期內腦血流調節功能尚未完全恢復,全身麻醉帶來的腦血流變化可能加重腦出血[13-14],因此本研究盡量避免氣管插管及全身麻醉,77.0%的患者采用監護麻醉。術后短期未出現新發IS、出血等不良事件,提示在這一人群中IS 或TIA 后早期行LAAC 治療的安全性。后期隨訪顯示,1 年內再發IS 風險僅為1.6%,提示該人群中早期行LAAC 對IS二級預防的有效性。
本研究中患者術后并發癥發生率較低,7 例(11.4%)患者出現小量心包積液,1 例(1.6%)患者出現中量心包積液,這些患者均為行射頻消融+LAAC一站式手術患者,其中5 例為持續性心房顫動患者。患者在射頻消融術后,LAAC 術前行TEE 即已證實存在心包積液,術后心包積液量未明顯增加,考慮與射頻消融手術相關,與既往文獻報道發生率類似[14]。對于小量心包積液患者,術后抗栓策略未進行調整,隨訪證實心包積液減少或消失,未出現其他不良事件。中量心包積液患者暫緩抗凝治療,術后次日復查超聲心動圖證實心包積液未增加后,重啟標準抗凝治療。
術后45 d 復查TEE,未發現器械相關血栓。1例患者術前曾有下肢靜脈血栓病史,故抗凝治療延長至術后3 個月。12 例(19.7%)患者為出血低危患者,LAAC 術前在規范抗凝治療期間仍反復發生心原性腦卒中,故在術后繼續口服NOAC 治療預防IS事件。然而,本研究尚未證實規范抗凝聯合LAAC治療能否進一步改善這一人群的缺血事件,尚待進一步研究探索。
本研究存在以下局限性:本研究作為觀察性研究,可能存在報告偏倚,但本研究數據采集過程和評估過程均經過神經病學、麻醉學、心臟病學多學科評估,最大程度地避免偏倚;未能進行隨機對照研究,尚不能明確手術的凈獲益;此外,本研究為單中心數據,單中心經驗尚不能推廣至所有中心。
綜上所述,本研究提示,LAAC 在心房顫動合并IS 或TIA 恢復期患者中是安全、有效的,對于長期抗凝禁忌或規范抗凝后仍發生心原性腦卒中的心房顫動患者,可考慮早期行LAAC。
利益沖突:所有作者均聲明不存在利益沖突

