雙酚A通過MLL1調控子宮內膜蛻膜化分子標志物HOXA10表達的分子機制
劉慧敏 熊峣 文雪 耿婷 張銘 陳慧君 張元珍
雙酚A(bisphenol A,BPA)是一種廣泛應用于工業生產的增塑劑,已有多種證據表明BPA是一種環境內分泌干擾物(endocrine disrupting chemicals, EDCs),可影響女性生殖功能[1]。HOXA10是子宮內膜蛻膜化的標志基因,HOXA10基因缺失的小鼠因蛻膜化缺陷導致胚胎著床失敗而出現反復妊娠流產[2]。HOXA10的啟動子區域有多個可以與ERα結合的雌激素反應原件(estrogen response element, ERE)。雌激素受體ERα作為HOXA10的轉錄因子直接調控HOXA10的表達,但ERα對HOXA10的轉錄調控作用受多種因素的影響[3]。課題組前期初步研究發現BPA影響混合譜系白血病組基因MLL1及子宮內膜蛻膜化相關基因的表達[4-5],但尚不清楚在子宮內膜間質細胞蛻膜化過程中,BPA是否通過調控MLL1的表達,進而影響MLL1與ERα的結合及其對ERα靶基因HOXA10的轉錄激活作用。為驗證MLL1在BPA調控HOXA10表達中的關鍵作用,將進一步探討不同BPA濃度暴露影響蛻膜化分子標志物HOXA10表達的具體分子機制。
資料與方法
一、實驗室資料
1.細胞培養:永生化的人子宮內膜基質細胞系(HESCs)從美國典型培養物保藏中心(ATCC,Cat#CRL-4003)獲得,細胞用含有10%活性炭處理胎牛血清(CS-FBS)的無酚紅DMEM/F12(Procell,PM150316)培養基在37 ℃與5%CO2條件下培養。
2.體外蛻膜化及雙酚A暴露:HESCs在完全培養基中培養至達到70%~80%,在2%CS-FBS培養基中饑餓24小時。向培養基中加入10 nM 雌二醇(E2,Sigma)、1μM甲羥孕酮(MPA,Sigma)、0.5 mM環狀單磷酸腺苷(cAMP,Sigma)和不同劑量(分別為0,10 pM,10 nM,10μM;選擇人群中普遍暴露的BPA濃度,即環境相關的濃度10nM,以及低劑量組10pM和高劑量組10μM進行實驗。)的雙酚A(BPA,Sigma)的2%CS-FBS培養基處理,每隔一天更換一次培養基,蛻膜化處理6 d后收獲細胞進行后續實驗[4-5]。
3.細胞增殖測定:取HESC對數生長期的單層貼壁細胞,0.25%胰酶消化,1000 r/min, 5min后離心收集細胞,以1.0×103/孔的密度植入于96孔板中,每組5個復孔,于37 ℃,5%CO2培養箱中培養。細胞貼壁后,培養6天時每孔分別加入10 μL的CCK8溶液,細胞培養箱中繼續培養2 h,酶標儀測定450 nm的光密度值。相對增殖速率=ODBPA組/OD溶劑組×100%。
4.RNA提取和實時定量PCR:使用RNA提取試劑盒從細胞中提取總RNA,然后用HisScript II Q RT SuperMix(Vazyme),將樣品中1 μg RNA逆轉錄合成cDNA用于qPCR。ChamQTMSYBR qPCR預混液(Vazyme)在CFX Connect Real-time PCR系統上進行定量實時PCR(qPCR)。qPCR的引物序列示于表1。mRNA的表達水平歸一化至GAPDH,使用2-ΔΔ ?t方法進行分析。
5.蛋白印跡實驗:用RIPA裂解緩沖液(Beyotime)裂解不同組的細胞,所得蛋白裂解物用BCA蛋白檢測試劑盒測定其蛋白質濃度。用10%SDS-PAGE凝膠分離等量的蛋白質后轉移到PVDF膜上,用5%的脫脂牛奶封閉2 h。將膜分別與兔抗MLL1抗體(1:1 000; Bethyl, 貨號A300-374A),小鼠抗HOXA10抗體(1:500; Santa Cruz, 貨號AB_10649855),小鼠抗GAPDH(1:6 000, Proteintech, 貨號AB_2107436)。TBST洗滌后與相應的過氧化物酶偶聯的二抗在室溫下孵育1小時。使用高靈敏度ECL化學發光檢測試劑盒經ECL發光成像系統(Tanon, 上海)進行檢測,使用Image J對條帶強度進行量化。
6.免疫共沉淀(CoIP):按照免疫沉淀試劑盒(Sangon Biotech)制造商的說明,進行CoIP。將細胞在超聲條件下1×裂解緩沖液中裂解,將等量的蛋白質用于免疫沉淀。加入適量的目的基因的抗體和非特異性IgG,并在4℃下孵育過夜。將混合液添加到18μLProtein A/G-瓊脂糖柱中,在4℃下孵育過夜。用IP緩沖液洗滌幾次后,用1×上樣緩沖液將結合的蛋白洗脫,最后通過SDS-PAGE凝膠電泳進行分析,用于免疫印跡的抗體是抗ERα的兔抗體(稀釋度1:1 000; abcam),兔抗MLL1抗體(稀釋度1:1 000; Bethyl, A300-374A)。
7.染色質免疫共沉淀(ChIP):按照CST公司的ChIP試劑盒(#56383)說明操作:先用1%甲醛將DNA結合蛋白與DNA交聯,甘氨酸終止交聯;超聲下裂解細胞,剪切染色質;取出2%輸入對照樣品;用MLL1抗體、IgG抗體與含DNA的染色質相結合,并加入Protein G磁珠使其沉淀下來,多次洗滌沉淀物;通過解交聯去除結合的蛋白質純化DNA;以得到的DNA為模板對HOXA10啟動子上多個ERE進行RT-PCR擴增,引物序列見表1。
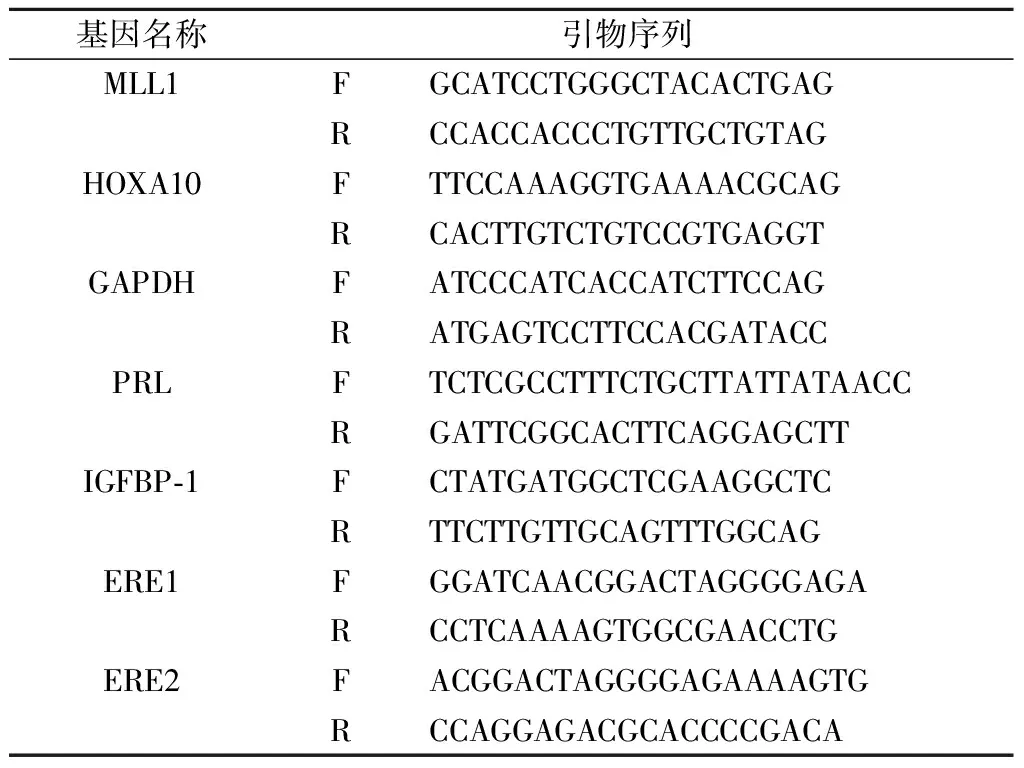
表1 用于RT-PCR,ChIP的引物列表
結 果
一、不同濃度BPA對HESC細胞增殖的影響
CCK-8實驗表明10 pM和10 nM的BPA暴露后,HESC細胞的增值能力并沒有降低,反而稍微升高。但BPA濃度為10 μM時,細胞的增殖能力與溶劑組無顯著差別(圖1)。以上結果表明,BPA可能以非線性方式影響HESC細胞的增殖,且這三種濃度的BPA均不會對HESC細胞增殖造成損傷。
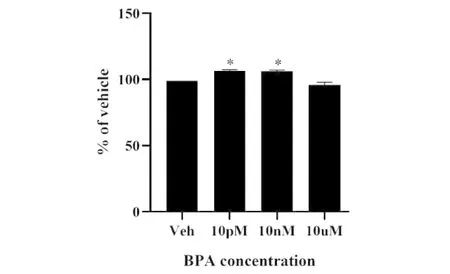
Note:Data are from four independent experiments.Veh=Vehicle, 10 pM、10 nM、10 μM indicate the concentration of BPA, *P<0.05 vs Vehicle
二、BPA暴露對蛻膜化過程中HESCs細胞MLL1、HOXA10表達的影響
蛻膜化處理的細胞中蛻膜化標志物IGFBP1和PRL的mRNA含量顯著升高(圖2A),表明體外蛻膜化模型成功建立。不同濃度BPA(0、10pM、10nM、10μM)暴露后,蛻膜化細胞中的MLL1和HOXA10 mRNA的表達水平降低,在10nM和10μM處差異具有顯著性(圖2B),Western Blot結果與qPCR一致(圖2C)。
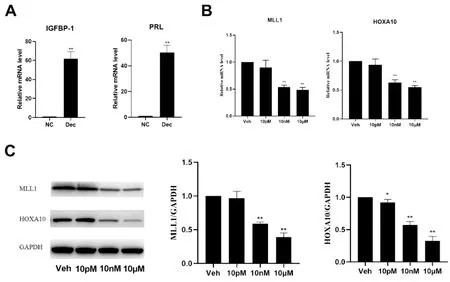
Note:Figure A shows RT-qPCR analysis of IGFBP-1 and PRL mRNA levels after decidualization treatment; Figure B shows RT-qPCR analysis of MLL1 and HOXA10 mRNA levels after BPA treatment.expression of in BPA concentration.Figure C shows Westernblot analysis of MLL1 and HOXA10 protein levels after BPA treatment.expression of in BPA concentration.Data are from four independent experiments; NC=normal control, Dec=decidualization, *P<0.05 vs NC or Veh
三、不同濃度BPA暴露后MLL1與ERα的結合情況
為了探討MLL1是否為ERα的共結合因子,通過用ERα和MLL1抗體進行雙向CoIP實驗,以MLL1抗體進行IP時,隨著BPA濃度的升高ERα與MLL1的結合降低,同樣的,以ERα的抗體進行IP時也得到了同樣的結果,該結果也說明了MLL1與ERα為調控蛻膜化的共作用因子,且BPA的暴露會降低二者的結合(圖3)。
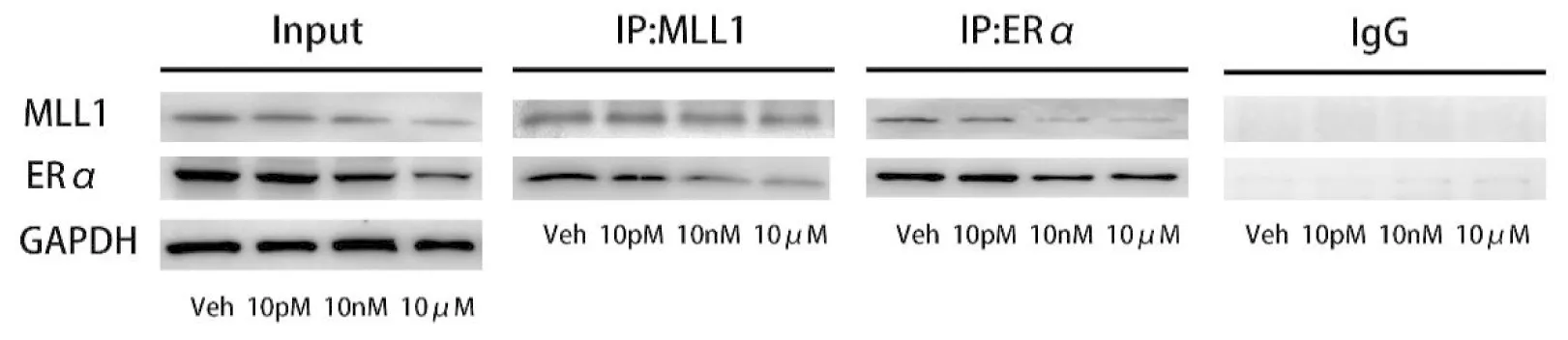
Note:the picture shows the representative protein bands from the three experiments, Input = input control, IP = immunoprecipitation
四、MLL1、ERα共作用因子在HOXA10啟動子區的富集情況
HOXA10啟動子在轉錄起始位點上游的前3000個核苷酸內包含多個雌激素反應元件,包括ERE1和ERE2(圖4A),通過進行ChIP實驗發現MLL1、ERα共作用因子在ERE1、ERE2區域均有富集。與溶劑組比較,ERE1處富集效率在10 nM時下降了約54%,10 μM時下降了約57%,ERE2處富集效率在10 nM時下降了約47%,10 μM時下降了約52%,差異具有顯著性(圖4B)。
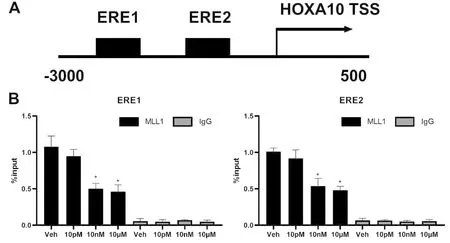
Note:Figure A shows schematic diagram of ERE1 and ERE2 in the HOXA10 promoter, TSS = transcription start site; Figure B shows enrichment of MLL1 and ERα cofactor in ERE1 and ERE2 regions, data are from three independent experiments, IgG as a negative control group, *P<0.05 vs Veh
討 論
BPA用于合成聚碳酸酯和環氧樹脂等材料。BPA可使材料透明度高、防沖擊、耐用輕巧、耐熱防腐蝕,常用于制造礦泉水瓶、食品包裝、光盤等產品,是世界上產量最高的化學品之一,年產量高達100億千克,每年大約有100噸BPA釋放到大氣中[6]。流行病學資料顯示,在95%的人群尿液樣本中檢測到BPA,濃度≥0.1 ng/mL(0.44 nM)[7],對成人血液樣本進行分析發現人體血液內BPA濃度范圍為0.2~10 ng/mL(0.9~44 nmol/L)[8]。BPA可以在正常使用條件下從塑料制品中浸出,通過消化道、呼吸和皮膚接觸而進入人體,進入人體后的BPA會被輸送到肝臟進行迅速的“首過代謝”,生成無活性的結合雙酚A,這一過程顯著降低了血液中的雙酚A濃度,但研究表明未結合的雙酚A仍舊可以在循環中保持數小時甚至數天[9]。對成人血液樣本進行分析后發現,生物活性形式的非結合型BPA在血液中平均濃度為1~3 ng/mL(4~13 nmol/L)[3]。在本次實驗中我們選擇10 pM、10 nM、10 μM三種的濃度來進行研究,其中10 pM和10 nM為環境相關的濃度,10 μM則代表了高暴露人群人體組織中的雙酚A濃度,三個濃度對子宮內膜基質細胞的增殖均沒有損害(圖1)。BPA對蛻膜化的影響近年來一直受到國內外學者所關注,在子宮內膜異位癥等蛻膜化損傷相關疾病的患者體內血清BPA濃度較高。Mark等發現BPA在10 μg/mL(43.8 μM)和20 μg/mL(87.6 μM)時會對蛻膜化造成損傷,但在較低劑量下則不會[10],Aghajanova L也發現50 μmol/L和100 μmol/L的高濃度BPA會對蛻膜化造成損傷[11],但這些研究中BPA的濃度遠遠高于在人群中可以檢測到的濃度。此外,BPA 對子宮內膜蛻膜化影響的研究結果也不一致。Mannelli等人[12]先對子宮內膜間質細胞進行蛻膜化處理,再將其暴露于BPA(1 μM、1 nM、1 pM)24 h,發現 1 μM的BPA可降低PRLmRNA的表達。Forte等人[13]發現當子宮內膜間質細胞單獨給予BPA處理或者孕酮處理24 h之后給予 BPA 暴露(10 uM、10 nM、10 pM),都會使 PRL和IGFBP-1mRNA 的表達不同程度的升高。這些研究結果的差異可能是由于藥物種類、給藥方式或藥物刺激時間的不同而造成的。由于“低劑量效應”的概念逐漸被認為是EDCs影響人體健康的一大普遍特征,更多的研究開始關注于低濃度的EDCs對疾病的影響[14]。本實驗結果表明子宮內膜基質細胞在給予cAMP、MPA、E2蛻膜化處理,并同時暴露于10 nM和10 μM BPA時會使細胞內HOXA10表達降低(圖2),這也就意味著BPA對蛻膜化的影響不僅是在高濃度下,在較低的環境相關的濃度下,BPA也會對蛻膜化造成損害,驗證了BPA的“低劑量效應”。
本課題前期研究發現BPA影響子宮內膜間質細胞蛻膜化及其分子標志物的表達,但具體分子調控機制尚不明確[4]。HOXA10是子宮內膜蛻膜化的標志基因,HOXA10基因缺失的小鼠因蛻膜化缺陷導致胚胎著床失敗而出現反復妊娠流產[2]。混合譜系白血病組基因MLLs是人類組蛋白甲基化轉移酶,包括MLL1、MLL2、MLL3、MLL4、SET1A和SET1B等,它們的作用是催化組蛋白H3K4的甲基化,促進靶基因的轉錄激活。MLL1蛋白分子上有與ERα結合的結構,可作為ERα的共同作用因子,參與對ERα下游靶基因的轉錄調控[15]。HOXA10是一種轉錄調節基因,在胚胎植入過程中起著重要作用,Nancy Ashary等研究認為HOXA10在胚胎植入過程中有三個重要作用:獲得子宮內膜的容受性;響應來自胚泡的信號,使子宮內膜蛻膜化;促進滋養細胞的侵襲和胎盤形成[16]。近年來,HOXA10的下游效應機制[17]以及上游調控機制[18]引起了大家的關注,這些研究不僅說明了HOXA10在蛻膜化過程中扮演著重要角色,也提示明確蛻膜化中HOXA10的上下游相關機制的必要性。MLL1是一種H3K4組蛋白賴氨酸甲基轉移酶,H3K4的甲基化已被證明與多種真核生物的轉錄激活相關,參與多種生物功能,對全基因組組蛋白修飾的研究發現H3K4的甲基化參與調控子宮內膜蛻膜化相關基因的表達變化[19]。以女性蛻膜化損傷為特征的習慣性流產的患者子宮內膜中MLL1表達水平顯著降低[9]。由MLL1組成的H3K4甲基轉移酶復合物是HOX基因激活所必需的,在細胞周期調控中,HOX基因(HOXA5、HOXA7、HOXA10)可招募MLL1蛋白到HOXA基因的啟動子序列上,引起H3K4組蛋白甲基化修飾和HOXA基因的轉錄激活[20]。另有研究提示在急性髓性白血病中,MLL1是ERα的共作用分子,ERα可結合MLL1蛋白,促進MLL1 結合到HOXA10啟動子上來調控HOXA10的表達[21],在子宮內膜蛻膜化過程中,可能也存在類似的分子作用機制。本研究的結果發現在蛻膜化的過程中,MLL1確實會與ERα結合,并作為其共同作用因子調控HOXA10表達,且BPA的暴露減少MLL1與ERα的結合(圖3),不僅如此,MLL1和ERα在HOXA10的啟動子區ERE的富集也與濃度呈逆相關(圖4)。總之,環境濃度BPA和高濃度BPA暴露使MLL1和ERα對靶基因HOXA10的轉錄調控作用減弱,最終導致HOXA10 表達降低,影響子宮內膜蛻膜化。這為探索BPA暴露影響子宮內膜蛻膜化分子標志物表達的機制提供了新的研究思路,也提示MLL1作為ERα的共同作用因子可能還調控其它蛻膜化相關基因的表達。BPA本身也具有擬雌激素作用,可直接與ERα結合進而調控HOXA10,故BPA可直接影響或通過MLL1相關機制間接影響蛻膜化。
子宮內膜間質的蛻膜化對子宮內膜容受性的建立起重要作用,而子宮內膜容受性的建立又是胚胎成功著床的必要條件,因此揭開蛻膜化損害所涉及的分子機制一直是生殖醫學領域的研究主題。課題組前期實驗通過使用MLL1的抑制劑和siRNA證明MLL1在蛻膜化中起重要作用[9],并發現BPA對蛻膜化造成損害可能與MLL1有關[5],而本文則發現BPA是通過降低MLL1和ERα共作用因子的結合并減少其在HOXA10啟動子區的富集從而減少HOXA10的表達,對蛻膜化造成損傷。該發現有助于加深對BPA影響子宮內膜蛻膜化分子機制的了解,并引起人們對BPA損傷女性生殖功能的關注。

